SLE合并胰腺微囊性囊腺瘤和升结肠腺癌1例报道并文献复习
2018-01-23尤国华王云检张璐阳珉郑州大学附属肿瘤医院河南省肿瘤医院肝胆胰外科河南郑州450000
尤国华,王云检,张璐阳,张 珉郑州大学附属肿瘤医院(河南省肿瘤医院)肝胆胰外科,河南 郑州 450000
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种包括遗传、性激素、环境、感染、药物、免疫反应等多因素参与的特异性自身免疫病。随着治疗手段和患者生存率的不断提高,SLE合并恶性肿瘤的报道越来越多,本文报道了1例SLE合并胰腺微囊性囊腺瘤和升结肠腺癌的病例,并就此病例进行文献回顾和总结。
病例患者,女,54岁,以“体检发现胰腺占位10余天”为主诉入院,10 d前患者因从座位起身站立后出现短暂黑懵,就诊于外院,MRI检查显示:脑血管狭窄。上腹部增强CT提示:胰体尾占位,住院治疗1周后脑部症状好转,既往偶有黑便。患2型糖尿病6年余,平时服用格列喹酮30 mg,早晚各半片。患高血压3年余,收缩压最高150 mmHg,平时服用美托洛尔片:0.5 mg/次,2次/d,贝那普利片:晨起1片/d。患SLE 30余年,曾有面部蝶形红斑,治疗后好转,伴日光过敏、口腔溃疡、抗核抗体阳性。曾服用强的松,最近服用甲泼尼松龙片1片/次,1次/d,5年前查出患有自身免疫性肝病。20年前发现深静脉瓣关闭不全,使用弹力袜治疗后好转。2015年11月曾行“双眼白内障”手术。我院检验示:乙肝(-),丙肝(-);部分凝血酶原时间32.20 s;凝血酶时间19.00 s;纤维蛋白原1.96 g/L,总胆红素5.0 μmol/L;直接胆红素3.2 μmol/L;总胆汁酸9.3 μmol/L;谷丙转氨酶27 U/L;谷草转氨酶23 U/L;尿素10.3 mmol/L;肌酐89 mol/L;尿酸377 μmol/L;葡萄糖11.0 mmol/L;前白蛋白 0.484 g/L;白细胞5.54×109L-1;红细胞3.03×1012L-1;血红蛋白63 g/L;血小板221×109L-1;中性粒细胞百分比82.6%;淋巴细胞百分比13.20%;肌酐89 μmol/L;尿酸377 μmol/L;葡萄糖11.0 mmol/L;CEA 3.63 ng/ml;AFP2.52 ng/ml;CA19-9 50.29 μ/ml,院外CT会诊:(1)胰腺体部肿块,考虑胰腺癌,建议结合临床;(2)双肾多发囊肿;(3)提示脂肪肝;(4)胸部CT扫描未见明显异常。院外MRI影像学会诊:(1)脑内多发点状白质缺血性脱髓鞘改变;(2)C6-7椎间盘脱出;(3)头部MRA未见明显异常。PET-CT示:(1)升结肠局部不规则增厚,代谢升高,恶性病变(结肠癌?)可能性大,请结合肠镜;(2)胰腺体尾部不规则低密度影,代谢稍升高,良性占位性病变可能性较大,请结合临床(见图1);(3)左下肺结节影,代谢未见异常,请随访。双肺下叶多发斑片影,代谢未见异常,考虑炎性病变。双上肺多发肺大泡;(4)纵膈多发软组织结节影,代谢未见异常,考虑多发淋巴结良性增大;(5)左肾上腺低密度影,代谢未见异常,考虑良性病变(肾血管平滑肌脂肪瘤?)双肾多发囊肿;(6)子宫体积缩小,代谢未见异常,请结合临床。肠镜检查回示:(升结肠)腺癌(见图2)。术前诊断:(1)升结肠肿瘤;(2)胰体尾肿瘤;(3)系统性红斑狼疮;(4)高血压病;(5)糖尿病;(6)白内障术后。术中探查见:肝脏有轻度硬化,肝外胆管直径约0.7 cm,胰体尾部可触及一约4.5 cm×4.0 cm×3.0 cm囊实性肿瘤,侵犯脾静脉。升结肠中部触及一肿块约4.5 cm×3.5 cm×3.0 cm,浸透浆膜,未及侧腹壁(见图3),肠系膜根部未见肿大淋巴结,腹腔脏器未见明显转移灶,余脏器未见明显异常,无腹水。行“胰体尾切除加脾脏切除术加右半结肠切除术”,术中出血2 000 ml,术中输悬浮红10 U,冰冻血浆800 ml。术后病理:(右半结肠)溃疡型中-低分化腺癌,侵出外膜。未见肯定的脉管内癌栓及神经侵犯。各切缘干净。胰腺肿物及另送胰体尾符合微囊性囊腺瘤。另送脾脏未见明确特殊。(肠周淋巴结)0/1,(另送大网膜)未累及。免疫组化:CD34血管(+),CD31血管(+),D2-40-(见图4~5)。
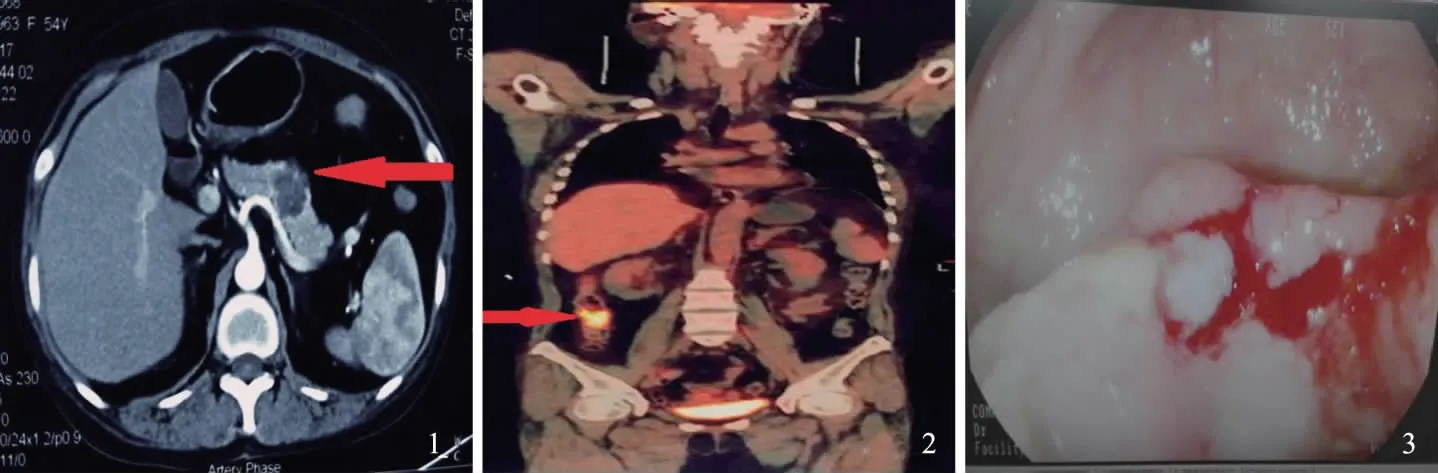
图1 胰体尾部占位;图2 升结肠壁局部不规则增厚,最厚处厚约13 mm,放射性摄取升高,SUV最大值10.6;图3 肠镜下见升结肠溃疡型肿物4 cm×3 cmFig 1 The body and the tail of the pancreas; Fig 2 Ascending local irregular thickening of the colon wall, the thickest wasabout 13 mm, radioactive intaking increased, the maximum SUV was 10.6; Fig 3 Ascending colon ulcer type mass were4 cm×3 cm under colonoscopy
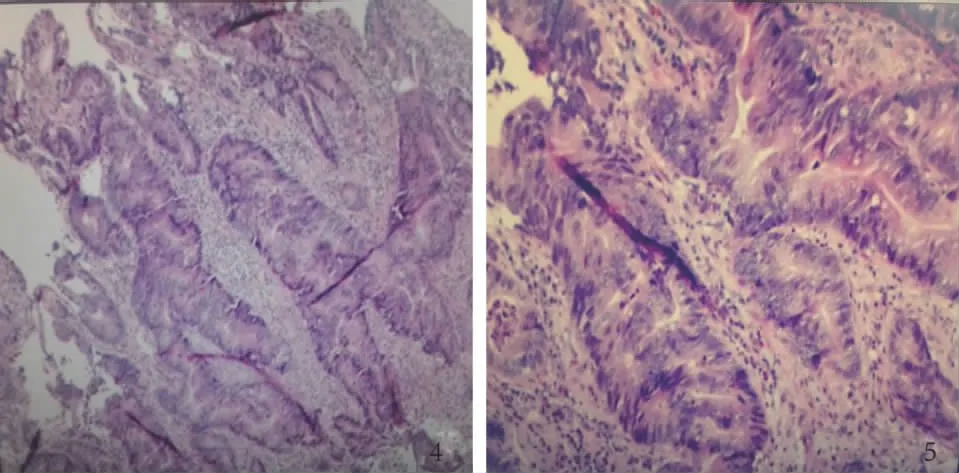
图4 升结肠肿物(HE 200×);图5 胰腺肿物 (HE 200×)Fig 4 Ascending colon tumor (HE 200×);Fig 5 Pancreatictumor (HE 200×)
讨论随着SLE患者治疗效果的提升,许多学者越来越意识到SEL和恶性肿瘤有某种相关性联系,但各学者的研究结果并不相同。不同类型的恶性肿瘤在SLE患者中的发生率比一般人群恶性肿瘤的发生率增加2.7%~25%[1]。国外9个大规模定群研究的结果示,SLE患者恶性肿瘤的发生率为2.7%~11.2%[2-3],国内报道SLE患者肿瘤发生率为2.1%~5.1%[4-5],目前研究达成共识的是SLE合并淋巴瘤和肺癌的发生率明显较普通人群升高,BJÖRNDAL通过对瑞典1964-1995年的5 715例SLE患者的数据分析后认为,SLE合并肿瘤的整体风险增加了25%(SIR=1.25,95%CI:1.14~1.37),而淋巴瘤构成了其最主要的风险。患非霍奇金淋巴瘤(NHL)的风险几乎增加3倍(SIR=2.86,95%CI:2.86~1.96)[6]。但CHUN等[7]认为,肿瘤发生的危险性与普通人群差异无统计学意义。SLE合并肿瘤一般多发生于40岁以上,本例患者54岁,40岁以上发病的SLE尤其是中老年患者当出现SLE难以解释的临床表现,应进行全面的检查和随访,以便尽早发现恶性肿瘤,在有手术指证并排除手术禁忌的情况下首选手术治疗。SLE多先于肿瘤发生或同时发生,BERNATSKY等[8]针对16 409例SLE患者为期7.4年的观察显示,SLE合并肿瘤的概率略微高于正常人群,但却有明显增加罹患NHL的风险,还会增加外阴癌、肺癌、甲状腺癌、肝癌的风险,但其研究显示,SLE患者罹患乳腺癌、子宫内膜癌、卵巢癌等激素相关性肿瘤的风险降低,肿瘤多发生于SLE的8~15年之后。本例患者患系统性红斑狼疮30余年。
SLE患者继发肿瘤的发病机制目前众说纷纭,总结起来有以下几点因素:(1)免疫异常:SLE患者在其长期治疗过程中应用了多种免疫抑制剂的同时也有损于淋巴系统的免疫监视功能,致使体内细胞免疫与体液免疫功能紊乱,从而降低了机体对肿瘤细胞的监视和清除能力[9]。另有一些学者认为,SLE并发淋巴瘤可能与B细胞反复长期刺激相关[10]。(2)遗传因素:rs77191406可能提示SLE合并肿瘤为高风险恶性肿瘤进展[11]。(3)肿瘤抗原:有肿瘤细胞释放入体内的大分子物质具有免疫原性,在机体内产生抗体诱发自身免疫性疾病[12]。(4)并发肿瘤可能与长期使用免疫抑制剂相关,此方面的报道国内外尚不统一,CHUN等[7]对466例患SLE的女性伴发肿瘤研究显示,使用细胞毒性药物并未增加SLE发生肿瘤的几率,但是SLE并发肿瘤的标准化死亡率升高,本例SLE患者并发结肠癌并未使用细胞毒性药物,考虑与监视功能低下等原因相关。
胰腺囊性占位在临床上比较少见,主要包括浆液性囊腺瘤、黏液性囊腺瘤及导管内乳头状黏液瘤[13]。其中30%以上为胰腺浆液性囊腺瘤,绝大多数为良性倾向,然而也有病理标本显示,良性但局部有浸润性肿瘤可能提示有增加复发或转移的可能性,本病例即是如此[14-15]。胰腺浆液性囊腺瘤形态学上可以分为浆液性微囊腺瘤、浆液性寡囊腺瘤、混合性浆液性囊腺瘤及实性囊腺瘤,其中以浆液性微囊腺瘤多见[16]。术前明确诊断为胰腺浆液性囊腺瘤比较困难,夏雨等[17]认为,CT与MRI在胰腺囊性病变术前诊断的准确率上不分伯仲,但其治疗决策众说纷纭。
随着影像学诊断技术的提高,胰腺囊性占位的诊断率逐渐提升,相关的文献报道越来越多[17],一些学者认为,其患病率与年龄呈正相关,在亚洲人群中可能更高[18],胰腺囊性占位的患者中40岁以下者占0.5%,70岁以上者占57%[19],在所有临床诊断的胰腺囊性占位中30%以上为胰腺囊腺瘤[15,19]。国外的研究报道,胰腺浆液性囊腺瘤在老年女性中多发,尤其是70岁以上[20],且多见于胰体尾部[21]。JAIS等[22]的多中心研究报道显示,胰腺浆液性囊腺瘤可有非特异性腹痛(27%)、胰胆管症状(9%)、糖尿病(5%)、其他症状(4%)等临床表现,无症状的胰腺浆液性囊腺瘤约占61%。本例患者未见有明显症状。
由于胰腺与脾动静脉相邻,且胰腺术后容易发生胰漏,保留脾脏有增加术后出血、腹腔脓肿等并发症的风险[23],故胰体尾部肿瘤常采取胰体尾联合脾脏切除术。但脾脏是人体重要的免疫器官,由于疏忽造成的脾切除会增加患者的住院日和死亡率[24]。保留脾脏的胰体尾切除术逐渐被重视。HE等[25]的Meta分析比较897例患者胰体尾切除保脾与不保脾的相关临床资料,结果显示,保脾组术后住院时间较短(P=0.007)、腹腔内脓肿发生率较低(P=0.009),两组术式在手术时间、出血量、输血、胰漏、血栓形成、再手术、术后伤口感染等方面无明显差异。鉴于脾脏的免疫功能以及术后快速康复,HE等[25]认为,保留脾脏的胰体尾切除术是安全有效且有必要的。本例由于术中发现囊腺瘤侵犯脾静脉,于是术中对患者行脾切,但我们依然认为术中应该尽可能的保留脾脏,以便患者术后快速康复。
[1] PETTERSSON T, PUKKALA E, TEPPO L, et al. Increased risk of cancer in patients with systemic lupus erythematosus [J]. Ann Rheum Dis, 1992, 51(4): 437-439.
[2] CIBERE J, SIBLEY J, HAGA M. Systemic lupus erythematosus and the risk of malignancy [J]. Lupus, 2001, 10(6): 394-400. DOI: 10.1191/096120301678646128.
[3] NIVED O, BENGTSSON A, JÖNSEN A, et al. Malignancies during follow-up in an epidemiologically defined systemic lupus erythematosus inception cohort in southern Sweden [J]. Lupus, 2001, 10(7): 500-504. DOI: 10.1191/096120301678416079.
[4] 孙乐栋, 曾抗, 王茜, 等. 系统性红斑狼疮伴发恶性肿瘤12例临床分析[J]. 中华风湿病学杂志, 2006, 10(6): 372. DOI:10.3760/j:issn:1007-7480.2006.06.016.
[5] 石宇红, 周润华, 莫汉有, 等. 8例系统性红斑狼疮合并恶性肿瘤的临床分析[J]. 重庆医学, 2010, 39(23): 3263-3264. DOI:10.3969/j.issn.1671-8348.2010.23.052.
[7] CHUN B C, BAE S C. Mortality and cancer incidence in Korean patients with systemic lupus erythematosus: results from the Hanyang lupus cohort in Seoul, Korea [J]. Lupus, 2005, 14(8): 635-638. DOI: 10.1191/0961203305lu2180xx.
[8] BERNATSKY S, RAMESEY-GOLDMAN R, LABRECQUE L, et al. Cancer risk in systemic lupus: an updated international multi-centre cohort study [J]. J Autoimmun, 2013, 42: 130-135. DOI: 10.1016/j.jaut.2012.12.009.
[9] BERNATSKY S, KALE M, RAMSEY-GOLDMAN R, et al. Systemic lupus and malignancies [J]. Curr Opin Rheumatol, 2012, 24(2): 177-181. DOI: 10.1097/BOR.0b013e32834ff258.
[10] VEERANKI S, CHOUBEY D. Systemic lupus erythematosus and increased risk to develop B cell malignancies: role of the p200-family proteins [J]. Immunol Lett, 2001, 133(1): 1-5. DOI: 10.1016/j.imlet.2010.06.008.
[11] ZHU L, ZHOU L, WANG L, et al. A20 SNP rs77191406 may be related to secondary cancer for rheumatoid arthritis and systemic lupus erythematosus patients [J]. Asia Pac J Clin Oncol, 2016, 12(4): 409-414. DOI: 10.1111/ajco.12577.
[12] MARMUR R, KAGEN L. Cancer-associated neuromusculoskeletal syndromes. Recognizing the rheumatic neoplastic connection [J]. Postgrad Med, 2002, 111(4): 95-98, 101-102.
[13] 陈湘光, 杨志企, 黄送, 等. 宝石能谱CT在诊断胰腺黏液性囊性肿瘤与浆液性囊腺瘤中的应用价值[J]. 胃肠病学和肝病学杂志, 2016, 25(6): 698-701. DOI:10.3969/j.issn.1006-5709.2016.06.027.
CHEN X G, YANG Z Q, HUANG S, et al. Application value of gemstone spectral CT in the diagnosis of mucinous cystic neoplasm and serous cystadenoma [J]. Chin J Gastroenterol Hepatol, 2016, 25(6): 698-701. DOI:10.3969/j.issn.1006-5709.2016.06.027.
[14] FARRELL J J. Prevalence, diagnosis and management of pancreatic cystic neoplasms: current status and future directions [J]. Gut Liver, 2015, 9(5): 571-589. DOI: 10.5009/gnl15063.
[15] GALANIS C, ZAMANI A, CAMERON J L, et al. Resected serous cystic neoplasms of the pancreas: a review of 158 patients with recommendations for treatment [J]. J Gastrointest Surg, 2007, 11(7): 820-826. DOI: 10.1007/s11605-007-0157-4.
[16] ROGGIN KEVIN K K, CHENNAT J, OTO A, et al. Pancreatic cystic neoplasm [J]. Curr Probl Surg, 2010, 47(6): 459-510. DOI: 10.1067/j.cpsurg.2010.02.002.
[17] 夏雨, 付义斌. CT和MRI在胰腺囊性病变鉴别诊断中的价值 [J]. 胃肠病学和肝病学杂志, 2017, 26(8): 934-936. DOI:10.3969/j.issn.1006-5709.2017.08.025.
XIA Y, FU Y B. Value of CT and MRI in the differential diagnosis of pancreatic cystic lesions [J]. Chin J Gastroenterol Hepatol, 2017, 26(8): 934-936. DOI:10.3969/j.issn.1006-5709.2017.08.025.
[18] CAHALANE A M, PURCELL Y M, LAVELLE L P, et al. Which is the best current guideline for the diagnosis and management of cystic pancreatic neoplasms? An appraisal using evidence-based practice methods [J]. Eur Radiol, 2016, 26(9): 3121-3128. DOI: 10.1007/s00330-015-4160-y.
[19] LAFFAN T A, HORTON K M, KLEIN A P, et al. Prevalence of unsuspected pancreatic cysts on MDCT [J]. Am J Roentgenol, 2008, 191(3): 802-807. DOI: 10.2214/AJR.07.3340.
[20] JANA T, SHROFF J, BHUTANI M S. Pancreatic cystic neoplasms: review of current knowledge, diagnostic challenges, and management options [J]. J Carcinog, 2015, 14: 3. DOI: 10.4103/1477-3163.153285.
[21] FARRELL J J, FERNNDEZ-DEL C C. Pancreatic cystic neoplasms: management and unanswered questions [J]. Gastroenterology, 2013, 144(6): 1303-1315. DOI: 10.1053/j.gastro.2013.01.073.
[22] JAIS B, REBOURS V, MALLEO G, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas) [J]. Gut, 2016, 65(2): 305-312. DOI: 10.1136/gutjnl-2015-309638.
[23] MABRUT J Y, FERNANDEZ-CRUZ L, AZAGRA J S, et al. Laparoscopic pancreatic resection: results of a mutticenter European study of 127 patients [J]. Surgery, 2005, 137(6): 597-605.
[24] MCGORY M L, ZINGMOND D S, SEKERIS E, et al. The significance of inadvertent splenectomy during colorectal cancer resection [J]. Arch Surg, 2007, 142(7): 668-674. DOI: 10.1001/archsurg.142.7.668.
[25] HE Z, QIAN D, HUA J, et al. Clinical comparison of distal pancreatectomy with or without splenectomy: a meta-analysis [J]. PLoS One, 2014, 9(3): e91593. DOI: 10.1371/journal.pone.0091593.
