胰腺癌分子靶向治疗疗效分析
2018-01-23黎莹,马冬
黎 莹, 马 冬
广东省人民医院 广东省医学科学院胃肠肿瘤内科,广东 广州 510000
胰腺癌在临床上是一种恶化程度很高、诊断和治疗都非常困难的一种消化道恶性肿瘤。临床相关研究显示,男性的发病率高于女性,比例为(1.5~2)∶1[1]。目前,临床中针对胰腺癌的治疗主要是外科治疗、姑息治疗、综合治疗为主,外科手术切除是疗效确切的一种治疗手段,但胰腺癌想要实现早期发现难度较大,等到临床上出现症状,患者的肿瘤细胞往往已经出现扩散的情况,想要利用外科手术切除有一定难度,因此临床上将研究的重点放在了其治疗方式上。本次研究纳入60例胰腺癌患者进行临床分析,均采用分子靶向治疗,现具体报道如下。
1 资料与方法
1.1一般资料收集2015年1月1日至2017年6月30日广东省人民医院广东省医学科学院胃肠肿瘤内科的胰腺癌患者60例作为研究对象,男33例,女27例,年龄(68.52±4.74)岁(40~78岁)。采用随机表法将60例患者分为三组,每组20例,三组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性(见表1)。A组采用吉西他滨联合表皮生长因子受体(EGFR)抑制剂,B组采用吉西他滨联合环氧合酶2(COX-2)抑制剂,C组采用吉西他滨联合血管内皮生长因子(VEGF)抑制剂。
1.2纳入及排除标准纳入标准:(1)符合临床中关于胰腺癌的诊断标准:年龄>40岁;无诱因腹痛、饱胀不适、食欲不振、消瘦、乏力、腹泻、腰背部酸痛、反复发作性胰腺炎或无家族遗传史的突发糖尿病[2];(2)预估生存期超过6个月;(3)经济条件良好;(4)通过医学伦理委员会同意,患者或患者监护人了解本次试验并签署知情同意书。排除标准:(1)神志不清、无法正常沟通者;(2)存在精神障碍者[3];(3)生存期<6个月者;(4)依从性较差,无法按时完成各种指标观察者;(5)患者不同意纳入本次研究。
1.3观察指标跟踪随访3个月至1年时间,对比3组1年总生存率、中位生存率。

2 结果
2.1一般资料比较根据AJCC第8版胰腺癌分期系统[4],将胰腺癌患者分为5期,分别为TX、T1、T2、T3、T4(见表1)。
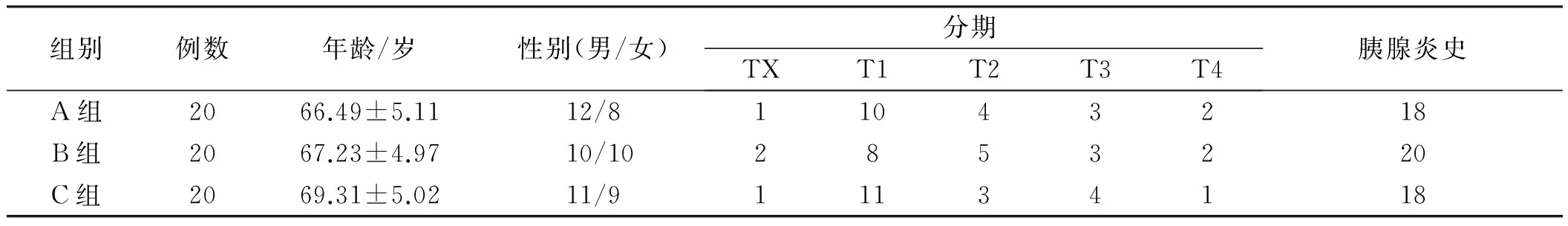
表1 3组一般资料比较
注:三组在年龄、性别、分期比较,差异均无统计学意义。
2.2对比3组1年总生存率、中位生存期通过对比3组1年总生存率和中位生存期,发现B组与C组比较,差异有统计学意义(P<0.05),A组与B组、A组与C组差异无统计意义(P>0.05,见表2)。
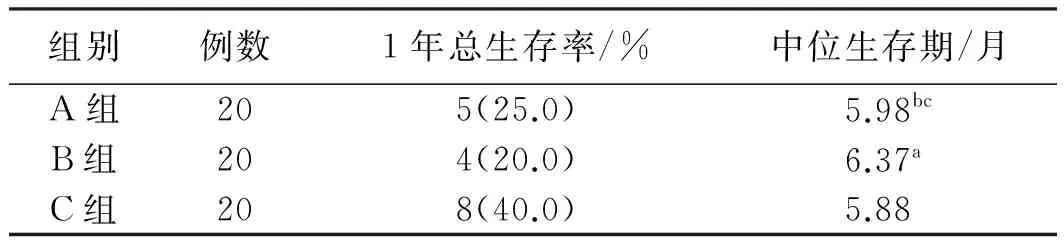
表2 3组1年总生存率、中位生存期比较
注:与C组比较,aP<0.05,χ2=4.052,bP>0.05,χ2=0.106;与B组比较,cP>0.05,χ2=0.134。
2.3分析三组不良反应发生情况3组患者均出现各种不良反应,3组的不良反应发生类型、发生数量比较,差异无统计学意义(P>0.05,见表3)。

表3 3组不良反应发生情况
3 讨论
3.1胰腺癌临床上有研究[5]显示,90%左右的胰腺癌是起源于腺管上皮的导管腺癌。胰腺癌5年生存率<1%,是临床上预后最差的恶性肿瘤之一[6]。胰腺癌是一种恶性程度极高的肿瘤,大部分患者确诊时已是晚期,错过了手术的最佳时间,放、化疗也不能很好改善预后,分子靶向治疗在胰腺癌的治疗领域提供了新的方向和思路[7]。
3.2胰腺癌与EGFR抑制剂当EGFR与配体结合后,发生二聚体化,激发胞质区中的酪氨酸残基磷酸化,从而活化受体中酪氨酸激酶,使酪氨酸激酶作用靶蛋白的结合位点充分暴露,多条下游信号传导途径被激活,最终导致细胞增殖、入侵和转移[8]。目前已知EGFR的7种配体包括:表皮生长因子(EGF)、转化生长因子α(TGF-α)、双调节蛋白(amphireguin)、β-细胞素(be-Tacelluin,BTC)、肝素结合的表皮生长因子(heparin-binding EGF,HBEGF)、神经调节素2-α(NRG2-α)与表皮素(epiregulin,EPR)[9]。FIORE等[10]进行过一项C225和GEM联合放射治疗34例EGFR阳性局部晚期胰腺癌患者的前瞻性临床试验。最终认为,C225和GEM 联合放射治疗晚期胰腺癌耐受性良好,改善了胰腺癌患者的中位生存时间,提高了患者的生存质量,有望在临床上广泛应用。在本次研究中,3组患者均出现各种不良反应,3组的不良反应发生类型、发生数量比较,差异无统计学意义。
3.3胰腺癌与COX-2抑制剂COX-2抑制剂能够促进前列环素的生成[11],前列环素能够有效促进血管生成,从而促进胰腺癌组织的生长[12],通过利用抑制COX-2从而抑制Kras诱导的胰腺上皮内瘤变向胰腺导管细胞癌的转化。另外,COX-2抑制剂还能够下调前列环素的表达,有效降低肿瘤微环境中的骨髓抑制水平。COX-2抑制剂中最有代表性的药物就是塞来昔布。目前在卵巢癌、非小细胞癌、乳腺癌等肿瘤的治疗中有着重要意义。
EL-RAYES等[13]用塞来昔布、吉西他滨、顺铂三药联合治疗胰腺癌的Ⅱ期临床试验研究,结果显示,中位生存期为5.8个月,塞来昔布并没有增加化疗疗效,其原因可能是塞来昔布对胰腺癌常规细胞毒性疗法不是很敏感。在本次研究中,A组1年总生存率25.0%、中位生存期5.98个月,B组1年总生存率20.0%、中位生存期6.37个月、C组1年总生存率40.0%、中位生存期5.88个月,B组与C组差异有统计学意义,A组与B组、A组与C组差异无统计学意义。
3.4胰腺癌与VEGF抑制剂目前的研究[14]显示,VEGF在很多实体肿瘤(包含胰腺癌)对血管的生成及肿瘤的发生和发展过程中起到了非常关键的作用。将贝伐单抗和吉西他滨联合治疗晚期胰腺癌其肿瘤治疗反应率、中位无进展期、中位生存期都要优于单一用药方式[15]。索拉非尼也是VEGF抑制剂中的一种,索拉非尼能够发挥出抗血管生成效应,还能够阻断肿瘤细胞增殖。
第一代VEGF抑制剂即贝伐单抗在乳腺癌、非小细胞肺癌中都有着非常广泛的应用。在本次研究使用阿帕替尼,庚同举等[16]观察阿帕替尼治疗晚期胰腺癌对生存期的影响,试验组18例、对照组21例,有完整随访资料的晚期胰腺癌患者,回顾性分析结果发现,试验组患者中位生存期6.0个月(95%CI: 5.17~6.84),对照组患者中位生存期5.5个月(95%CI: 4.15~6.85),生存曲线Log-rank检验P>0.05,认为阿帕替尼不能延长晚期胰腺癌患者的生存期。
3.5胰腺癌与其他分子靶向治疗临床中,会将沙利度胺用于调剂IL-6等炎性因子的治疗[17]。一项研究[18]证实,THD联合GEM能够抑制胰腺癌细胞的增殖和肿瘤血管的生成,并与诱导肿瘤细胞凋亡和坏死有关。临床上还有研究[19]认为,沙利度胺能够有效改善晚期胰腺癌患者的体质,减少癌症厌食和恶病质的发生。mTOR抑制剂是通过抑制mTOR功能,从而抑制PI3K-AKT-mTOR途径下游相关因子的功能,抑制肿瘤细胞生长,甚至使细胞凋亡[20]。MMP可通过调节细胞之间的黏附作用来促进肿瘤细胞的浸润与转移,BAY12-9566是一种新型MMP抑制剂,可抑制胰腺癌的浸润与转移[21],MOORE等[22]发现,与单用吉西他滨相比,联合口服BAY12-9566后可显著延长患者的生存时间。
综上所述,针对胰腺癌的临床治疗,可考虑采用吉西他滨联合COX-2抑制剂的治疗方案,但在实际临床中想要达到良好治疗效果,仍然需要结合患者个体情况及其他因素联合考虑。
[1] 占婷, 罗和生, 田霞, 等. TAZ与胰腺癌细胞增殖和抗凋亡能力的关系研究[J]. 胃肠病学和肝病学杂志, 2017, 26(07): 741-743. DOI: 10.3969/j.issn.1006-5709.2017.07.006.
ZHAN T, LUO H S, TIAN X, et al. Relationship of TAZ with proliferation and anti apoptotic ability of pancreatic cancer [J] Chin J Gastroenterol Hepatol, 2017, 26(7): 741-743. DOI: 10.3969/j.issn.1006-5709.2017.07.006.
[2] 郭小陪, 魏华琳, 张夏璐, 等. 胰腺癌放疗致胃、十二指肠出血胃镜下观察及特征性分析[J]. 胃肠病学和肝病学杂志, 2016, 25(8): 906-908. DOI: 10.3969/j.issn.1006-5709.2016.08.019.
GUO X P, WEI H L, ZHANG X L, et al. Endoscopic observation and characteristics analysis of gastroduodenal hemorrhage after pancreatic cancer radiotherapy [J]. Chin J Gastroenterol Hepatol, 2016, 25(8): 906-908. DOI: 10.3969/j.issn.1006-5709.2016.08.019.
[3] 王荣华, 阮丁异, 徐志峰, 等. 胰蛋白酶与胰腺癌疼痛及其患者生存期的关系[J]. 胃肠病学和肝病学杂志, 2014, 23(10): 1217-1219. DOI: 10.3969/j.issn.1006-5709.2014.10.031.
WANG R H, RUAN D Y, XU Z F, et al. Relationship of trypsin with pancreatic cancer pain and its survival period [J]. Chin J Gastroenterol Hepatol, 2014, 23(10): 1217-1219. DOI: 10.3969/j.issn.1006-5709.2014.10.031.
[4] 张明娟, 刘佳, 王甦. 胰腺癌患者胰液中端粒酶表达的Meta分析[J]. 胃肠病学和肝病学杂志, 2013, 22(11): 1099-1101. DOI: DOI:10.3969/j.issn.1006-5709.2013.11.013.
ZHANG M J, LIU J, WANG S. Expression of human telomerase in pancreatic juice of pancreatic cancer: a meta-analysis [J] Chin J Gastroenterol Hepatol, 2013, 22 (11): 1099-1101. DOI: DOI:10.3969/j.issn.1006-5709.2013.11.013.
[5] 李智德, 侯宝华. 循环microRNA在胰腺疾病中作为分子标记物的研究进展[J]. 胃肠病学和肝病学杂志, 2016, 25(5): 594-596. DOI: 10.3969/j. issn.1006-5709.2016.05.028.
LI Z D, HOU B H. Advances in circulating microRNA as biomarkers in pancreatic disease [J] Chin J Gastroenterol Hepatol, 2016, 25 (5): 594-596. DOI: 10.3969/j.issn.1006-5709.2016.05.028.
[6] 豆利华. 吉西他滨联合分子靶向药物及铂类药物治疗中晚期胰腺癌患者安全性和有效性的META分析[D]. 石家庄:河北医科大学, 2016.
DOU L H. Systematic evaluation of the safety and efficacy of gemcitabine combined with molecular targeted agents and platinum based drugs in the treatment of patients with advanced pancreatic cancer [D]. Shijiazhuang: Hebei Medical University, 2016.
[7] 钟志惟, 殷香保. 胰腺癌的分子靶向治疗研究进展[J]. 中国普通外科杂志, 2016, 25(9): 1351-1356. DOI: 10.3978/j.issn.1005-6947.2016.09.022.
ZHONG Z W, YIN X B. Research progress in molecular targeted therapy for pancreatic cancer [J]. Chinese Journal of General Surgery, 2016, 25 (9): 1351-1356. DOI: 10.3978/j.issn.1005-6947.2016.09.022.
[8] FRANCAVILLA C, PAPETTI M, RIGBOLT K T, et al. Multilayered proteomics reveals molecular switches dictating ligand-dependent EGFR trafficking [J]. Nat Struct Mol Biol, 2016, 23(6): 608-618. DOI: 10.1038/nsmb.3218.
[9] DREUX A C, LAMB D J, MODJTAHEDI H, et al. The epidermal growth factor receptors and their family of ligands: their putative role in atherogenesis [J]. Atherosclerosis, 2006, 186(1): 38-53. DOI: 10.1016/j.atherosclerosis.2005.06.038.
[10] FIORE M, TRODELLA L, VALERI S, et al. Prospective study of cetuximab and gemcitabine in combination with radiation therapy: feasibility and efficacy in locally advanced pancreatic head cancer [J]. Radiat Oncol, 2015, 10: 255. DOI: 10.1186/s13014-015-0564-8.
[11] 马慧, 任正刚. 肿瘤干细胞相关机制及靶向肿瘤干细胞治疗研究进展[J]. 实用肿瘤杂志, 2013, 28(1): 89-94. DOI:10.13267/j.cnki.syzlzz.2013.01.024.
[12] 许元鸿, 刘哲, 郭克建, 等. 新基因JDP2通过不同通路抑制人胰腺癌上皮向间质转化作用的研究[J]. 中国医科大学学报, 2012, 41(11): 990-994. DOI: 10.3969/j.issn.0258-4646.2012.11.008.
XU Y H, LIU Z, GUO K J, et al. Effect of JDP2 on epithelial-mesenchymal transition in human pancreatic cancer cell line [J]. Journal of China Medical University, 2012, 41(11): 990-994. DOI: 10.3969/j.issn.0258-4646.2012.11.008.
[13] EL-RAYES B F, ZALUPSKI M M, SHIELDS A F, et al. A phase II study of celecoxib, gemcitabine, and cisplatinin advanced pancreatic cancer [J]. Invest New Drags, 2005, 23(6): 583-590.
[14] 刘芳. Mesothelin抗体修饰的Fe3O4@SiO2纳米探针在胰腺癌体内外靶向成像中的实验研究[D]. 上海: 第二军医大学, 2016.
[15] 郑圣明. 索拉菲尼联合阿霉素治疗晚期胰腺癌的临床疗效[J]. 华南国防医学杂志, 2014, 28(8): 824-825.
[16] 庚同举, 毋永娟. 阿帕替尼治疗晚期胰腺癌临床疗效观察[J]. 医学理论与实践, 2016, 29(21): 2934-2935. DOI: 10.19381/j.issn.1001-7585.2016.21.029.
[17] 郭世奎, 龚昆梅, 肖乐, 等. 胰腺癌相关信号转导通路研究新进展[J]. 中国肿瘤临床与康复, 2010, 17(6): 563-565. DOI: 10.13455/j.cnki.cjcor.2010.06.027.
[18] QIAO Z, YUAN J, SHEN J, et al. Effect of thalidomide in combination with gemcitabine on human pancreatic carcinoma SW-1990 cell lines in vitro and in vivo [J]. Oncol Lett, 2015, 9(5): 2353-2360. DOI: 10.3892/ol.2015.3064.
[19] RONGA I, GALLUCCI F, RICCARDI F, et al. Anorexia-cachexia syndrome in pancreatic cancer: recent advances and new pharmacological approach [J]. Adv Med Sci, 2014, 59(1): 1-6. DOI: 10.1016/j.advms.2013.11.001.
[20] 厉胜, 廖泉, 赵玉沛. 胰腺癌分子靶向治疗的研究进展[J]. 基础医学与临床, 2010, 30(5): 557-560.
LI S, LIAO Q, ZHAO Y P. Progress in molecule-targeted therapy for pancreatic cancer [J]. Basic & Clinical Medicine, 2010, 30(5): 557-560.
[21] 许莹, 戴树龙. 胰腺癌分子靶向治疗的研究进展[J]. 临床肝胆病杂志, 2016, 32(10): 2026-2028. DOI: 10.3969/j.issn.1001-5256.2016.10.048.
XU Y, DAI S L. Research advances in molecular targeted therapy for pancreatic cancer [J]. J Clin Hepatol, 2016, 32(10): 2026-2028. DOI: 10.3969/j.issn.1001-5256.2016.10.048.
[22] MOORE M J, HAMM J, DANCY J, et al. Comparidson of gemcitabin vesus the matrix metalloprotinase inhibitor BAY12-9566 in patients with advanced or adenocarcinoma of the pancreas:a phase trial of the National Cancer Institute of Canada Clinical Trials Group [J]. J Clin Oncol, 2003, 21(2): 3296-3300. DOI: 10.1200/JCO.2003.02.098.
