铁离子对厌氧氨氧化污泥富集培养的影响
2018-01-23毛念佳嵇鸿民任洪强
毛念佳,嵇鸿民,许 柯,任洪强
(南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏南京 210023)
厌氧氨氧化即厌氧条件下厌氧氨氧化菌以氨氮为电子供体,亚硝酸盐为电子受体,并将其转化为氮气的生物脱氮过程[1-2]。相较于传统硝化反硝化工艺,厌氧氨氧化具有脱氮效能高、曝气消耗小、无需外加有机碳源、剩余污泥产量少等优势[3-5],发现之初便成为污水生物脱氮领域的研究热点。
作为厌氧氨氧化功能承载者的厌氧氨氧化菌细胞产率低、生长速率缓慢,导致厌氧氨氧化污泥富集培养缓慢、工艺启动时间长[6-8]。当前对厌氧氨氧化污泥富集培养的研究,主要集中于反应器构型[9-10]、填料添加[11-12]、接种污泥[13]、参数优化[14]等方面,而对微量元素的影响研究较少。铁元素作为微生物生长必需的微量元素,对厌氧氨氧化菌的生理生化功能具有重要影响。Strous等[15]分析厌氧氨氧化菌Candidatus K.stuttgartiensis基因组发现其存在代谢Fe(Ⅲ)的电子传递途径;此外,厌氧氨氧化菌富含铁元素颗粒[16],多种功能蛋白合成需要大量血红素[17-19],铁元素作为血红素的重要组分,无疑会对厌氧氨氧化污泥的富集培养产生影响,当前则较少有研究涉及。
本研究通过对照试验考察了铁离子对厌氧氨氧化污泥富集培养的影响,并采用荧光定量PCR及16S rRNA高通量测序技术从微生物生态学解析其机理,研究结果对厌氧氨氧化污泥的富集培养及工艺启动具有参考价值和指导意义。
1 材料与方法
1.1 试验装置与运行条件
试验采用小试规模厌氧颗粒污泥膨胀床反应器(expanded granular sludge bed,EGSB),由有机玻璃制作,有效容积为0.8 L,外覆锡纸以隔绝光的影响[20]。反应器运行温度通过恒温循环水槽维持在35℃,进水 pH 值用 0.1 mmol/L 盐酸调节为 6.6~6.8,以保证 Fe(Ⅲ)的溶解;本试验采用连续流,水力停留时间(HRT)为24 h,试验装置如图1所示。

图1 试验装置示意图Fig.1 Schematic Diagram of Experimental Device
1.2 接种污泥与模拟废水
试验所用接种污泥取自南京某市政污水厂氧化沟缺氧段,为棕黄色絮状污泥。反应器接种污泥量为20 g/L,接种前用pH值=7.2的磷酸盐缓冲液冲洗三次,以洗去残余物质。模拟废水以自来水配置,组分为:(NH4)2SO4(按需配制)、NaNO2(按需配制)、KH2PO410 mg /L、CaCl2·2H2O 5.6 mg /L、MgSO4·7H2O 300 mg /L、KHCO3500 mg /L、EDTA 25 mg/L、微量元素浓缩液Ⅰ 1.25 mL /L、微量元素浓缩液Ⅱ(按需配制)。微量元素浓缩液Ⅰ组分为:FeSO40.625 mL /L、H3BO40.0175 mL /L、MnCl2·4H2O 1.2375 mL /L、CuSO4·5H2O 0.3125 mL /L、ZnSO4·7H2O 0.5375 mL /L、NiCl2· 6H2O 0.2375 mL /L、NaSeO4· 10H2O 0.262 5 mL /L、NaMoO4· 2H2O 0.275 mL/L。微量元素浓缩液Ⅱ:FeCl3(按需配制),R1为控制组,模拟废水中不添加微量元素浓度液Ⅱ;而试验组R2、R3中添加微量元素浓缩液Ⅱ并控制 Fe(Ⅲ)浓度分别为 0.04、0.08 mmol/L。模拟废水预曝高纯氮气(>99.5%)至溶解氧浓度(DO)低于 0.5 mg/L,再泵入反应器中。
1.3 常规指标分析方法
反应器出水定期采样,经0.22 μm滤膜过滤后测定,分析测定方法参考国家标准[21]。采用水杨酸分光光度法;采用 N-(1-萘基)-乙二胺分光光度法;用酚二磺酸分光光度法;Fe(Ⅲ)采用邻菲啰啉光光度法;溶解氧(DO)以便携式溶解氧仪测定,pH值由 pH计测定。
1.4 污泥粒径分析
从反应器中取一定量污泥至50 mL离心管中,置于激光粒度仪(Mastersizer 3000,英国马尔文仪器有限公司)中检测。样品充分混匀后,以水为分散剂进行分析测试,并使用机器配置的软件进行记录,使用一次性塑料滴灌吸取搅拌均匀的样品,污泥样加至遮光度在10%~15%时进行测试。单一样品重复测定3次,以降低误差。
1.5 实时荧光定量PCR分析
污泥样品采用FastDNA SPIN Kit for soil试剂盒提取污泥DNA,而后用NanoDrop 2000超微量紫外分光光度计定量,采用SYBR®Green染料法进行定量PCR分析。选取目标基因包括:细菌16S rRNA基因、厌氧氨氧化菌16S rRNA基因及部分氮素转化功能基因,以含有目标基因的质粒标准品建立标准曲线(R2>0.999)。扩增体系为 25 μL,含 12.5 μL 2×SYBR®Green PCR Master Mix(Vazyme,中国),2 μL 模板 DNA(20 ng/μL),正反引物各 0.2 μL,10.1 μL无菌超纯水;扩增程序在荧光定量PCR仪AB7500(Life Technologies,美国)进行,每个样品做三个平行,具体参数如表1所示。

表1 目标基因的引物序列及退火温度Tab.1 Primers Sequence for Target Genes and Corresponding Annealing Temperature
1.6 16S rRNA高通量测序分析
16S rRNA高通量测序分析基于Illumina Miseq测序平台,具体步骤包括DNA提取、PCR扩增、产物验证及纯化、测序及结果分析。DNA提取见1.5,PCR扩增采用细菌通用引物,引物序列为:正向引物(5’-AGAGTTTGATYMTGGCTCAG-3’),反向引物(5’-TGCTGCCTCCCGTAGGAGT-3’);扩增体系为 50 μL,含 5 μL 10×PCR Buffer (TaKaRa,日本)、0.25 μL Ex Taq DNA 聚 合 酶、4 μL MgCl2、4 μL DNTP Mixture、2 μL DNA 模板(20 ng /μL)、正反引物各 1 μL,无菌超纯水若干。扩增反应于 Veriti PCR仪(Life Technologies,美国)进行,扩增程序为:预变性 98℃/5 min,扩增循环 20次(变性 98℃/30 s,退火 50 ℃ /30 s,延伸 72 ℃ /40 s),延伸 72 ℃ /10 min。扩增产物经2%的琼脂糖凝胶电泳验证,经E.Z.N.A.TMCycle-Pure Kit试剂盒纯化后,送至江苏中宜金大分析检测有限公司进行测序分析。测序数据使用Sickle和Mothur程序降噪处理,而后用RDP classifier对序列分类,使用 Heml程序绘制热图。
2 结果与讨论
2.1 反应器运行性能
厌氧氨氧化污泥富集培养过程中,为考察铁离子的影响,反应器保持同步容积氮负荷提升,直至运行稳定。反应器R1、R2、R3进出水氮素指标、容积氮负荷及氮去除速率如图2所示。
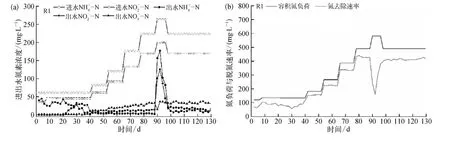

图2 铁离子对厌氧氨氧化污泥富集培养过程中脱氮效能的影响(a)、(c)、(e)氮素指标;(b)、(d)、(f)容积氮负荷及氮去除速率Fig.2 Influence of Fe(Ⅲ)on Denitrification Performance during Enrichment Cultivation Process(a)、(c)、(e)Nitrogen Profile;(b)、(d)、(f)Nitrogen Load Rate (NLR)and Nitrogen Removal Rate (NRR)
由图2可知,富集培养初期(0~4 d)各反应器均出现菌体自溶现象,表现为出水浓度高于进水。由于进水中无有机碳源,且溶解氧浓度严格限制,导致部分微生物难以适应无机环境而自溶[29]。在菌体自溶阶段,反应器中存在强烈的内源反硝化作用,出水及浓度几乎为0;此时反应器污泥颜色由黄棕变黑,并伴有明显的减量。
随着菌体自溶作用的减弱,反应器进入活性迟滞阶段,表现出微弱的厌氧氨氧化作用。在此阶段(5~38 d),进水和保 持在45.1 mg/L和 61.1 mg/L,各反应器运行并未表现出明显差异。各反应器中出水浓度为 24.6~42.6 mg/L,平均去除率为 21.8%~26.7%,反应器出水浓度较低,表明反应器中仍存在一定的反硝化作用。在此阶段,各反应器逐渐适应环境,反硝化作用减弱,出水水质变化特征类似。
随着反硝化功能的减弱,各反应器中厌氧氨氧化作用不断增强,成为主要脱氮途径,为活性提高阶段。在此过程,各反应器进水容积氮负荷同步提升,由于铁离子的添加,反应器表现出不同的容积氮负荷耐受能力。反应器R1活性提高阶段为39~88 d,容积氮负荷由 132.6 mg /(L·d)提升至 489.4 mg /(L·d);R2在活性提高阶段(39~100 d)容积氮负荷由 132.6 mg/(L·d)提升至 580.9 mg /(L·d);R3活性提高阶段为 39~112 d,容积氮负荷由132.6 mg/(L·d)提升至 696.6 mg /(L·d)。容积氮负荷提升量由高到低为R3>R2>R1;此外,活性提高阶段 R1、R2、R3中平均总氮去除率分别为82.9%、84.2%、85.3%,试验组 R2、R3 整体脱氮效率略高于R1。
在厌氧氨氧化污泥富集培养中,由于厌氧氨氧化菌生长缓慢,反应器容积负荷有限。许多研究证明了高氮素基质对厌氧氨氧化菌的抑制作用[30-33]。Strous等[7]研究表明亚硝酸盐浓度达到 100 mg/L,即可强烈抑制厌氧氨氧化菌活性;本研究以出水亚硝酸盐浓度高于100 mg/L作为反应器超过可承受负荷并失稳的依据。对照组R1在运行90 d时,容积氮负荷超出反应器承受极限,出水和浓度急剧升高,类似失稳现象也出现在试验组 R2(第 102 d)、R3(第 114 d)。反应器失稳后,降低进水基质氮浓度,同时加大回流比以解除基质自抑制;由于EGSB反应器抗冲击负荷能力强,反应器很快恢复稳定运行。稳定阶段反应器运行状况如表2 所示。Chen 等[34]通过批次试验证明了3.68 mg /L的铁离子添加下,比厌氧氨氧化活性可提高533.2%;长期试验证明,铁离子的添加,相较于控制组,提升了19.5%的反应器容积负荷,与本研究结果类似。
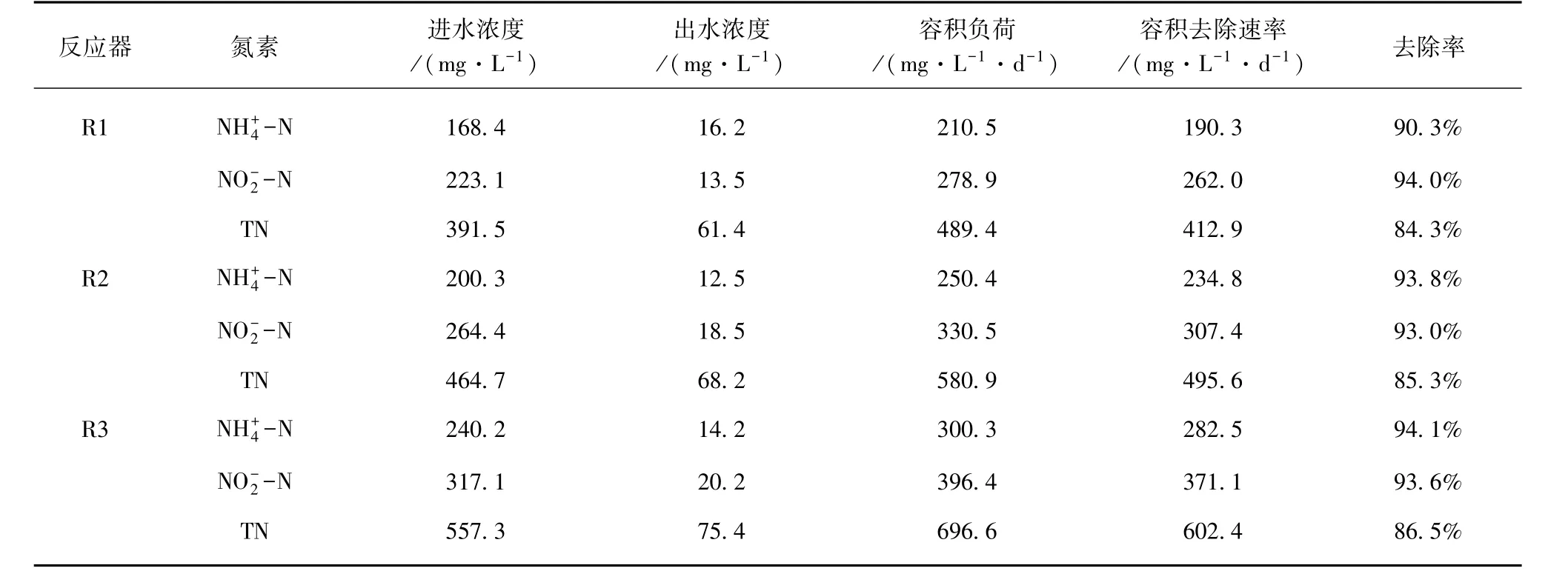
表2 稳定阶段反应器运行状况Tab.2 Operation Status of Reactors at Stabilization Stage
2.2 污泥粒径分布
本研究采用EGSB反应器培养厌氧氨氧化污泥,接种污泥为絮状反硝化污泥,取接种污泥及130 d污泥样品,用激光粒度仪分析其粒径,结果如图3所示。

图3 污泥粒径分布Fig.3 Particle Size Distribution of Sludge Samples
富集培养130 d时,表观观察发现污泥呈颗粒化特征。激光粒度分析结果显示,反应器R1、R2、R3中污泥样品平均粒径分别为 796、908 μm和1 040 μm,试验组 R2、R3 中污泥粒径较高。据DLVO理论,当负载电性相同的电荷时,由于细菌个体之间静电斥力的存在,不利于颗粒状富集培养物的形成。添加多价阳离子(Ca2+、Mg2+、Fe3+、Al3+等),可以减少细菌间的静电斥力,通过压缩双电层促进细胞聚集,进而强化颗粒污泥富集[35]。本试验中,铁离子的添加强化了厌氧氨氧化污泥的颗粒化;除减少细菌间静电斥力作用外,铁离子还是酶的常见活性剂,提高微生物代谢活性,促进微生物生长,加速厌氧氨氧化污泥的颗粒化[36]。
2.3 功能基因及厌氧氨氧化菌丰度变化
定量PCR结果显示(图4),经过130 d的富集培养,各反应器微生物的量明显提升,细菌16S rRNA 拷贝数由初始的 1.04×107copies/ng DNA 分别提高到 1.34×107copies/ng DNA (对照组 R1)、2.73×107copies/ng DNA(试验组 R2)和 3.63×107copies/ng DNA (试验组 R3);R2、R3 中丰度显著高于R1(p<0.05)。由于进水中不含有机碳源,且严格限氧,反硝化微生物受到抑制,相关的功能基因napA(编码周质硝酸盐还原酶)、narG(编码膜结合硝酸盐还原酶)、nirK(编码铜型亚硝酸还原酶)、nirS(编码细胞色素cd1型亚硝酸还原酶)的丰度显著降低。接种污泥中基因narG、napA、nirS、nirK丰度分别为 1.01×106、3.16×105、4.71×106、1.01×107copies/ng DNA,经过130 d的富集培养,其在反应器中丰度分别降至 6.86×103~8.65×103、1.96×104~4.24×104、1.47×104~6.01×104、2.70×104~5.35×104copies/ng DNA,反应器 R1、R2、R3 间无显著差异。此外,接种污泥中氨单加氧酶编码基因amoA丰度为 5.05×103copies/ng DNA,富集培养 130 d后,反应器中 amoA基因拷贝数为 2.49~2.90×102copies/ng DNA。
随着污泥的富集培养,厌氧氨氧化成为反应器主要的脱氮途径,相应的,厌氧氨氧化菌16S rRNA和功能基因hzsB丰度显著增加。富集培养130 d后,R2、R3中Anammox 16S rRNA 丰度分别为6.96×106、8.47×106copies/ng DNA,显著高于对照组 R1中丰度(p<0.05)。
联氨合成酶为厌氧氨氧化菌的重要功能蛋白[37],其编码基因hzsB丰度经富集培养过程也明显提高;130 d时,对照组R1中hzsB丰度为6.83×106copies/ng DNA,而试验组 R2、R3 中其丰度分别为 9.86×106、1.24×107copies/ng DNA,显著高于对照组 R1(p<0.05)。可以推测,铁离子对厌氧氨氧化菌富集具有一定促进作用,同时提高了厌氧氨氧化活性,也与反应器脱氮效能结果一致。
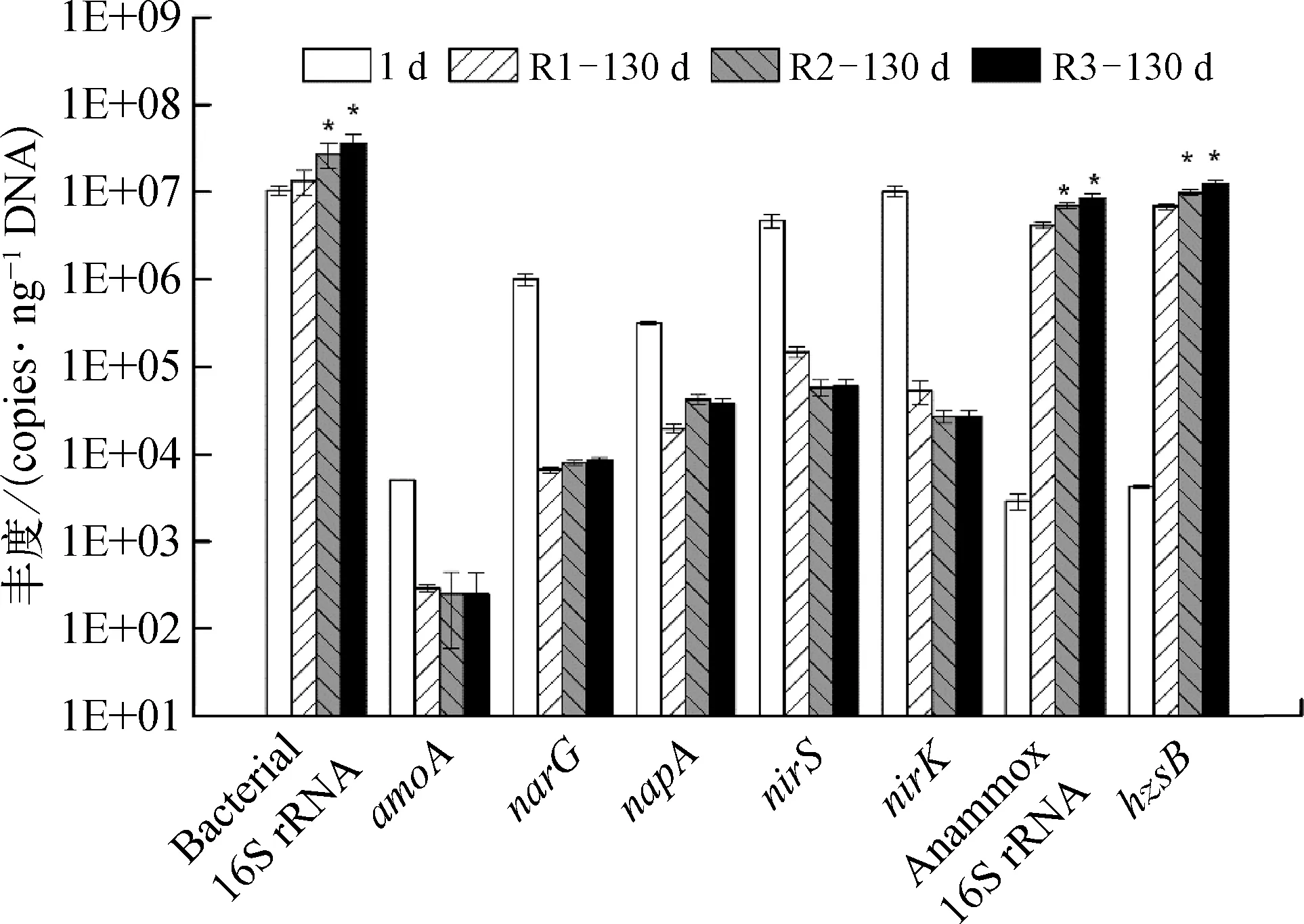
图4 铁离子对细菌、厌氧氨氧化菌及氮素转化功能基因丰度的影响Fig.4 Influence of Fe(Ⅲ)on Abundance of Bacterial 16S rRNA,Anammox 16S rRNA and Functional Genes Related to Nitrogen Transformation
2.4 微生物群落结构变化
接种污泥及富集培养130 d后,各反应器污泥微生物群落结构如图5所示。接种污泥为反硝化污泥,由图5(a)可见变形菌(Proteobacteria)和绿弯菌(Chloroflexi)为其优势菌门,分别占比 44.08%和19.11%;富集培养过程中微生物菌群结构显著改变,Proteobacteria菌丰度分别降至 31.72% (R1)、30.74% (R2)、30.52% (R3)。绿弯菌(Chloroflexi)相对丰度无明显变化,而厌氧氨氧化菌所属浮霉菌(Planctomycetes)丰度明显提高,由接种污泥中的0.20%提高至 5.10% (R1)、7.31% (R2)、9.54%(R3),试验组中富集程度较高。

图5 污泥微生物群落结构分布(a)门水平;(b)属水平(相对丰度>0.1%)Fig.5 Distribution of Dominant Bacteria in Sludge Samples(a)Phylum Level;(b)Genus Level(Relative Abundance>0.1%)
图5(b)为污泥微生物属水平热图。由图5可知,厌氧氨氧化菌Candidate Brocadia明显富集;接种污泥中Candidate Brocadia菌难以检测其丰度(<0.01%),经130 d的富集培养,对照组R1污泥样品中厌氧氨氧化菌Candidate Brocadia相对丰度为4.2%,而试验组R2、R3污泥样品中其丰度分别为6.8%、8.2%,高于对照组 R1。
3 结论
(1)进水添加铁离子富集培养厌氧氨氧化污泥过程中,试验组R2、R3与对照组R1中呈现类似的规律性,而试验组可承受容积氮负荷显著高于对照组。稳定阶段,试验组R2、R3容积氮去除速率分别为 495.6、602.4 mg-N/(L·d),为对照组 R1 的1.20和1.46倍。进水添加铁离子提高了反应器容积氮负荷及运行效能。
(2)进水添加铁离子富集培养厌氧氨氧化污泥130 d后,污泥群落结构及功能基因丰度显著变化。反硝化功能基因narG、napA、nirS、nirK丰度显著降低,厌氧氨氧化菌及微生物量富集明显。试验组R2、R3中厌氧氨氧化菌Candidate Brocadia相对丰度为6.8%、8.2%,明显高于对照组 R1(4.2%)。
[1]Mulder A,Van de graaf A A,Robertson L A,et al.Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor[J].Fems Microbiology Ecology,1995,16(3):177-183.
[2]Strous M,Vangerven E,Kuenen J G,et al.Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing(Anammox)sludge[J].Applied and Environmental Microbiology,1997,63(6):2446-2448.
[3]Mulder A.The quest for sustainable nitrogen removal technologies[J].Water Science and Technology,2003,48(1):67-75.
[4]Siegrist H,Salzgeber D,Eugster J,et al.Anammox brings WWTP closer to energy autarky due to increased biogas production and reduced aeration energy for N-removal[J].Water Science and Technology,2008,57(3):383-388.
[5]Van Loosdrecht M C M,Salem S.Biological treatment of sludge digester liquids[J].Water Science and Technology,2006,53(12):11-20.
[6]Egli K, FangerU, AlvarezP J, etal. Enrichmentand characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate[J].Archives of Microbiology,2001,175(3):198-207.
[7]Strous M,Kuenen J G,Jetten M S M.Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology,1999,65(7):3248-3250.
[8]Jetten M S,Niftrik L,Strous M,et al.Biochemistry and molecular biology of anammox bacteria[J].Critical Reviews In Biochemistry And Molecular Biology,2009,44(2-3):65-84.
[9]Jin R C,Zheng P,Hu A H,et al.Performance comparison of two anammox reactors:SBR and UBF[J].Chemical Engineering Journal,2008,138(1-3):224-230.
[10]Tao Y,Gao D W,Fu Y,et al.Impact of reactor configuration on anammox process start-up:MBR versus SBR[J].Bioresource Technology,2012,104(1):73-80.
[11]Chen C J,Huang X X,Lei C X,et al.Improving anammox startup with bamboo charcoal[J].Chemosphere,2012,89(10):1224-1229.
[12]Wang T,Zhang H M,Yang F L,et al.Start-up and long-term operation of the anammox process in a fixed bed reactor(FBR)filled with novel non-woven ring carriers[J].Chemosphere,2013,91(5):669-675.
[13]Tang C J,Zheng P,Chen T T,et al.Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process[J].Water Research,2011,45(1):201-210.
[14]Wett B. Development and implementation of a robust deammonification process[J].Water Science & Technology,2007,56(7):81-88.
[15]Strous M,Pelletier E,Mangenot S,et al.Deciphering the evolution and metabolism of an anammox bacterium from a community genome[J].Nature,2006,440(7085):790-794.
[16]Van Nifitrik L,Geerts W J C,Van Donselaar E G,et al.Combined structural and chemical analysis of the anammoxosome:A membrane-bounded intracytoplasmic compartment in anammox bacteria[J].Journal of Structural Biology,2008,161(3):401-410.
[17]Cirpus I E,Geerts W,Hermans J H,et al.Challenging protein purification from anammox bacteria[J].International Journal of Biological Macromolecules,2006,39(1):88-94.
[18]Schalk J,De Vries S,Kuenen J G,et al.Involvement of a novel hydroxylamine oxidoreductase in anaerobic ammonium oxidation[J].Biochemistry,2000,39(18):5405-5412.
[19]Shimamura M,Nishiyama T,Shigetomo H,et al.Isolation of a multiheme protein with features of a hydrazine-oxidizing enzyme from an anaerobic ammonium-oxidizing enrichment culture[J].Applied and Environmental Microbiology, 2007, 73 (4):1065-1072.
[20]Van Der Star W R L,Miclea A I,Van Dongen U G J M,et al.The membrane bioreactor:A novel tool to grow anammox bacteria as free cells[J].Biotechnology and Bioengineering,2008,101(2):286-294.
[21]国家环境保护总局,水和废水监测分析方法[M].北京:中国环境科学出版社,2002.
[22]He S,Gall D L,Mcmahon K D.“Candidatus accumulibacter”population structure in enhanced biological phosphorus removal Sludges as revealed by polyphosphate kinase genes[J].Applied and Environmental Microbiology,2007,73(18):5865-5874.
[23]Tsushima I,Ogasawara Y,Kindaichi T,et al.Development of high-rate anaerobic ammonium-oxidizing (anammox)biofilm reactors[J].Water Research,2007,41(8):1623-1634.
[24]Francis C A,Roberts K J,Beman J M,et al.Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(41):14683-14688.
[25]Bru D,Sarr A,Philippot L.Relative abundances of proteobacterial membrane-bound and periplasmic nitrate reductases in selected environments[J].Applied and Environmental Microbiology,2007,73(18):5971-5974.
[26]Throback I N,Enwall K,Jarvis A,et al.Reassessing PCR primers targeting nirS,nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J].Fems Microbiology Ecology,2004,49(3):401-417.
[27]Yan T F,Fields M W,Wu L Y,et al.Molecular diversity and characterization of nitrite reductase gene fragments(nirK and nirS)from nitrate-and uranium-contaminated groundwater[J].Environmental Microbiology,2003,5(1):13-24.
[28]Zhu G,Wang S,Wang W,et al.Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces[J].Nature Geoscience,2013,6(2):103-107.
[29]Chamchoi N,Nitisoravut S.Anammox enrichment from different conventional sludges[J]. Chemosphere,2007,66(11):2225-2232.
[30]Fernandez I,Dosta J,Fajardo C,et al.Short-and long-term effects of ammonium and nitrite on the anammox process[J].Journal of Environmental Management,2012,95:S170-S174.
[31]Jin R C,Yu J J,Ma C,et al.Performance and robustness of an ANAMMOX anaerobic baffled reactor subjected to transient shock loads[J].Bioresource Technology,2012,114:126-136.
[32]Dapena-Mora A,Fernandez I,Campos J L,et al.Evaluation of activity and inhibition effects on anammox process by batch tests based on the nitrogen gas production[J].Enzyme and Microbial Technology,2007,40(4):859-865.
[33]Lotti T,Van Der Star W R,Kleerebezem R,et al.The effect of nitrite inhibition on the anammox process[J].Water Research,2012,46(8):2559-2569.
[34]Chen H,Yu J J,Jia X Y,et al.Enhancement of anammox performance by Cu(II),Ni(II)and Fe(III)supplementation[J].Chemosphere,2014,117(1):610-616.
[35]Fernandez I,Vazquez-Padin J R,Mosquera-Corral A,et al.Biofilm and granular systems to improve anammox biomass retention[J].Biochemical Engineering Journal,2008,42(3):308-313.
[36]金仁村,郑平,胡宝兰,等.污泥颗粒化快速启动厌氧氨氧化反应器的探讨[J].环境污染与防治,2006,28(10):772-775.
[37]Harhangi H R,Le Roy M,Van Alen T,et al.Hydrazine synthase,a unique phylomarker with which to study the presence and biodiversity ofanammox bacteria[J]. Applied and Environmental Microbiology,2012,78(3):752-758.
