产氨基甲酸乙酯降解酶酵母菌的选育及产酶条件优化
2018-01-23姚晓瑞宁高飞飞王斌肖婧史学伟
姚晓瑞宁,高飞飞,王斌,肖婧,史学伟*
(1.石河子大学 食品学院, 新疆 石河子 832000;2.石河子大学 信息科学与技术学院,新疆 石河子 832000)
氨基甲酸乙酯(Ethyl carbamate)是一种普遍存在于发酵食品中的有毒有害物质[1,2]。从20世纪40年代开始,不断有科学家证实了EC的致癌性,许多国家也出台了酒精饮料中EC含量的限值。2007 年,IARC(the International Agency for Research on Cancer)经评估后提升了EC的危险等级,将其从2B类致癌物质提高为2A类致癌物质[3]。几年来用于降低食品中EC含量的方法主要集中在减少前体物质、生产工艺调节和添加EC降解酶这几个方面,而酶解法无疑是最有效、最直接的途径。而作为大多数食品中的主要发酵剂,酵母菌的发酵产酶性能一直是近年来大家关注的焦点,本实验通过大量筛选,发现了一株可以降解EC的酵母菌,并对其产酶条件进行了优化,明显提升了酶活,对EC的降解起到了良好的作用。
1 材料与方法
1.1 材料
1.1.1 原料
来自新疆石河子周边团场、新疆巴音郭楞蒙古自治州各大葡萄产区的酿酒葡萄。
1.1.2 培养基
YEPD培养基:蛋白胨2%、酵母浸粉1%、琼脂2%,均为美国Sigma公司生产;葡萄糖2%(天津致远化学试剂有限公司),自然pH,115 ℃灭菌30 min。
筛选培养基[4-6]:氯化钠0.2%、磷酸二氢钾0.25%、硫酸铵0.4%、氯化锰0.01%、硫酸锌0.015%,以上试剂均购自天津致远化学试剂有限公司,氨基甲酸乙酯0.25%(美国Sigma公司),pH 5,115 ℃灭菌30 min。
发酵培养基:蛋白胨1%、酵母浸粉1%、葡萄糖2%、氨基甲酸乙酯0.2%,自然pH。
1.1.3 主要试剂
BioFlux DNA试剂盒;BIOWEST琼脂糖;Trans2K DNA Marker;2×Easy Taq PCR SuperMix;柠檬酸;柠檬酸钠;氯化铵;硫酸,均购自天津致远化学试剂有限公司。
1.1.4 主要仪器设备
分光光度计、离心机、PCR仪、电泳仪、血球计数板。
1.2 实验方法
1.2.1 菌株分离和纯化
用20 mL无菌水浸泡洗涤新疆酿酒葡萄,将表皮上的微生物洗入无菌水中,取1 mL洗涤液进行梯度稀释,每个稀释梯度涂布3个平板(YEPD培养基),28 ℃培养24 h,将平板上不同形态的菌株单独划线培养,每株菌3个平行,通过显微镜观察,挑选出具有酵母菌形态的菌株。接入到筛选培养基中,在以EC为唯一碳源的培养基上能生长的菌株具有能降解EC的能力[7]。
1.2.2 菌株鉴定
吸取1 mL液体培养基转移入1.5 mL离心管中,14000 r/min离心3 min,弃上清液,沉淀为目的菌株。使用BioFlux DNA试剂盒提取DNA;PCR扩增条件为:50 μL反应体积,95 ℃ 预变性5 min,95 ℃ 变性1 min,52 ℃ 退火2 min,72 ℃ 延伸1 min,循环35次,72 ℃ 延伸10 min[8]。取3 μL PCR产物于1%琼脂糖凝胶中进行电泳,条带清晰,送上海生工生物工程股份有限公司测序,测序结果经NCBI Blast比对。
1.2.3 EC酶活定义
常温常压、中性pH条件下,每1 min分解EC产生1 nmol氨或1 nmol乙醇的酶量为1个酶活单位(U)。
1.2.4 粗酶液的制备
将筛选出的菌株接入不加琼脂的液体筛选培养基中,培养48 h,离心将菌种分离,用柠檬酸缓冲液(pH 5)洗涤2次,离心沉淀。冰浴超声破碎,破碎液于4 ℃ 12000 r/min离心5 min,取上清液,即为粗酶液[9]。
1.2.5 酶活测定方法
取2支试管,分别加入200 μL EC溶液,25 ℃水浴加热40 min,向2支试管中分别加入100 μL粗酶液,向其中一支试管中加入50 μL 0.1 mol/L硫酸使酶失活,作为空白对照,另一支试管放入25 ℃,水浴1.5 h,后同样加入50 μL 0.1 mol/L硫酸终止反应,按照Berthelot 反应显色法,在波长625 nm下测定吸光值,计算酶活[10-12]。
1.2.6 标准曲线绘制
用氯化铵配制不同浓度的标准溶液,在波长625 nm下测定吸光值,绘制标准曲线。
1.2.7 菌株产酶优化
在实验前,先用血球计数板计算液体培养基中酵母菌的个数,在做每个因素的实验前,用无菌水将菌液稀释至相同的数量级,减少试验误差。本文统一为106数量级。
1.2.7.1 发酵温度对产酶的影响
将菌株按发酵培养基体积的2%添加,分别在24,26,28,30,32 ℃,培养7天,测定其产酶能力。
1.2.7.2 初始pH对产酶的影响
将菌株按发酵培养基体积的2%添加,初始pH调整为4,5,6,7,8,9,10,在28 ℃培养7天,测定其产酶能力。
1.2.7.3 接种量对产酶的影响
将菌株按发酵培养基的1%,2%,3%,4%,5%添加,pH 6,28 ℃培养7天,测定其产酶能力。
1.2.8 酶学性质分析
1.2.8.1 pH对酶活性的影响
分别配制pH为4.0,5.0,6.0,7.0,8.0,9.0,10.0的缓冲液,加入粗酶液,测定酶的最适反应pH。
1.2.8.2 温度对酶活的影响
将粗酶液置于25,30,35,40,45 ℃下,分别测定酶活。
1.2.8.3 热稳定性研究
将粗酶液置于30,40,50 ℃下保温100 min,间隔20 min测1次酶活。
1.2.8.4 金属离子对酶活性的影响
将粗酶液中加入1 mmol/L的不同种金属离子(Cu2+,Fe2+,Ca2+,Mn2+),35 ℃放置12 h,测定酶活,去离子水做空白。
2 结果与分析
2.1 菌株分离
从葡萄表皮共分离出120株菌,其中按照形态学挑选出50株酵母菌[13],经筛选培养基筛选出1株生长良好的菌株,见图1。

图1 酵母菌形态 Fig.1 Morphology of yeast
2.2 菌株鉴定
PCR扩增产物电泳条带大约在500 bp左右,ITS核酸序列测序结果为:GGGTTACTGCTGATTTATATCTTATACACATGCGTGAGCGCACCAAACACCTAAAATTGTAATAATACCATGTCACTAAGTTTTAACAAAACAAAACTTTCAACAACGGATCTCTTGGTTCTCGCATCGATGAAGAGCGCAGCGAAATGCGATACCTAGTGTGTTGCAGCCATCGTGAATCATCGAGTTCTTGAACGCACATTGCGCCCCATGGTATTCCATGGGGCATGCCTGTCTGAGCGTCGTTTCCTTCTTGCGCAAGCAGAGTTGAGAACAGGCTATGCCTTTTTCGAAATGGAACGTCGTGGACGAAGTGAACTAAACATTTAGCACGCTTTGGCCGCCGAACTTTTAACTAAGCTCGACCTCAGATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAAAAGGCGGAGGAA;经Blast同源性比对,结果显示为与PichiafermentansKY076614.1 的ITS核酸序列相似度为97%。PCR扩增产物琼脂糖凝胶电泳见图2。菌株YX22 ITS 基因发育树见图3。

图2 PCR扩增产物琼脂糖凝胶电泳Fig.2 PCR amplification product agarose gel electrophoresis

图3 菌株YX22 ITS 基因发育树Fig.3 The ITS genetic tree of strain YX22
2.3 标准曲线
NH4+测定标准曲线见图4。
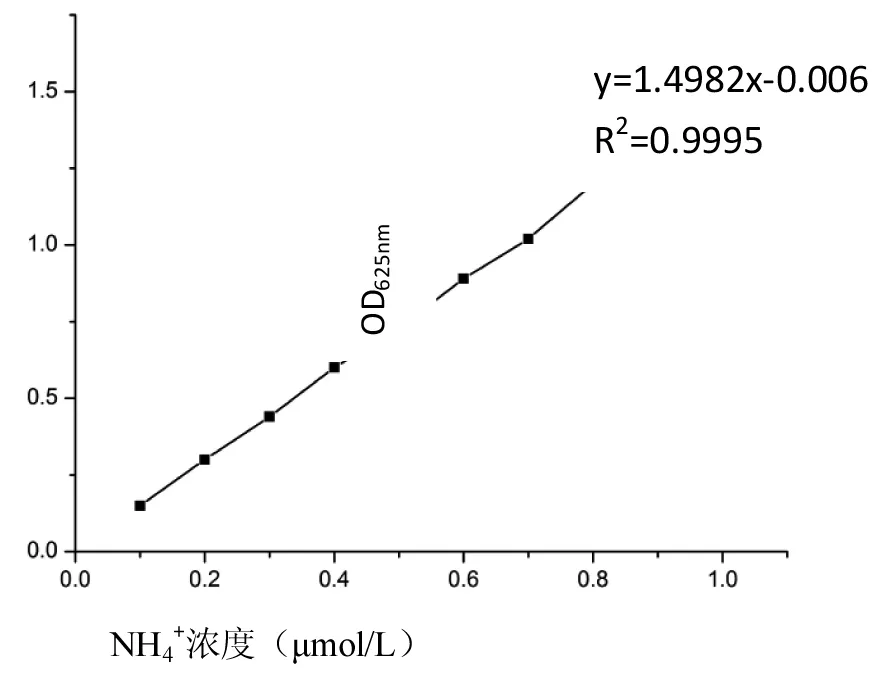
图4 NH4+测定标准曲线Fig.4 The standard curve of NH4+
2.4 菌株产酶优化
2.4.1 温度对产酶的影响

图5 温度对产酶的影响Fig.5 Effect of temperature on enzyme production
由图5可知,酵母菌随着温度增加产酶能力逐渐增加,在28 ℃时产酶活力较高,之后随着温度增加产酶能力逐渐降低,但在26~30 ℃的范围内,产酶性能均良好。
2.4.2 初始pH对产酶的影响

图6 pH对产酶的影响Fig.6 Effect of pH on enzyme production
由图6可知,在pH 4~10的范围内,菌株产酶能力出现先增后降,在pH 4~7的范围内平稳增长,pH>7之后出现明显下降,证明菌株在pH中性偏酸性时有良好的产酶能力,优势明显。
2.4.3 接种量对产酶的影响

图7 接种量对酶活的影响Fig.7 Effect of inoculation amount on enzyme activity
一般来说,接种量越大,积累的酶越多,但是在实验室封闭培养的条件下,营养物质有限,如果接种量过多,会使得单个酵母菌细胞能利用的营养物质变少,从而减少产酶量,由图7可知,接种量在2.5%时产酶量明显增加。
2.5 酶学性质分析
2.5.1 最适pH

图8 pH对酶活的影响Fig.8 Effect of pH on enzyme activity
由图8可知,当pH由4上升到7时,酶活力稳步增加,高于7时则大幅下降,说明此酶的耐酸性较好,而碱性环境会使其活力降低,原因可能是碱性环境破坏了酶的正常结构,从而影响了酶的活力;pH在6~7时,酶活力变化不大,故最适pH为6~7。
2.5.2 最适温度及热稳定性

图9 温度对酶活的影响Fig.9 Effect of temperature on enzyme activity
由图9可知,温度在低于30 ℃的范围内,随着温度的增加,酶活力增大;温度高于30 ℃时,酶活力逐渐降低,在30 ℃时,酶活力最高。
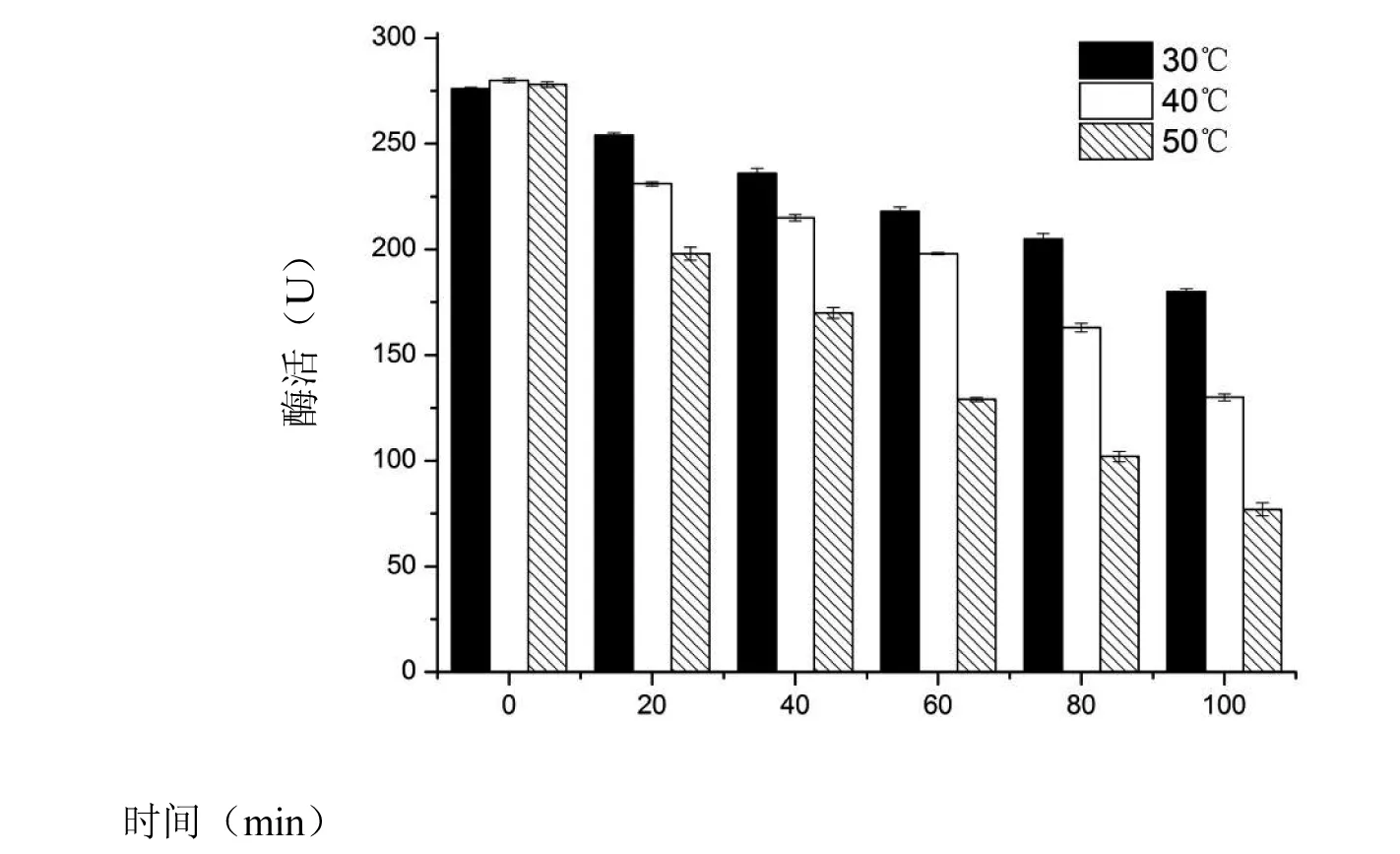
图10 热稳定性Fig.10 Thermal stability
由图10可知,在各个温度条件下,酶的活性都相对稳定,在30 ℃下保温100 min后,酶的活力仍保留74%,证明在此温度下酶的活性有良好的稳定性;在40 ℃和50 ℃的条件下,保温100 min后,酶活力分别剩余59%和44%,说明此酶在高温条件下不稳定,易失活。
2.5.3 金属离子对蛋白活性的影响

表1 金属离子对酶活力的影响Table 1 Effect of metal ions on enzyme activity
由表1可知,Cu2+和Fe2+对酶活力有激活作用,而Ca2+和Mn2+均有抑制酶活的作用,其中Fe2+的激活作用最明显,而Ca2+的抑制作用最明显。
3 结论
在葡萄酒酿造过程中,酿酒酵母和细菌的共同发酵作用产生了EC,从1971 年,Löfroth等[14,15]在葡萄酒、啤酒中发现了EC,到1976 年,Ough[16]证明了葡萄酒中含有EC,之后陆续的研究也证明了葡萄酒中EC的致癌性,而EC的前体物质众多,它本身又是一种化学性质稳定的物质,所以用生物产酶降解的方法是目前认为最可靠的方法;1990 年,Fujinawa S等[17]成功将酸性脲酶应用于葡萄酒中,使得酒液中的尿素减少,从而降低EC的含量。本实验从酿酒酵母表皮上成功分离纯化了一株酵母菌,通过ITS序列测定分析后确定为发酵型毕赤酵母(Pichiafermentans);酶学性质研究表明:该酵母菌最适产酶温度为28 ℃,最适产酶初始pH为7,最适产酶接种量为2.5%;该酵母菌所产酶的最适pH为6~7,最适温度为30 ℃,并且在此温度下酶活稳定性较好,Fe2+对此酶有激活作用,说明金属离子可以提高该酶的活性。将可以产EC酶的酵母菌作为发酵剂直接或者混合加入,会更直接、更有效地降低酒精饮料中EC的含量。
[1]Lee K G.Analysis and risk assessment of ethyl carbamate in various fermented foods[J].European Food Research and Technology,2013,236(5):891-898.
[2]Xia Q,Niu M,Wu C,et al.Formation of ethyl carbamate in Goji wines: effect of Goji fruit composition[J].Food Science and Biotechnology,2016,25(3):921-927.
[3]Baan R,Straif K,Grosse Y,et al.Carcinogenicity of alcoholic beverages[J].Lancet Oncology,2007,8(4):292-293.
[4]沈敏佳,陆筑凤,刘颖,等.氨基甲酸乙酯降解酶的基因克隆[J].中国酿造,2014,33(1):56-59.
[5]Zhao C J,Kobashi K.Urethanase in rat tissues[J].Journal of Toxicology & Environmental Health,1992,37(1):37-45.
[6]Wang P,Sun J,Li X,et al.Contribution of citrulline to the formation of ethyl carbamate during Chinese rice wine production[J].Food Additives & Contaminants, 2014,31(4):587.
[7]赵雅敏.红酵母降解中国黄酒中氨基甲酸乙酯的研究[D].无锡:江南大学,2012.
[8]陈杰,赵雨薇,倪永清,等.新疆石河子地区酵母菌的生物多样性及系统发育研究[J].中国酿造,2012,31(11):102-105.
[9]Gu X L,Tian Y P.Isolation and characterization of urethanase fromPenicilliumvariabileand its application to reduce ethyl carbamate contamination in Chinese rice wine[J].Applied Biochemistry and Biotechnology,2013,170(3):718-728.
[10]Weatherburn M W.Phenol-hypochlorite reaction for determination of ammonia[J].Analytical Chemistry,1967,39(8):971-974.
[11]杨广明,査小红,田亚平.一种氨基甲酸乙酯和尿素降解酶产生菌的鉴定及酶学特性[J].食品与生物技术学报,2015,34(1):7-14.
[12]李京京,方芳,张继冉,等.氨基甲酸乙酯水解酶的分离纯化及酶学性质[J].食品与生物技术学报,2014,33(12):1239-1245.
[13]胡瑞卿.酵母菌的特征与鉴定手册[M]:青岛:青岛海洋出版社,1991.
[14]Löfroth G,Gejvall T.Diethyl pyrocarbonate: formation of urethan in treated beverages[J].Science,1971,174(4015):1248-1250.
[15]Nóbrega I C C,Pereira G E,Silva M,et al.Improved sample preparation for GC-MS-SIM analysis of ethyl carbamate in wine[J].Food Chemistry,2015,177:23-28.
[16]Ough C S.Ethylcarbamate in fermented beverages and foods.I.Naturally occurring ethylcarbamate[J].Journal of Agricultural & Food Chemistry,1976,24(2):323.
[17]Fujinawa S,Burns G,De L T P.Application of acid urease to reduction of urea in commercial wines[J].American Journal of Enology & Viticulture,1990,41(4):350-354.
