毛霉型豆豉发酵菌株分离鉴定与酶活分析
2018-01-23任璐刘思雨钟燕索化夷
任璐,刘思雨,钟燕,索化夷*
(1.西南大学 食品科学学院,重庆 400715;2.重庆第二师范学院 重庆市功能性食品协同创新中心,重庆 400067)
参与豆豉发酵的微生物与豆豉品质、风味及酶活等密切相关。豆豉制曲阶段的优势霉菌是总状毛霉[5],豆豉中纤维素酶、蛋白酶等酶活性决定了粗纤维、蛋白质等降解速度,影响豆豉的色泽变化、质构变化[6]。毛霉型豆豉采用自然发酵工艺,发酵周期长,没有一种优良而稳定的发酵剂。张雨浩等[7]发现酶通过催化蛋白质降解,为黑色素形成提供底物。孙森等[8]分析了天然发酵豆豉中的微生物菌相及关键酶酶活变化。目前对毛霉型豆豉微生物区系、黑色素形成机理等方面的深入研究较多,但对毛霉菌株发酵能力的评价较少。
本文从永川豆豉和三台豆豉中分离得到2株总状毛霉,对其蛋白酶、纤维素酶和β-葡萄糖苷酶的酶活力进行分析,对传统毛霉型菌株间的差异做一简要阐述,为毛霉型豆豉安全高效发酵剂的研发,实现豆豉的规模化工业生产奠定基础。
1 材料与方法
1.1 材料
该实验材料采自永川豆豉食品有限公司和四川省三台县三台农产品开发有限责任公司。
1.2 实验试剂
美国OMEGA公司生产的真菌DNA提取试剂盒(Fungal DNA Min Kit)、dNTP Mixture(10 mmol/L)、Taq Plus(5 U/μL)、10×Taq Plus Buffer(含Mg2+)、6×DNA Loading Buffer、λDNA/HindⅢMarker、LD2000 plus DNA Ladder、Gold View Ⅰ型核酸染料、50×TAE;
福林试剂(Folin试剂)、3,5-二硝基水杨酸(DNS)、三氯乙酸、干酪素、水杨素等均为分析纯(AR);
马铃薯葡萄糖琼脂培养基(PDA)[9]、麸皮培养基。
1.3 实验仪器
Mini-PROTEAN Tetro Cell核酸电泳系统 美国Bio-RAD公司;G:Box EF 凝胶成像系统 英国Syngene公司;EDC-810 双槽PCR仪 东胜创新生物科技有限公司;光学显微镜。
1.4 实验方法
1.4.1 毛霉的分离纯化
取永川豆豉样品25 g至锥形瓶中,加225 mL灭菌纯水,于搅拌器上搅拌均匀。取1 mL上清液于EP管中,即为10-1稀释度的样液,依次按10倍稀释6次,分别得到10-2,10-3,10-4,10-5,10-6,10-7稀释度的样液。取0.1 mL不同稀释度的样液,涂布PDA平板,每种稀释度做3个平行平板,倒置在28 ℃恒温培养箱中培养,每隔24 h观察1次。3~5天后根据菌落形态和孢子颜色分离平板上生长的所有菌种,在PDA平板中划线接种于28 ℃培养,3~5天后重复分离步骤,直至分离出所有纯化菌种,并在光学显微镜下观察找到毛霉菌落。三台豆豉做相同处理。
1.4.2 分离菌株的分子生物学鉴定
1.4.2.1 DNA的提取
参考Chen等[10]的方法,用真菌DNA试剂盒(Fungal DNA Min Kit)提取毛霉DNA。
1.4.2.2 PCR扩增
取5 μL引物NS1(5'-GTAGTCATATGCTTGTCTC-3')、5 μL引物Fung(5'-ATTCCCCGTTACCCGTTG-3')、5 μL dNTP Mixture(10 mmol/L)、5 μL Taq Plus(5 U/μL)、25 μL 10×Taq Plus Buffer(含Mg2+)和195 μL灭菌超纯水混匀。取24 μL混合液与1 μL提取的DNA样品配成PCR体系,另取24 μL混合液加入1 μL灭菌超纯水作空白,放入PCR仪中进行相应的PCR,得到PCR扩增产物。
1.4.2.3 DNA的电泳
选用0.8%的琼脂糖凝胶,5 μL λDNA/HindⅢMarker加入样品池的一端,1 μL 6×DNA Loading Buffer与5 μL DNA样品混匀后依次加入样品池。在80 V恒定电压下电泳50 min,在凝胶成像系统中观察结果并分析。
用1.4%的琼脂糖凝胶对PCR扩增产物进行电泳检测,5 μL D2000plus DNA Ladder加入样品池的一端,其他条件同上。
1.4.2.4 测序与鉴定
PCR产物测序由华大基因完成,测序结果通过NCBI中的BLAST程序寻找与其有最大同源性的序列,最终确定2株菌的种属关系。
1.4.3 测定酶活
1.4.3.1 制备待测酶液
纯化的毛霉接种到麸皮培养基,培养48天后加pH为7.2的磷酸缓冲液10 mL,破碎后在40 ℃抽提1 h,离心(3500 r/min),离心液备用。
1.4.3.2 蛋白酶活测定
参照GB/T 23527-2009的方法测定[11]。
绘制标准曲线:以不同浓度的酪氨酸与福林试剂反应测出的OD660值为横坐标,酪氨酸的浓度为纵坐标,绘制成标准曲线。
取待测离心液1 mL于40 ℃水浴预热2 min,加1 mL同样预热的酪蛋白,精确保温10 min后加0.4 mol三氯乙酸2 mL,保温20 min使残余蛋白质沉淀后离心。另取试管加滤液1 mL,0.4 mol碳酸钠5 mL和福林试剂1 mL,摇匀后40 ℃保温发色20 min并进行光密度(OD)测定。每个样品做3个平行和空白对照。空白实验在加酪蛋白之前先加0.4 mol三氯乙酸2 mL使酶失活,其他测定方法相同。
结果处理得到样品蛋白酶活力单位如下:
式中:A为由样品测得OD值,查标准曲线得相当的酪氨酸微克数(或OD值×K);4为4 mL反应液取出1 mL测定;N为酶液稀释的倍数;10为反应10 min;W为样品水分百分含量。
1.4.3.3 纤维素总体酶活测定(FPA活力单位测定)
绘制标准曲线:取不同浓度的标准葡萄糖溶液和DNS显色剂各2 mL,沸水浴10 min后定容至15 mL,测OD550值。以OD值为横坐标,葡萄糖的mg数为纵坐标绘制标准曲线。
试管内加0.2 mL待测酶液和pH为4.8醋酸缓冲液1.8 mL,预热至50 ℃后加1×6 cm滤纸条,在50 ℃恒温水浴60 min,加DNS显色剂2 mL并沸水浴加热10 min,冷却后加水至15 mL,测OD550值。
1.4.3.4 β-葡萄糖苷酶活测定(Cb酶活力单位测定)
参照Cheng[12]的方法,改进后进行毛霉β-葡萄糖苷酶活测定。
试管内加0.2 mL待测酶液和1.8 mL水杨素(1%),置50 ℃恒温水浴60 min后加DNS显色剂2 mL,沸水浴加热10 min,冷却后加水至15 mL,测OD550值。
结果处理,得到纤维素酶活力活力单位如下:
式中:x为样品OD值的平均值;b和a由葡萄糖浓度和相应的OD值通过回归方程求得;n为酶液稀释的倍数;T为酶促反应的时间;0.2为所加酶液的量。
2 结果与分析
2.1 电泳图像分析
提取不同毛霉的总DNA时,YC-1在Marker 23130 bp附近出现条带,条带完整,样本提取成功,得到目的片段。
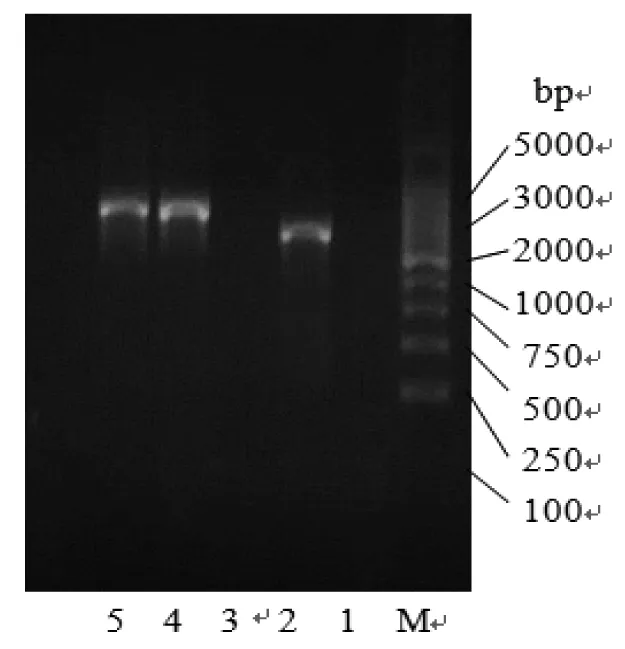
图1 提取不同毛霉的DNA片段的图像Fig.1 The image of DNA's fragment extraction from different mucor
注:M为Marker,1为空白,2和3为YC-1,4和5为ST-1。
由图1可知,提取不同毛霉的DNA片段时,在Marker附近出现2,4,5号3条条带,条带清晰明亮,阴性对照无条带,2个样本扩增成功。
2.2 菌株鉴定

表1 两株菌种的鉴定Table 1 Identification of two kinds of strains
由表1可知,菌株YC-1和ST-1鉴定成功,片段长度分别为677和679,同源性都为99%,鉴定出2株菌种皆为总状毛霉。
2.3 酶活比较

图2 酪氨酸标准曲线Fig.2 Standard curve of tyrosine
根据标准曲线计算样品的蛋白酶活。在40 ℃下每1 min水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。
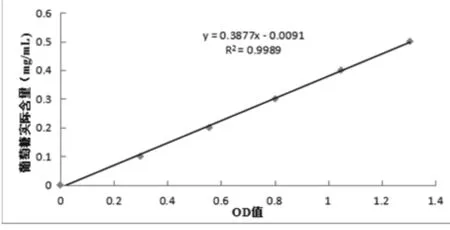
图3 葡萄糖标准曲线Fig.3 Standard curve of glucose
由图3可知,样品的纤维素总体酶活和β-葡萄糖苷酶活。1 mL酶液在50 ℃,pH为4.8条件下,每1 min水解1×6 cm的滤纸产生1 μg还原糖(以葡萄糖计)的酶量定义为1个纤维素总体酶活力单位。1 mL酶液于50 ℃,pH为4.8条件下,每1 min水解1%水杨素溶液产生1 μg还原糖(以葡萄糖计)的酶量定义为1个β-葡萄糖苷酶活力单位。
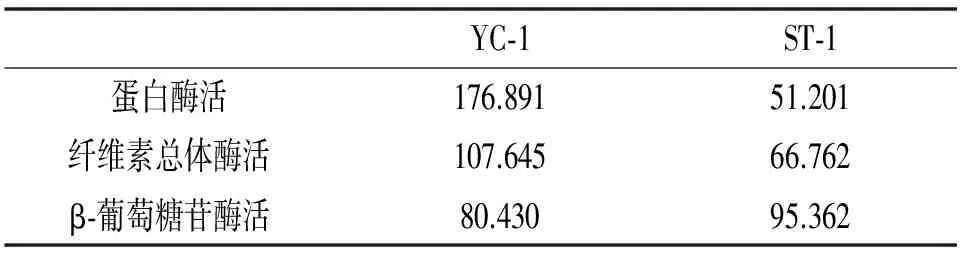
表2 两种毛霉的酶活比较Table 2 Comparison of enzyme activities of two kinds of mucor U/mL
蛋白酶活性是评价豆豉发酵过程的重要指标,蛋白酶将大分子蛋白水解成小分子多肽和氨基酸以及各种香气成分。蛋白酶活性高低反映了豆豉中蛋白质水解的速度,决定了豆豉发酵成熟的周期[13]。在以蛋白质为主要成分的大豆制品中,蛋白酶活力的高低对豆豉发酵过程及蛋白质降解有重要影响。如果豉曲的质量不高,分泌的蛋白酶不足,影响成品成熟时间和营养价值[14]。
由表2可知,YC-1和ST-1的蛋白酶活分别为176.891 U/mL和51.201 U/mL,且YC-1的蛋白酶活性明显高于ST-1。与索化夷等研究发现永川豆豉制曲过程中酸性蛋白酶的最高酶活性291 U/g相比较低,发酵后阶段永川豆豉蛋白酶活力降低到50~175 U/g。在自然发酵条件下,曲霉型自然发酵豆豉过程中的蛋白酶活性最高为190.24 U/g[15,16],与YC-1相比差异不大,与ST-1的差异很大。在曲霉型和毛霉型豆豉研究中也表明可以通过降低食盐含量,提高蛋白酶活性的方法缩短发酵周期。选育高活性蛋白酶产生菌是缩短发酵周期和提高风味最简单和行之有效的方法[17]。
豆豉发酵过程中纤维素酶活性高低决定了大豆纤维素的降解程度,大豆纤维素的降解会降低豆豉的硬度、弹性和咀嚼度等质构指标。由表2的测定结果发现,YC-1和ST-1的纤维素总体酶活分别为107.645 U/mL和66.762 U/mL,YC-1的酶活显著高于ST-1的酶活。索化夷等[18]发现在毛霉型制曲阶段,豆豉纤维素酶活由发酵初期的0.54 U/g上升到制曲结束时的1.37 U/g,进入后发酵阶段纤维素酶的活性开始下降,在豆豉成熟时仅为0.03 U/g。以上表明YC-1和ST-1的纤维素总体酶活较高,其中YC-1的酶活高于ST-1的酶活。
微生物分泌β-葡萄糖苷酶作用于异黄酮糖苷,将大豆中糖苷型异黄酮向苷元型异黄酮转化,而苷元型异黄酮更具有功能活性。因而,对β-葡萄糖苷酶活性的研究有助于提高发酵豆制品的功能物质。由表2可知,YC-1和ST-1的β-葡萄糖苷酶活分别为80.430 U/mL和95.362 U/mL,且ST-1的酶活稍高于YC-1的酶活。β-葡萄糖苷酶作用于异黄酮,增强了发酵豆制品的功能性,为功能性豆豉的生产提供了参考。
3 结论
毛霉是毛霉型豆豉发酵的主要菌株,其优势霉菌是总状毛霉。从永川豆豉和三台豆豉中分离到2株毛霉YC-1和ST-1,经分离、纯化、测序,鉴定为总状毛霉。
2株总状毛霉3种酶的酶活不同,YC-1和ST-1产蛋白酶活分别为176.891 U/mL和51.201 U/mL;产纤维素总体酶活分别为107.645 U/mL和66.762 U/mL;产β-葡萄糖苷酶活分别为80.430 U/mL和95.362 U/mL。总体来说,YC-1酶活力情况高于ST-1的酶活力。
[1]Wang D,Wang L J,Zhu F X,et al.In vitro and in vivo studies on the antioxidant activities of the aqueous extracts of Douchi (a traditional Chinese salt-fermented soybean food)[J].Food Chemistry,2008,107(4):1421-1428.
[2]Liu Y Q,Wang L J,Cheng Y Q,et al.Isoflavone content and anti-acetylcholinesterase activity in commercial douchi:a traditional Chinese salt-fermented soybean food[J].Japan Agricultural Research Quarterly,2009,43(4):301-307.
[3]Li F J,Yin L J,Lu X,et al.Changes in angiotensin I-converting enzyme inhibitory activities during the ripening of douchi (a Chinese traditional soybean product) fermented by various starter cultures[J].International Journal of Food Properties,2010,13(3):512-524.
[4]Wang H,Li Y Y,Cheng Y Q,et al.Effect of the maillard reaction on angiotensin i-converting enzyme (ace)-inhibitory activity of douchi during fermentation[J].Food and Bioprocess Technology,2013,6(1):297-301.
[5]索化夷,赵欣,骞宇,等.永川毛霉型豆豉在发酵过程中微生物总量与区系变化规律[J].食品科学,2015,36(19):124-131.
[6]Rhyu M,Kim E.Umami taste characteristics of water extract of Doenjang,a Korean soybean paste:low-molecular acidic peptides may be a possible clue to the taste[J].Food Chemistry,2011,127(3):1210-1215.
[7]张雨浩,马良,周梦柔,等.永川豆豉发酵过程中蛋白水解作用与黑色素形成关系[J].食品科学,2013,34(19):195-199.
[8]孙森.天然发酵豆豉后发酵过程的动态分析[D].济南:山东轻工业学院,2008.
[9]张初署,刘阳,邢福国,等.七种培养基对黄曲霉分离效果的比较[J].核农学报,2013,27(2):208-212.
[10]Chen A J,Tang D,Zhou Y Q,et al.Identification of ochratoxin:a producing fungi associated with fresh and dry liquor rice[J].Plos One,2013,8(10):78285.
[11]GB/T 23527-2009,蛋白酶制剂[S].
[12]Cheng Y Q,Zhu Y P,Hu Q,et al.Transformation of isoflavones during Sufu (a traditional chinese fermented soybean curd) production by fermentation with Mucor flavus at low temperature [J].Inter J Food Prope,2011,14(3):629-639.
[13]刘锦绣.豆豉混菌发酵及其功能成分的研究[D].泰安:山东农业大学,2013.
[14]索化夷,卢露,吴佳敏,等.永川豆豉在传统发酵过程中基本成分及蛋白酶活性变化[J].食品科学,2011,32(1):177-180.
[15]管泳宇.曲霉型豆豉发酵分析及人工接种发酵研究[D].扬州:扬州大学,2013.
[16]管泳宇,于海,葛庆丰,等.曲霉型豆豉后发酵过程的初步研究[J].食品与生物技术学报,2013(2):212-218.
[17]杨林,王筱兰,杨慧林,等.1株传统曲霉型豆豉中高活力蛋白酶产生菌的分离及其鉴定[J].江西师范大学学报(自然科学版),2015(5):497-501.
[18]索化夷,赵欣,骞宇,等.永川豆豉发酵过程中质构色泽形成规律[J].食品与发酵工业,2016,42(7):80-85.
