南极磷虾酶解液脱氟工艺研究
2018-01-23黄俊伟崔春郑雪君陈智光
黄俊伟,崔春*,郑雪君,陈智光
(1.华南理工大学 食品科学与工程学院,广州 510640; 2.广东真美食品股份有限公司,广东 潮州 521000)
南极磷虾(Euphausiasuperba),其蛋白氨基酸组成丰富,必需氨基酸齐全且高于WHO/FDA的推荐值。南极磷虾蛋白消化率高,生物价也高于其他肉类蛋白和奶类蛋白[1]。但目前南极磷虾主要在水产养殖业和钓鱼业中用作饲料,产品附加值低。酶解处理是提高南极磷虾蛋白利用率和产品附加值的有效手段,许多研究表明南极磷虾酶解液具有抗氧化[2]、抑制有害菌[3]、预防骨质疏松[4]、降血压[5]等生理活性。氟是一种具有双阈值的微量元素,适量的氟可以促进骨质生长、预防龋齿,但过量的氟会导致人体出现氟斑牙和氟骨病等症状。国家标准GB 2762-2005和农业行业标准NY 5073-2006规定鱼类(淡水)的氟含量不得超过2 mg/kg,中国卫生部在1981年规定3.5 mg/kg为每人每日氟安全摄入量[6]。南极磷虾具有富氟特性,氟含量高达1102~1432 mg/kg,即使是南极磷虾酶解液其氟含量也一般在40~70 mg/kg[7]。因此,从食用安全性的角度考虑,对南极磷虾酶解液进行脱氟处理显得尤为必要。
关于南极磷虾酶解液脱氟方面的研究目前已有许多报道。李红艳等利用电渗析法将酶解液氟含量从58.97 mg/kg降低至1.25 mg/kg,但酶解液营养价值损失严重,氨氮和总氮分别损失14.9%和19.0%。该学者也采用纳滤法对酶解液进行脱氟处理,氟含量由49.97 mg/kg 降低至2.45 mg/kg,但氨氮损失率和总氮损失率分别高达15.7%和22.5%。吕传萍等[8]利用生石灰对酶解液进行脱氟,最优条件下脱氟率可达88.25%,但以酶解液氟含量为50 mg/kg来计算,脱氟后酶解液氟含量仍然高达5.88 mg/kg。此外,生石灰加入酶解液中会释放出大量的热,会对酶解液的营养价值和生理活性产生不良影响。郭帆等[9]使用乳酸钙和活性氧化铝混合物对酶解液进行脱氟处理,脱氟率高达93.98%,氨基酸损失率仅为3.49%,但由于铝盐对人体有毒害作用,反应液需要通过微滤膜来除去残留的脱氟材料,因而成本高。王灵昭[10]先用乳酸钙然后使用生物脱氟剂对酶解液进行脱氟处理,脱氟后酶解液氟含量仅为1.53 mg/kg,总氮损失率为14.06%,但该学者并没有明确说明所使用的生物脱氟剂具体是什么物质,因而限制了该工艺的推广应用。
目前成熟的脱氟方法主要集中在废水治理和饮用水处理方面[11,12],因此本文首先从常用的脱氟剂中筛选出适用于南极磷虾酶解液的脱氟剂,在兼顾蛋白损失的情况下,正交试验优化酶解液脱氟工艺并对脱氟前后酶解液的营养价值进行评价。本研究旨在得到脱氟效果好、操作简便、成本低、营养价值损失少的脱氟工艺,以便为低氟南极磷虾产品的商业性开发提供理论指导和参考。
1 材料与方法
1.1 材料与试剂
冰冻南极磷虾(frozen krill):-20 ℃保存备用,青岛远洋捕捞有限公司;酶制剂(胰酶):重庆市祥盛生物制药有限公司;超纯水:实验室使用Milli Q超纯水仪自制;磷酸、盐酸、氢氧化钠、氢氧化钙、氧化钙、柠檬酸钙等其他化学试剂:均为分析纯。
1.2 仪器与设备
HYP-308消化炉、KDN-103F型微量凯氏定氮仪 上海纤检仪器有限公司;善美SM-G21型绞肉机 广州新域机电制造有限公司;电子分析天平 梅特勒-托利多国际股份有限公司;pH-3E pH计 上海雷磁仪器厂;PF-202-C氟离子复合电极 上海仪电科学仪器股份有限公司;THZ-82恒温振荡器 常州国华电器有限公司;TG20-WS离心机 长沙湘智离心机仪器有限公司;Milli Q超纯水仪 默克密理博Merck Millipore公司;L-8800 型氨基酸分析仪 日本日立公司。
1.3 南极磷虾酶解液的制备
将冰冻南极磷虾进行解冻后绞成磷虾肉糜,按料液比1∶1的比例往虾肉糜中加入超纯水,搅拌均匀后调节体系初始pH为7.5,然后加入0.1%(E/S)胰酶,45 ℃酶解7 h,沸水浴灭酶10 min后冷却至室温,8000 r/min离心20 min,上清液过滤纸,得到南极磷虾酶解液。
1.4 基本理化指标的测定
总氮含量:凯氏定氮法,参照GB/T 5009.5-2010;氨氮含量:甲醛滴定法,参照GB/T 5009.39-2003;氟含量:氟离子选择性电极法,参照国标GB/T 5009.18-2003。记录脱氟前和脱氟后南极磷虾酶解液的质量,酶解液的蛋白损失率、氨氮损失率和脱氟率的计算公式如下:
蛋白损失率=(1-脱氟后酶解液蛋白总量/脱氟前酶解液蛋白总量)×100%。
公式(1)
氨氮损失率=(1-脱氟后酶解液氨氮总量/脱氟前酶解液氨氮总量)×100%。
公式(2)
脱氟率=(1-脱氟后酶解液氟含量/脱氟前酶解液氟含量)×100%。
公式(3)
1.5 脱氟剂的筛选
在参考部分文献的基础上,本实验使用的脱氟剂包括硅藻土、高岭土、活性炭、人造沸石、壳聚糖、几丁质、活性氧化铝、聚合氯化铝、氧化镁和氯化钙。分别添加溶液质量1%的上述脱氟剂到氟化钠溶液(CF-=50 mg/kg)和南极磷虾酶解液中,搅拌均匀后放入摇床,在摇床转速150 r/min、温度30 ℃条件下反应90 min,然后过滤纸得到滤液,测定氟含量。
1.6 钙盐的氟脱除效果比较
分析比较钙盐在氟化钠溶液和南极磷虾酶解液中的脱氟效果,使用的钙盐包括无机钙(氢氧化钙、氧化钙、碳酸钙、磷酸一氢钙、磷酸二氢钙、磷酸钙、氯化钙和硫酸钙)和有机钙(乳酸钙、D-泛酸钙、乙酸钙、葡萄糖酸钙和柠檬酸钙)。添加终浓度20 mmol/kg 的上述钙盐(以 Ca2+计)到反应液中,搅拌均匀后放入摇床,在摇床转速150 r/min、温度30 ℃条件下反应90 min,然后过滤纸得到滤液,测定氟含量。
1.7 氢氧化钙脱氟工艺研究
以氢氧化钙作为脱氟试剂,分别向氟化钠溶液和南极磷虾酶解液中加入1%的氢氧化钙,搅拌均匀等量分成3份,一份作为空白对照(A工艺),一份使用浓盐酸调节反应体系的pH为7.0(B工艺),一份使用磷酸溶液(浓磷酸稀释5倍)调节反应体系的pH为7.0(C工艺),30 ℃条件下反应1 h,反应液过滤纸后测定氟含量。
1.8 单因素试验
使用磷酸溶液来调节脱氟反应的pH值,南极磷虾酶解液脱氟试验的基本条件为:氢氧化钙添加量1%,反应pH 7.0,反应时间1 h,反应温度40 ℃。脱氟结束后反应液8000 r/min离心20 min,所得上清液即为脱氟酶解液。固定其他条件,改变其中1个因素来考察其对酶解液脱氟效果的影响。各因素变化范围为脱氟反应pH 3.0,4.0,5.0,5.5,6.0,6.5,7.0,7.5,8.0,9.0,10.0;氢氧化钙添加量0.1%,0.3%,0.5%,0.8%,1.0%,1.5%;反应温度4,25,30,35,40,45,50 ℃;反应时间15,30,45,60,75,90,120 min。
1.9 正交优化试验
在单因素的基础上,兼顾酶解液的蛋白损失情况,固定脱氟反应的pH为6.5,选择氢氧化钙添加量(A)、反应时间(B)、反应温度(C)进行三因素三水平正交优化试验,因素设计见表1。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal array design
1.10 脱氟前后酶解液营养价值评价
参考GB/T 5009.124-2003对最优条件下脱氟前后酶解液的氨基酸组成进行分析。待测样品通过6 mol/L的盐酸在(110±1) ℃恒温干燥箱中水解22 h后取出冷却,然后过滤,取1 mL滤液挥干后加入1 mL去离子水溶解后蒸干,反复3次,最后加入4 mL pH 2.2缓冲溶液溶解后供氨基酸自动分析仪测定其氨基酸组成。
1.11 数据处理
试验重复3次,试验结果采用Excel软件进行处理,SPSS 19.0进行正交优化设计和显著性分析(P<0.05)。
2 结果与分析
2.1 脱氟剂的筛选
目前成熟的脱氟方法主要集中在废水治理和饮用水处理方面[13],在参考相关文献的基础上考察了不同的脱氟剂对南极磷虾酶解液氟脱除效果的影响,同时与氟化钠溶液的脱氟效果进行比较,实验结果见图1。
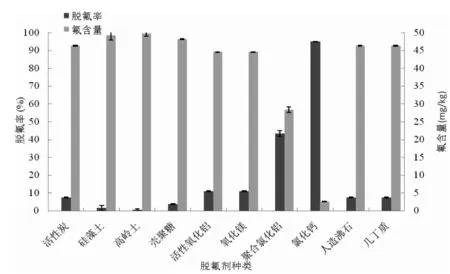
a.脱氟剂在氟化钠溶液中脱氟效果比较a.Defluorination of sodium fluoride aqueous solution using different fluoride removal agents
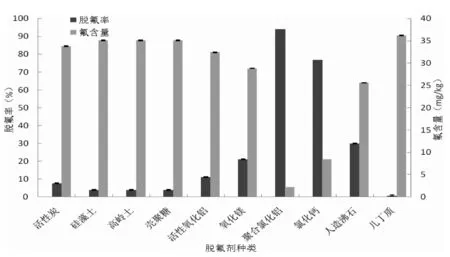
b.脱氟剂在南极磷虾酶解液中脱氟效果比较b.Defluorination of Antarctic krill protein hydrolysate using different fluoride removal agents图1 脱氟剂的筛选Fig.1 Selection of fluoride removal agents
由图1中a可知,在氟化钠溶液中,氯化钙脱氟效果最好,脱氟率高达94.92%。其次为聚合氯化铝,脱氟率为43.38%。活性炭脱氟效果不佳,脱氟率仅为7.39%,这可能是因为活性炭脱氟原理为纯粹的物理吸附,对氟离子的吸附选择性不高。陈红红等的研究表明改性后的人造沸石脱氟率可达91.56%,本实验的人造沸石除氟能力不强,可能是因为没有对其进行改性处理导致的。南极磷虾外壳氟含量高达3828~4278 mg/kg,几丁质是南极磷虾外壳的主要成分之一,因此我们也研究了几丁质及其脱乙酰基产物——壳聚糖的除氟能力。由图1中a可知它们的脱氟效果都很差,脱氟率分别为7.39%和3.65%。可见南极磷虾的富氟特性主要不是由几丁质的吸附作用造成的,这也与Wang等[14]的研究推论相一致。
由图1中b可知,在南极磷虾酶解液中,聚合氯化铝的脱氟效果最好,脱氟率高达93.96%,脱氟后酶解液含氟量仅为2.21 mg/kg,略高于NY 5073-2006氟限量标准。氯化钙的脱氟效果次之,脱氟率为76.84%,脱氟后酶解液氟含量为8.46 mg/kg。人造沸石和氧化镁有一定脱氟效果,脱氟率分别为29.94%和21.12%,而几丁质则完全没有脱氟效果。比较图1中a和b可知,脱氟剂在不同体系中的除氟效果有明显差异,这可能是因为与氟化钠溶液相比,酶解液成分更复杂,游离氨基酸、小分子肽、无机盐等物质会对脱氟剂除氟效果有影响。
尽管聚合氯化铝脱氟效果最好,但实验中发现其在酶解液中有较大残留,考虑到铝盐的毒害作用,聚合氯化铝不宜用作AKPHs的脱氟剂。氯化钙能有效降低酶解液氟含量,这主要是因为其脱氟原理为Ca2++2F-=CaF2↓。可见钙盐具有较好的脱氟效果,在后续的实验中本文将深入研究不同钙盐(包括有机钙和无机钙)的脱氟能力。
2.2 钙盐的筛选
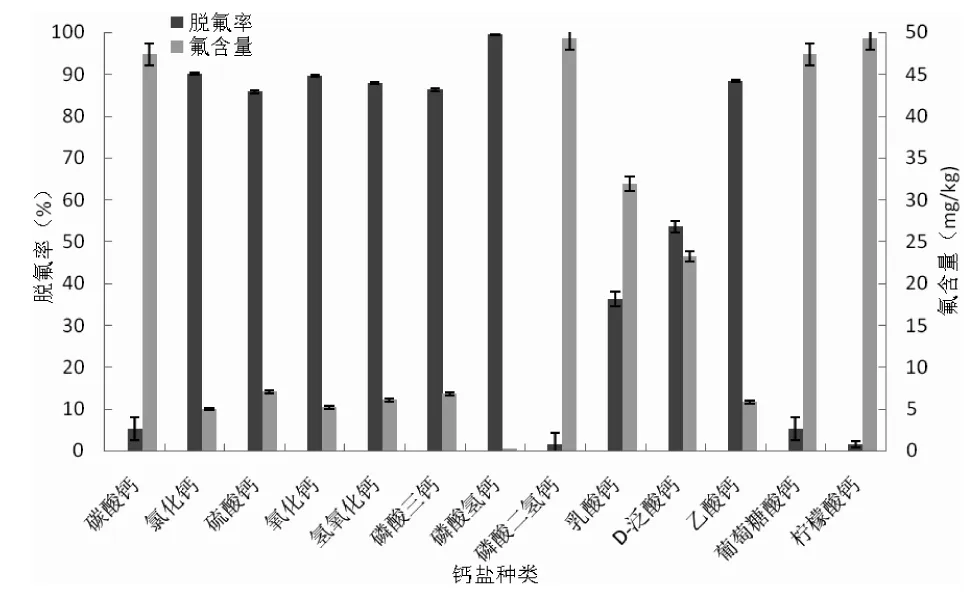
a.钙盐在氟化钠溶液中脱氟效果比较a.Defluorination of sodium fluoride aqueous solution using calcium materials
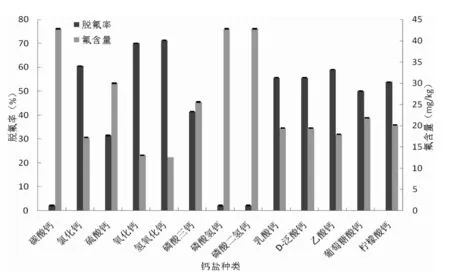
b.钙盐在南极磷虾酶解液中脱氟效果比较b.Defluorination of Antarctic krill protein hydrolysate using different calcium materials图2 钙盐脱氟能力的比较Fig.2 Comparison of the fluoride removal ability of calcium materials
钙盐具有良好的除氟效果,其除氟能力与钙盐的类型有关。由图2中a可知,在氟化钠溶液中,无机钙的脱氟能力普遍优于有机钙。除了碳酸钙和磷酸二氢钙脱氟效果非常差,其他的无机钙盐的脱氟率均超过85%,其中磷酸氢钙的脱氟效果最好,脱氟率高达99.42%,脱氟后水中氟含量仅为0.29 mg/kg。有机钙盐中,乙酸钙的脱氟率高达88.35%;D-泛酸钙和乳酸钙脱氟效果较好,脱氟率分别为53.54% 和36.25%;葡萄糖酸钙脱氟效果非常差,而柠檬酸钙则基本没有脱氟能力。
由图2中b可知,在南极磷虾酶解液中,无机钙盐间的脱氟能力有差异明显,而有机钙盐间的脱氟能力相差不大。无机钙盐中,氢氧化钙的脱氟效果最好,脱氟率为71.28%;其次为氧化钙,脱氟率为70.12%;氯化钙有一定脱氟效果,其脱氟率为60.60%。李红艳和吕丽萍对酶解液进行脱氟处理选择的钙盐分别为氯化钙和生石灰,通过响应面优化后的脱氟率可达89.43%和88.25%。磷酸钙盐中,磷酸三钙对酶解液的脱氟率为41.49%,而磷酸氢钙和磷酸二氢钙则基本没有脱氟效果,脱氟率仅为2.17%。有机钙普遍具有较好的脱氟能力,它们的脱氟率都大于50%,其中乙酸钙的脱氟效果最好,脱氟率为59.01%,脱氟酶解液氟含量仅为17.93 mg/kg;而葡萄酸钙的脱氟能力最弱,脱氟率为50.05%,脱氟酶解液氟残留量为21.85 mg/kg。
比较图2中a和b可知,钙盐在不同体系中的除氟效果有明显差异。与在氟化钠溶液中的脱氟效果相比,无机盐对酶解液的脱氟能力明显变弱,而有机钙的脱氟能力普遍有所增强(除了乙酸钙)。综上,选择脱氟效果最好的氢氧化钙作为南极磷虾酶解液的脱氟剂。
2.3 氢氧化钙脱氟工艺研究
选择氢氧化钙作为酶解液的脱氟试剂,考虑到南极磷虾的钙、磷分布与氟具有明显相关性[15],而氟磷酸钙Ca5(PO4)3F是自然界中溶解度最小的化合物之一,溶度积远比氟化钙小(仅为1.44×10-119)[16],所以本文探讨使用氢氧化钙和磷酸来降低酶解液氟含量的可行性,实验结果见表2。
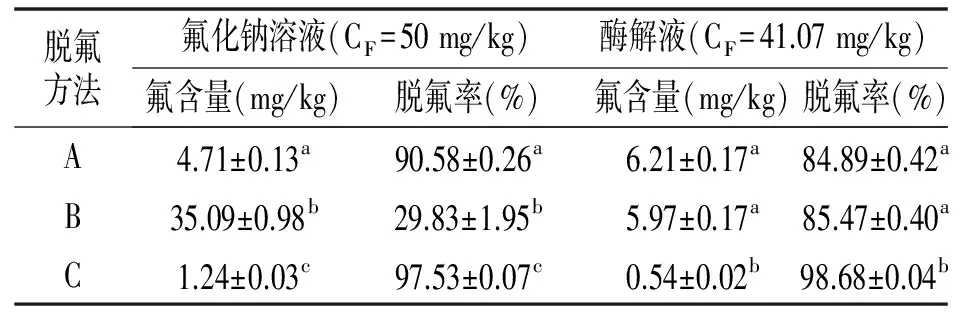
表2 氢氧化钙脱氟方法比较Table 2 Comparison of defluorination efficiency using calcium hydroxide
注:工艺A不调节脱氟反应pH;工艺B使用浓盐酸调节脱氟反应pH为7.0;工艺C使用磷酸溶液(1+5)调节脱氟反应pH为7.0;同一列数据标记不同字母表示结果间存在显著性差异(P<0.05)。
由表2可知,在氟化钠溶液中,与A工艺相比, B工艺的脱氟率仅为29.83%;而C工艺脱氟率则提高到97.53%。在南极磷虾酶解液中,B工艺的脱氟率为85.47%;而C工艺的脱氟率则高达98.68%,其脱氟酶解液氟含量仅为0.54 mg/kg,远远低于GB 2762-2005和NY 5073-2006氟限量标准。C工艺的脱氟效果与A,B工艺相比有明显差异,这可能是因为它们的脱氟原理不同导致的。A,B工艺的脱氟原理为Ca2++2F-=CaF2↓。CaF2溶度积为3.95×10-11,18 ℃时溶解度为16.3 mg/L,以氟计算其在水中溶解度也大约有8 mg/kg,因而很难通过形成CaF2沉淀将氟含量降低到2 mg/kg以下[17]。而使用磷酸调节pH时,磷酸能够与氢氧化钙发生反应,生成磷酸钙、羟基磷酸钙(HAP)等有明显脱氟作用的化合物[18,19],这些物质以及氢氧化钙能够有效吸附氟离子,或者通过与酶解液中的氟发生反应形成氟磷酸钙、氟化钙等难溶化合物,从而有效地降低氟含量。毕华银等在对水进行降氟实验时发现,在pH 6.2~7.5时,向高氟水中按比例加入Ca2+和PO43+可以将水中的氟含量降低到0.8 mg/L以下。Gogoi等[20]首先向含氟水溶液中加入稀磷酸,然后使用石灰石对其进行吸附,水中的氟含量可由0.526 mmol/L(10 mg/L)降低到0.50~52.6 μmol/L(0.0095~1 mg/L)。本实验的研究结果表明C工艺具有降低南极磷虾酶解液氟含量的可行性,因此选择C工艺对南极磷虾酶解液进行脱氟研究。
2.4 单因素试验
选择氢氧化钙作为脱氟剂,磷酸溶液调节脱氟反应的pH,反应pH、氢氧化钙添加量、反应温度和反应时间对南极磷虾酶解液脱氟效果的影响见图3。
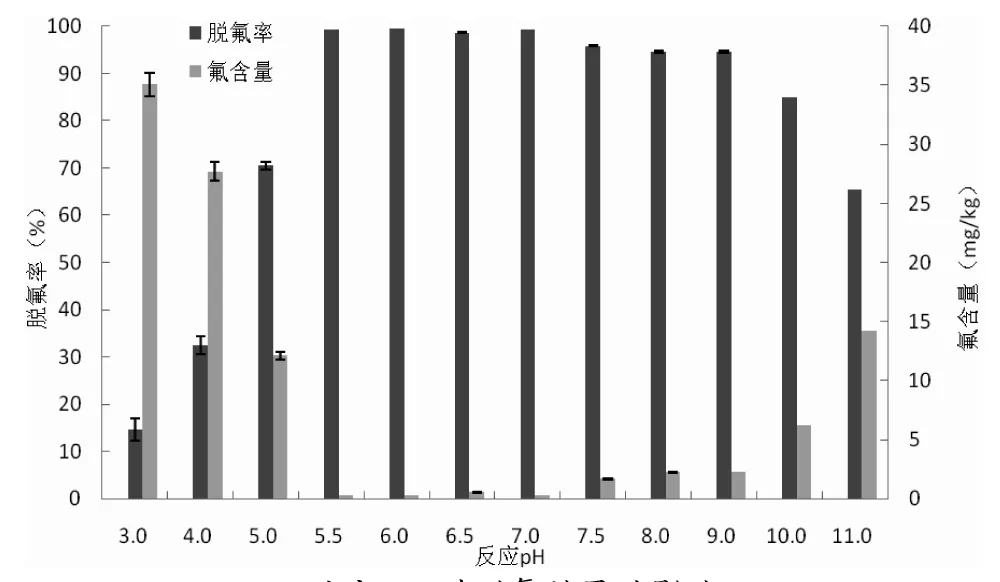
a.反应pH对脱氟效果的影响a.Effect of reaction pH on the defluorination

b.氢氧化钙添加量对脱氟效果的影响b.Effect of calcium hydroxide amount on the defluorination

c.反应温度对脱氟效果的影响c.Effect of reaction temperature on the defluorination

d.反应时间对脱氟效果的影响d.Effect of reaction time on the defluorination图3 单因素对南极磷虾酶解液脱氟效果的影响Fig.3 Effect of single factor on the defluorination of Antarctic krill protein hydrolysate
注:固定因素水平为氢氧化钙添加量1%,反应pH 7.0,反应时间1 h,反应温度40 ℃。
由图3中a可知,随着反应pH的升高,脱氟南极磷虾酶解液的氟含量呈现先下降后恒定然后升高的趋势。反应pH在3.0~5.0时脱氟效率并不高,这可能是因为在酸性条件下,酶解液中的氟离子容易与氢离子反应形成HF,导致溶液中氟离子浓度下降。在反应pH为5.5~7.0时脱氟效率明显提高,脱氟率超过99%,脱氟后酶解液氟含量远远小于2 mg/kg。毕华银等的研究表明在pH 6.2~7.5时,向高氟水中按比例加入Ca2+和PO43+可以将水中的F-降低到0.8 mg/L以下。当反应pH在碱性条件下时,脱氟效果明显下降;在pH 11.0时脱氟率仅为65.45%,这可能是因为在碱性条件下,溶液中的Ca2+与OH-反应形成微溶于水的Ca(OH)2导致Ca2+浓度有所下降。由图3中b可知,氢氧化钙添加量在0.1%~0.5%时,随着添加量的增加,脱氟效率呈急剧上升趋势;当添加量为0.5%时,随着添加量的进一步增加脱氟率趋于稳定,因此选择0.1%~0.5%作为添加量的最优范围。由图3中c可知,在4 ℃条件下,脱氟率仅为95.36%,脱氟酶解液氟含量为1.9 mg/kg。当反应温度提高到25 ℃时,脱氟效率明显提高到99.18%,酶解液氟含量降低到0.34 mg/kg。随着温度的进一步提高,脱氟率增加趋势不明显。由此可见,氢氧化钙-磷酸脱氟法是一个吸热反应,适当提高反应温度可以提高脱氟效率。但考虑到过高的反应温度可能会对酶解液的营养价值和生理活性造成损失,选择40 ℃作为最适反应温度。由图3中d可知,反应30 min后就已经有较好的脱氟效果,此时的脱氟率为99.21%。随着反应时间的进行,脱氟率呈现上升趋势,当反应时间增加到120 min时,脱氟效率反而略有下降。为避免脱氟时间过长导致微生物的生长繁殖消耗酶解液的营养物质,同时考虑脱氟效果,选择60 min作为最佳反应时间。
2.5 正交优化试验
在单因素的基础上,选择对脱氟效果影响较大的氢氧化钙添加量、反应时间和反应温度作为试验因素,兼顾蛋白损失情况对南极磷虾酶解液脱氟工艺进行正交优化,试验结果见表3。

表3 正交试验结果与极差分析Table 3 Results of orthogonal experiment and range analysis

续 表
由表3的极差分析结果可知,不管对于脱氟率还是蛋白损失率,极差的大小排序均为A>B>C,说明氢氧化钙添加量对脱氟率和蛋白损失率的影响最大,其次为反应时间,而反应温度的影响最小。由k值结果可知,脱氟率最高的较优组合为A3B3C3,蛋白损失率最低的较优组合为A1B1C2。
对试验结果进行方差分析,见表4。
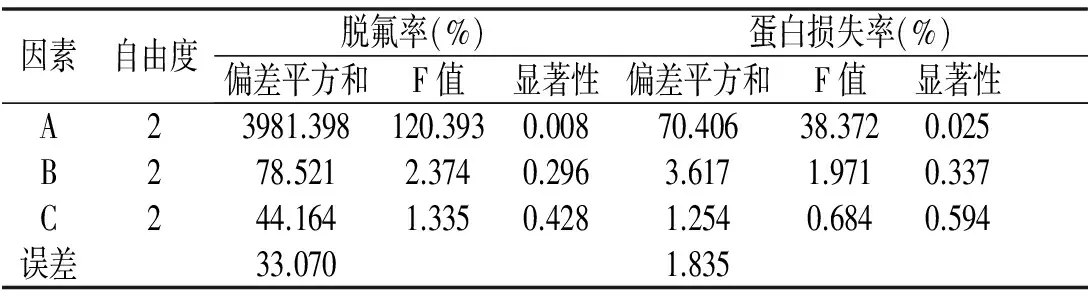
表4 正交试验方差分析Table 4 Variance analysis of orthogonal experiment
注:F0.01(2,2)=99.00, F0.05(2,2)=19.00。
由表4可知,对于脱氟率而言,F(A)>F0.01(2,2)=99>F(B)>F(C),说明氢氧化钙添加量对脱氟率有极显著性影响(P<0.01),而反应时间和反应温度对脱氟率影响不显著(P>0.05)。对于蛋白损失率而言,F(A )>F0.05(2,2)=19>F(B)>F(C),说明氢氧化钙添加量对蛋白损失率有显著性影响(P<0.05),而反应时间和反应温度对蛋白损失率影响不显著(P>0.05)。因此,为了能够将酶解液的氟浓度降低到2 mg/kg以下,氢氧化钙添加量应该要尽量大,氢氧化钙添加量选择3水平。为了减少酶解液蛋白损失情况,同时兼顾效率和脱氟成本,反应温度选择2水平,反应时间选择2水平。综上,南极磷虾酶解液的最佳脱氟工艺为A3B2C2,即氢氧化钙添加量0.5%,反应时间60 min,反应温度40 ℃,但是该条件在上述正交表中没有出现,需要进行验证试验。
2.6 验证试验
采用上述的最优工艺条件,验证试验的结果见表5。

表5 南极磷虾酶解液脱氟工艺验证试验Table 5 Validation of orthogonal experiment for defluorination of Antarctic krill protein hydrolysates
由表5可知,最优条件下脱氟率高达99.27%,脱氟效果优于目前已知的文献报道,脱氟后南极磷虾酶解液的氟含量从41.07 mg/kg 降低到0.30 mg/kg,符合NY 5073-2006的氟限量标准;蛋白损失率和氨氮损失率分别为8.57%和8.26%,说明脱氟处理对酶解液的营养价值损失较少。
2.7 脱氟前后酶解液营养价值评价
为了进一步了解本文的脱氟工艺对南极磷虾酶解液营养价值的影响,对脱氟前后酶解液的氨基酸组成进行分析,试验结果见表6。
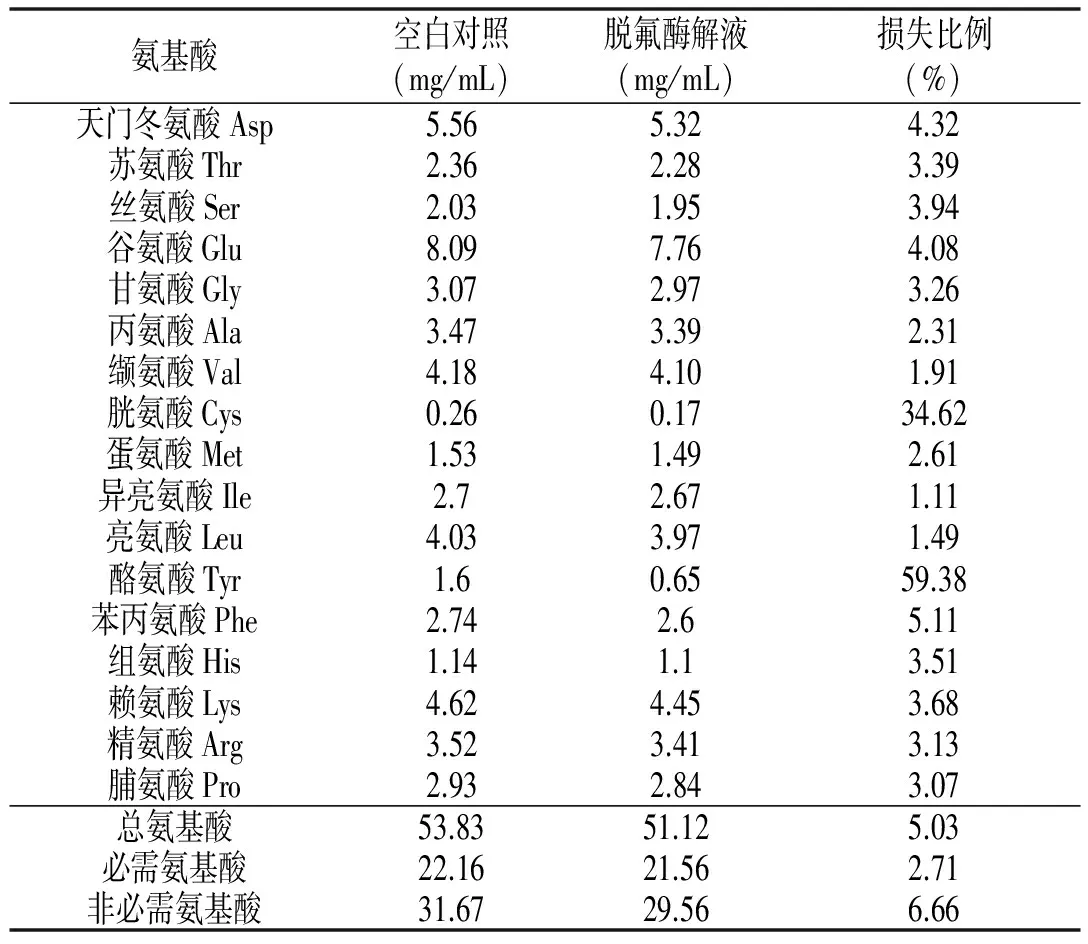
表6 脱氟前后南极磷虾酶解液的氨基酸组成分析Table 6 Effect of defluorination on the amino acid composition of Antarctic krill hydrolysates
由表6可知,南极磷虾酶解液氨基酸种类齐全,含有人体所需的所有氨基酸和必需氨基酸(色氨酸被强酸破坏未检出)。脱氟后,酶解液的酪氨酸和胱氨酸损失明显,它们的损失比例分别为59.38%和34.62%。除了酪氨酸、胱氨酸和苯丙氨酸,酶解液中的其他氨基酸损失比例均在5%以下。根据 FAO/WHO理想蛋白质推荐模式,优质蛋白质的必需氨基酸与总氨基酸的比值(EAA/TAA)应该在 40%左右,必需氨基酸与非必需氨基酸的比值(EAA/NEAA)在 60%以上。脱氟后,酶解液的EAA/TAA和EAA/NEAA分别从41.17%和69.97%提高到了42.18%和72.94%。由表6可知,脱氟后酶解液的总氨基酸仅损失5.03%,必需氨基酸仅损失2.71%,可见脱氟处理后酶解液中的营养价值损失少。
2.8 讨论
南极磷虾酶解液营养价值高,具有抗氧化、抑制有害菌、预防骨质疏松、降血压等生理活性,但由于其氟含量比较高,相关的脱氟工作一直是研究的热点。目前关于南极磷虾酶解液的脱氟研究已有很多报道,例如李红艳等利用电渗析法和纳滤法对南极磷虾酶解液进行脱氟处理,尽管取得良好的脱氟效果,但是酶解液氨氮损失率均超过10%,蛋白损失率均超过15%,此外这些设备较为昂贵,成本高。郭帆等使用乳酸钙和活性氧化铝混合物对酶解液进行脱氟处理,脱氟率高达93.98%,氨基酸损失率仅为3.49%,但是铝盐对人体有害,因而该工艺安全性不高。吕传萍等利用生石灰对酶解液进行脱氟,但是生石灰溶解度低,而且生石灰溶于水会放出大量的热,会对酶解液的营养价值和生理活性产生不良影响,远不如使用氢氧化钙作为脱氟剂。与目前文献已报道的南极磷虾酶解液脱氟方法相比,本脱氟工艺具有脱氟效果好、操作简便、反应条件温和、成本低、酶解液营养价值损失少等优点,可为低氟南极磷虾产品的工业化生产提供技术指导。
3 结论
反应体系会对脱氟剂的脱氟效果有明显影响。与氟化钠溶液相比,南极磷虾酶解液成分复杂,多肽、游离氨基酸、无机盐离子等组分会影响其脱氟效果。
聚合氯化铝对南极磷虾酶解液的脱氟效果最好,脱氟率高达93.96%,而几丁质则完全没有脱氟效果。钙盐的类型对酶解液的氟脱除效果有很大影响,无机钙盐对酶解液的脱氟效果差异很大,其中氢氧化钙脱氟效果最好,脱氟率为71.28%,而磷酸一氢钙的脱氟效果最差,脱氟率仅为2.17%;有机钙盐对酶解液普遍具有较好的脱氟效果,它们的脱氟率均超过50%。
氢氧化钙作为脱氟剂时,使用磷酸来调节脱氟反应的pH能够将酶解液氟含量降低到2 mg/kg以下。正交试验优化得到的最佳脱氟工艺为氢氧化钙添加量0.5%,反应pH 6.5,反应时间60 min,反应温度40 ℃,此时的脱氟率高达99.27%,脱氟后酶解液氟含量仅为0.30 mg/kg,蛋白损失率和氨氮损失率分别为8.57%和8.26%。尽管脱氟后酪氨酸和胱氨酸损失严重,但是酶解液的总氨基酸和必需氨基酸分别仅下降5.07%和2.71%。本脱氟工艺具有操作时间短、反应条件温和、成本低、酶解液营养价值损失少等优点,可为低氟南极磷虾产品的工业化生产提供技术指导。
[1]Wang L,Xue C,Wang Y,et al.Extraction of proteins with low fluoride level from Antarctic krill (Euphausiasuperba) and their composition analysis[J].Journal of Agricultural and Food Chemistry,2011,59(11):6108-6112.
[2]Kim K M,Lee D S,Nam M H,et al.Optimization of alcalase for krill byproduct hydrolysis and antioxidative activities by response surface methodology[J].Preventive Nutrition and Food Science,2010,15(4):316-321.
[3]Zhao L,Yin B,Liu Q,et al.Purification of antimicrobial peptide from Antarctic krill (Euphausiasuperba) and its function mechanism[J].Journal of Ocean University of China,2013,12(3):484-490.
[4]Wang Y,Wang S,Wang J,et al.Preparation and anti-osteoporotic activities in vivo of phosphorylated peptides from Antarctic krill (Euphausiasuperba)[J].Peptides,2015,68:239-245.
[5]Hatanaka A,Miyahara H,Suzuki K I,et al.Isolation and identification of antihypertensive peptides from Antarctic krill tail meat hydrolysate[J].Journal of Food Science,2009,74(4):116-120.
[6]陆英,刘仲华.茶叶中氟的研究进展[J].吉首大学学报:自然科学版,2004,25(4):84-88.
[7]李红艳.南极磷虾酶解液脱氟技术的研究[D].青岛:中国海洋大学,2011.
[8]吕传萍,李学英,杨宪时,等.生石灰降低南极磷虾酶解液中氟含量的研究[J].食品工业科技,2012,33(12):106-110.
[9]郭帆,施文正,汪之和.南极磷虾酶解液脱氟工艺的研究[J].食品工业科技,2016(9):41.
[10]王灵昭.南极磷虾(Euphausiasuperba)蛋白质深加工新技术研究[D].青岛:中国海洋大学,2013.
[11]Nath S K,Dutta R K.Significance of calcium containing materials for defluoridation of water: a review[J].Desalination & Water Treatment,2015,53(8):2070-2085.
[12]Sollo F W J,Larson T E,Mueller H F.Fluoride removal from potable water supplies[J].Illinois State Water Survey,1978,36(9):136.
[13]陈红红,黄丽玫,毋福海.人造沸石的载铁改性及除去水中氟的性能[J].环境科学与技术,2011,34(3):80-84.
[14]Wang Z,Yin X.Comparison of the defluoridation efficiency of calcium phosphate and chitin in the exoskeleton of Antarctic krill[J].Advances in Polar Science,2012,23(3):149-154.
[15]Zhang Haisheng,Cheng Xianhao, Pan Jianming,et al.Biogeochemistry research of fluoride in Antarctic Ocean.The study of fluoride anomaly in krill[J].Antarctic Res,1993(4):55-61.
[16]毕华银,熊咏民,奕唯真,等.磷酸钙改水降氟的实验研究[J].西安医科大学学报,1993,14(1):90-92.
[17]Yang M,Zhang Y,Shao B,et al.Precipitative removal of fluoride from electronics wastewater[J].Journal of Environmental Engineering,2001,127(10):902-907.
[18]Adler H,Klein G,Lindsay F K.Removal of fluorides from potable water by tricalcium phosphate[J].Ind Eng Chem,2002,30:163-165.
[19]Ando J,Toya E,Matsuno S.Effects of fluorine upon coagulation precipitation of phosphate by lime addition[J].Inorganic Materials,1984,189:76-82.
[20]Gogoi S,Nath S K,Bordoloi S,et al.Fluoride removal from groundwater by limestone treatment in presence of phosphoric acid[J].Journal of Environmental Management,2015,152:132-139.
