基于土壤微生物生物量碳和酶活性指标的土壤肥力质量评价初探
2018-01-23禹朴家范高华韩可欣周道玮
禹朴家,范高华,韩可欣,周道玮
(1. 中国科学院东北地理与农业生态研究所,吉林 长春 130102;2. 新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830011)
土壤质量是指土壤在生态系统中维持生物生产的能力,保持和改善环境质量的能力以及促进人类和动植物健康发展的能力[1]。评价并掌握土壤质量的变化对于维持甚至提高土壤的生产力,促进农牧业的可持续发展都具有非常重要的意义,因此土壤质量评价被认为是现代土壤学研究的主要问题之一[2-3]。
在众多土壤质量评价的研究中,虽然研究者将多个土壤指标结合在一起来反映土壤质量的变化,但这些指标大多集中在土壤的物理和化学指标方面,对土壤微生物学指标则涉及的较少[3-6]。而作为对短期土地利用变化最为敏感的土壤指标[6-8],在进行土壤质量评价时土壤微生物学指标理应受到人们的重视。在众多的土壤微生物学指标中,参与到土壤碳、氮、磷等养分循环中的土壤微生物及过氧化氢酶、蔗糖酶、脲酶和磷酸酶等与土壤质量的很多理化指标高度相关,因此被广泛认为是监测土壤质量变化的重要指标[5,8]。土壤质量指数是评价土地利用方式或管理措施对土壤质量影响的一种有用的工具,它能将不同土壤管理措施下的多个土壤指标信息集合在一起来反映土壤质量的变化,因此被广泛应用于土壤质量评价研究中[6,9-12]。如Liu等[3]利用土壤质量指数对中国东部具有不同生产力的白浆土(Albic soil)的土壤质量进行了研究;Guo等[6]利用土壤质量指数法对黄河下游禹城和垦利两个区域农田土壤的土壤质量进行了研究;邓绍欢等[12]利用土壤质量指数法对我国南方地区冷浸田的土壤质量进行了评价。
作为我国北方农牧交错带的重要组成部分,松嫩草地在过去的几十年中由于不合理的土地利用方式,导致农田土壤发生退化,大量土地被弃耕,区域生态环境不断恶化[13-14]。此外,近年来我国粮食产量不断增加,到2014年松嫩草地所处的东北地区粮食产量比2003年增长了近1倍,其中高产的玉米产量占全国的比重提高了6.54%[15]。玉米产量的提高导致库存压力变大,价格骤减,农民收入降低。因此,调整农业种植结构对于区域内农牧业的可持续发展和种植效益的提高具有重要的意义。基于此,本研究以松嫩平原草地为研究对象,分析玉米地、苜蓿地、羊草地、羊草割草地和自然恢复草地5种短期(4年)土地利用方式变化对土壤微生物生物量碳含量和土壤过氧化氢酶、蔗糖酶、脲酶和碱性磷酸酶活性的影响,同时利用Andrews等[9]提出的土壤质量评价模型,通过线性和非线性赋分函数两种方法计算土壤质量指数,对不同土地利用方式下的土壤肥力质量进行定量评价,探讨短期土地利用方式变化对土壤肥力质量的影响,以期为研究区内土壤的改良、利用以及农业种植结构的调整提供科学参考。
1 材料与方法
1.1 研究区概况
研究地点位于吉林省松原市长岭县境内的中国科学院长岭草地农牧生态研究站(44°33′N,123°31′E),该区地处松嫩平原南部的农牧交错区,区内地势平坦,以低平原为主,有带状沙丘分布,平均海拔约为145 m。气候条件属于温带半湿润、半干旱大陆性季风气候,雨热同期,年平均降水量约为427 mm,集中在6—9月,占年降水量的70%左右,年蒸发量约为1 600 mm;年均温约为5.9 ℃,无霜期 140 d,> 10 ℃的有效积温 2 900~3 000 ℃。
研究地点的土壤类型属于草甸碱土。此外,研究区内还分布着草甸土和风沙土等土壤类型,pH值约为7.5~10.5。主要植被类型为羊草(Leymus chinensis)草甸,主要优势植物包括羊草(Leymus chinensis)、虎尾草(Chloris virgata)、盐地碱蓬(Suacda salsa)和星星草(Puccinellia tenuiflora)等[16]。半个世纪以来,由于人口增长对粮食需求的增加,在草地的边缘部分草甸被开垦成农田,用于种植玉米、葵花、高粱等经济作物。
1.2 试验设计
选择初始演替的弃耕地约2 hm2, 去除地表所有植被和枯落物后,划定小区;试验样地布置于2010年,试验处理从2011年5月初开始。由于多年的土壤耕作,使得土壤比较均质,试验开始前样地0~10 cm土层的有机碳含量为7.82 g/kg, 土壤容重为1.47 g/cm3。试验采用区组实验设计,分为4个重复区组,在每个区组内设置了自然恢复草地、羊草地、羊草割草地、苜蓿地和玉米地5种土地利用方式的处理,总计20个小区。每个试验区组的面积约为60 m×50 m,其中草地小区面积为6 m×50 m, 苜蓿小区及作物种植小区面积为12 m×50 m,各小区间间隔1 m,重复区组间间隔2 m。耕地的耕作方式为传统耕作,作物为一年一熟制,每年于4月底或5月初进行翻耕,施肥量为N肥 74 kg/hm2、P肥 22kg/hm2、K 肥 41 kg/hm2。
苜蓿草地建立于2014年,之前这些试验小区为免耕种植玉米,样地管理情况(包括作物种植情况和化肥使用情况等)与前面的传统耕作种植玉米样地完全相同。2011年5月按照试验设计在羊草草地小区内进行了补播处理,补播羊草种子的密度约为2 000粒/m2。补播处理促进了羊草草地的恢复,到2011年9月,样地内的地上生物量就达到了100~120 g/m2左右。在每个区组的两个羊草草地小区内,一个小区进行割草处理,将地上生物量移除到小区外,而另一个小区不做任何处理,让地上生物量以枯落物的形式回归到土壤中。自然恢复草地自2011年5月开始不进行任何处理,让其自然恢复。苜蓿地、羊草地、羊草割草地和自然恢复草地不施用肥料[14]。
1.3 土壤采样与分析
2015年生长季末(8月下旬至9月初),在每个小区内随机选择5个0.5 m×0.5 m的样方,在每个样方内,首先去除地上生物量和枯落物,然后用4 cm直径的土钻采集0~10 cm土层深度的土壤样品,将同一小区5个样方采集到的土壤样品混合为一个样品。土壤样品取完后分为两部分,一部分立即存放到4 ℃的冰箱内,用于测定土壤微生物生物量碳含量,另一部分土壤样品在自然状态下阴干,去除砾石和残留的植物残体后,过2 mm的土壤筛用于测定土壤酶活性。
土壤微生物生物量碳含量采用氯仿熏蒸法测定,称取11.00 g新鲜土样(相当于干土10.00 g)均匀的平铺在玻璃培养皿上并放入干燥器中,干燥器底部放置一瓶装有50 ml无水氯仿的小烧杯并加入少量防爆沸的物质,密闭熏蒸24 h后,除去氯仿并将土样装入塑料瓶中,按照1:5的比例加入0.50 M 的硫酸钾溶液50 ml,在往返式振荡器上震荡30 min后过滤。与此同时,另外一组土样直接加入0.50 M 的硫酸钾溶液50 ml,震荡过滤。滤液用TOC仪进行测定,熏蒸与未熏蒸土样中有机碳含量差值乘以转换系数即为土壤微生物生物量碳含量。
土壤过氧化氢酶活性采用高锰酸钾滴定法测定;土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定;土壤脲酶活性采用苯酚钠-次氯酸钠比色法测定;土壤碱性磷酸酶活性采用磷酸苯二钠比色法测定[17-18]。
1.4 敏感性指数计算
土壤微生物学指标的敏感性指数以给定的一种土地利用方式为基准,通过计算其它土地利用方式与给定土地利用方式间该指标的差异来反映土地利用变化对该土壤指标的影响程度。本研究以玉米地为参考基准(玉米地敏感性指数为1)来计算其它4种草地利用方式中土壤微生物学指标的敏感性指数,其计算公式为:

式中:SIi是土壤i指标的敏感性指数;Si是测定土地利用方式下土壤i指标的含量;SRi是参考土地利用方式下土壤i指标的含量。当土壤指标的敏感性指数大于1.50(增加50%)或是低于0.50(降低50%)的时候,认为该土壤指标对土地利用变化响应敏感[19]。
1.5 土壤质量指数计算
依据Andrews等[9]提出的土壤质量评价模型(SMAF),本文将测定的5种土壤微生物学指标作为土壤质量指数计算的数据集,通过2个步骤计算土壤质量指数,以土壤生产力和可持续利用作为土壤管理的最终目标。
第一步,利用线性和非线性的赋分函数法对数据中的土壤指标进行赋分。根据土地管理的目标以及土壤指标在土壤生态系统中的功能,将数据集中的土壤指标分为两类。一类是在土壤中含量越多越好的土壤指标,一类是在土壤中含量越少越好的指标。这两类土壤指标的赋分的最大值均为1。其中,线性赋分函数的公式为:

式中:SL是线性赋分函数得出的分值,其范围为0~1;X是数据集中的土壤指标含量值,Xmax和Xmin分别是每个土壤指标含量的最大值和最小值;其中公式(2)应用于土壤中含量越多越好的土壤指标,而公式(3)应用于土壤中含量越少越好的土壤指标[19]。
非线性赋分函数的公式为:

式中:SNL是非线性赋分函数得出的分值,其范围为0~1;a是土壤指标所能得到的最大值,本研究中将a定义为1;X是数据集中的土壤指标含量值,Xm是这个土壤指标含量的平均值;b是这个公式中的斜率,本研究中将含量越多越好的土壤指标的b值设定为-2.5,而含量越少越好的土壤指标的b值设定为+2.5[19-20]。
第二步,在数据集中的土壤指标赋分完毕后,计算土壤质量指数[20],公式为:

式中:SQIA是计算得出的土壤质量指数;Si为土壤i指标的得分值;n为数据集中土壤指标的个数。
1.6 数据统计与分析
本研究中所有的数据分析均在SPSS 16.0(SPSS 16.0 for Windows, Inc., Chicago, IL, USA)软件中完成。单因素方差分析被用来分析土地利用方式对土壤微生物学指标和土壤质量指数的影响;不同土地利用方式下土壤指标和土壤质量指数的均值比较通过LSD法进行分析。Pearson相关系数被用来分析2个土壤质量指数之间的相关性。所有数据统计分析的显著性水平设定为P = 0.05。
2 结果与分析
2.1 土壤微生物生物量碳含量与土壤酶活性
5种土壤微生物学指标均对土地利用方式响应敏感,但在不同的土地利用方式下,不同指标的响应程度有所不同。土地利用方式对土壤微生物生物量碳含量、脲酶活性和蔗糖酶活性均具有极显著(P < 0.01)的影响(表1)。其中,土壤蔗糖酶活性在4种草地利用方式间没有显著差异,但其值均显著高于玉米地;土壤微生物生物量碳含量和脲酶活性均在苜蓿地中达到最高,分别为533.3 mg C/kg和1.17 mg NH3-N/g soil/24h,其值显著高于自然恢复草地和玉米地,而与羊草地没有显著差异。羊草割草地中土壤微生物生物量碳含量为427.6 mg C/kg,其显著高于玉米地,而土壤脲酶活性为0.78 mg NH3-N/g soil/24h,其与玉米地没有显著差异。虽然土地利用方式对土壤过氧化氢酶活性和碱性磷酸酶活性没有显著影响,但草地利用方式与玉米地间仍存在一定程度的差异。
土壤过氧化氢酶活性在自然恢复草地和羊草割草地中的值分别为0.95和0.93 ml KMnO4/g soil,其显著高于玉米地,与羊草地和苜蓿地没有显著差异,而土壤碱性磷酸酶活性在苜蓿地、羊草地和自然恢复草地中的值分别为1.21、1.09和1.08 mg phenol/g soil/12h,其显著高于玉米地,而与羊草割草地没有显著差异。
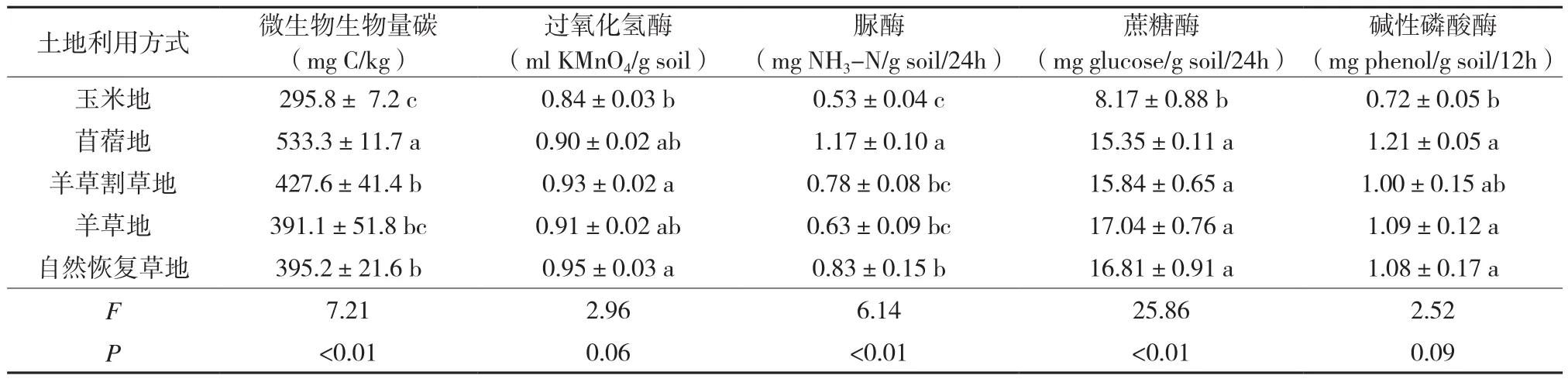
表1 不同土地利用方式下土壤微生物学指标的变化及ANOVA分析结果Table 1 Changes of soil microbial indicators and ANOVA results for the changes under five land use types
2.2 土壤微生物学指标的敏感性指数
耕地转变为草地后,5种土壤微生物学指标的敏感性指数均大于1.0(图1),表明它们均呈现出一定程度的增加趋势。其中,土壤蔗糖酶活性的增加幅度最大,其敏感性指数值均大于1.94,对土地利用变化的响应最为敏感;而土壤过氧化氢酶活性的增加幅度最小,其敏感性指数均小于1.13,对土地利用变化的响应也最小。不同土地利用方式下,苜蓿地中土壤微生物学指标响应最为敏感,其中有微生物生物量碳含量、脲酶活性、蔗糖酶活性和碱性磷酸酶活性4个指标的敏感性指数值大于1.50;羊草割草地中土壤微生物指标响应最小,其中仅有蔗糖酶活性1个指标的敏感性指数值大于1.50;而自然恢复草地和羊草地中土壤指标的响应程度居中,分别有脲酶活性、蔗糖酶活性和碱性磷酸酶活性3个和蔗糖酶活性和碱性磷酸酶活性2个土壤指标的敏感性指数值大于1.50。
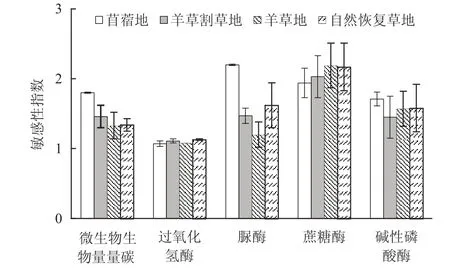
图1 不同土地利用方式下土壤微生物生物量碳和土壤酶活性的敏感性指数Fig. 1 Sensitivity indices of soil microbial biomass carbon and soil enzyme activities under five land use types
2.3 土壤质量指数
单因素方差分析结果表明,线性土壤质量指数(F=8.55,P<0.01)和非线性土壤质量指数(F=9.59,P<0.01)在不同土地利用方式间均存在极显著差异。虽然线性土壤质量指数在数值上显著高于非线性土壤质量指数,但2种土壤质量指数指示的不同土地利用方式间土壤质量的变化趋势完全一致(图2)。5种土地利用方式中,玉米地的土壤质量指数均显著低于草地利用方式,其线性和非线性土壤质量指数分别为0.55和0.30;而在4种草地利用方式中,苜蓿地的线性土壤质量指数和非线性土壤质量指数均最高,分别为0.89和0.60,其显著高于羊草地,而与自然恢复草地和羊草割草地没有显著差异。
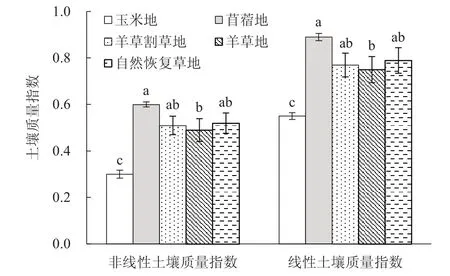
图2 不同土地利用方式下的土壤质量指数Fig. 2 Soil quality indices under five land use types
以线性土壤质量指数值为横坐标,以非线性土壤质量指数值为纵坐标对2种土壤质量指数间的线性相关性进行了分析,结果表明线性与非线性土壤质量指数的Pearson相关系数为0.93,显著性水平P<0.001(图3),表明两者间存在极显著的线性正相关关系。
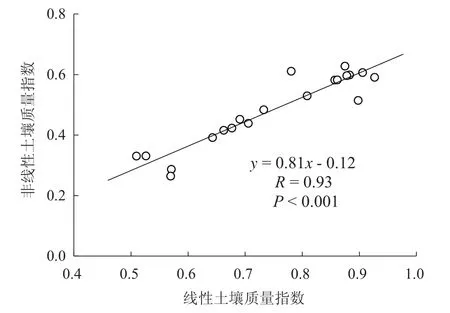
图3 线性与非线性土壤质量指数的相关性Fig. 3 Pearson’s correlation between linear and nonlinear soil quality indices
3 讨论
3.1 土地利用方式对土壤微生物学指标的影响
土壤微生物生物量碳含量和土壤酶活性对外界环境因素和土壤质量的变化响应快速且准确,常被用来作为土壤生态系统变化的早期指示指标[21]。与玉米地相比,苜蓿地、羊草割草地、羊草地和自然恢复草地中土壤微生物生物量碳含量分别提高了79.5%、44.1%、31.9%和33.3%,表明草地恢复显著提高了研究区内土壤微生物生物量碳的含量(表1)。这主要是由于草地恢复以后向土壤中输入的枯落物和根系的量增加,从而为土壤微生物的生长提供了充足的基质和能量,进而促进了微生物种群数量的增加和活性的提高[22-23]。
与土壤微生物生物量碳含量的变化趋势相同,草地利用方式中4种土壤酶的活性也均显著高于玉米地,表明草地恢复对土壤酶活性的提高具有积极的作用。草地恢复后土壤微生物数量和活性增加是导致土壤酶活性提高的主要原因。此外,草地恢复后土壤中有机碳含量的增加(苜蓿地、羊草割草地、羊草地和自然恢复草地土壤有机碳含量比样地处理前增加了2.4、1.8、2.5和3.0 g C/kg),促进了土壤有机碳与土壤酶的结合,减少了土壤酶的水解[24],也在一定程度上提高了土壤酶的活性。4种草地利用方式中,苜蓿地、自然恢复草地、羊草地和羊草割草地中分别有4个、3个、2个和1个土壤微生物学指标的敏感性指数高于1.50,表明苜蓿地和自然恢复草地对土壤微生物学指标的影响明显高于羊草地和羊草割草地。
从土壤微生物学指标的绝对含量上来看,自然恢复草地中仅有土壤过氧化氢酶活性达到最高,而苜蓿地中则有土壤微生物生物量碳含量、土壤脲酶活性和碱性磷酸酶活性3个指标达到最高,表明苜蓿地对土壤微生物学指标的影响显著高于自然恢复草地。土地利用和管理方式的差异是导致土壤微生物学指标出现差异的主要原因。苜蓿作为一种豆科植物,具有生物固氮作用,它不仅能够增加土壤中有机物的输入,还能增加土壤中氮素的输入[25],从而为微生物群落的生长提供了更好的生存环境,因此比其它3种草地利用方式更有利于土壤微生物量和土壤酶活性的增加。在自然恢复草地中,由于群落的物种多样性显著高于单一物种的羊草地和羊草割草地,所以向土壤中输入的有机质的种类也会明显高于羊草地和羊草割草地,从而为土壤中多种微生物种群的生存提供适宜的环境,进而导致自然恢复草地对土壤微生物指标的影响高于羊草地和羊草割草地。
3.2 土地利用方式对土壤肥力质量的影响
本研究中,通过线性和非线性赋分函数获得的2个土壤质量指数间具有极显著的线性正相关关系(图3),表明它们均能准确的反映出土地利用方式变化对土壤质量的影响。虽然线性土壤质量指数值显著高于非线性土壤质量指数值,但在不同土地利用方式下2种土壤质量指数指示的土壤质量的差异是一致的(图2),表明应用2种方法中的任何一种方法对土壤质量进行评价均是可行的。这与Raiesi[19]在伊朗的研究得出的结论一致,他们也发现这2种土壤质量指数间具有较好的相关性,且均能反映出不同管理方式下土壤质量的变化。
与玉米地相比,苜蓿地、羊草割草地、羊草地和自然恢复草地中的线性土壤质量指数分别提高了61.8%、40.0%、36.4%和43.6%;而非线性土壤质量指数分别提高了100.0%、70.0%、63.3%和73.3%(图2)。2种土壤质量指数的分析结果均表明,草地恢复显著提高了研究区内0~10 cm土层的土壤肥力质量,即草地利用方式要比耕地更适合于研究区内土壤生产力的提高和土地的可持续利用。
4种草地利用方式中,苜蓿地的2种土壤质量指数值均明显高于其它3种草地利用方式(图2),表明种植苜蓿对于土壤肥力质量的改善要优于自然恢复草地和羊草地。此外,作为一种优良的饲草,苜蓿种植还能带来一定的经济效益。在当今研究区所处的北方农牧交错带出现玉米卖粮难,库存压力大,种植效益大幅降低[15],国家大力鼓励粮改饲的大背景下,在作物产量较低且土壤条件较差的区域将耕地转变为苜蓿饲草地可能是一种“双赢”的土地利用方式,既能增加当地农户的收入,促进农业结构的调整,又能提高土壤质量,促进土地的可持续利用。
4 结论
研究表明,土地利用方式对土壤微生物生物量碳含量、脲酶活性和蔗糖酶活性具有极显著影响。虽然土地利用方式对土壤过氧化氢酶活性和碱性磷酸酶活性没有显著影响,但4种草地利用方式中的过氧化氢酶活性和碱性磷酸酶活性均明显高于玉米地,表明土地利用方式变化对这2种土壤酶活性也具有一定的影响。因此,土壤微生物生物量碳含量、脲酶活性、蔗糖酶活性、过氧化氢酶活性和碱性磷酸酶活性均对土地利用方式变化具有一定的敏感性,均可以作为不同土地利用方式下土壤肥力质量评价的敏感性指标。
线性与非线性土壤质量指数间存在极显著的线性正相关关系,表明两者均能准确的反映出土地利用变化对土壤质量的影响。耕地转变为草地显著提高了土壤微生物生物量碳的含量和4种土壤酶的活性,进而提高了土壤的肥力质量,即草地利用方式要比耕地更适合于研究区内土壤的可持续利用和生产力的提高。5种土地利用类型中苜蓿地的土壤质量指数最高,自然恢复草地、羊草地和羊草割草地次之,而玉米地的土壤肥力质量最低,表明种植苜蓿对于研究区内土壤肥力质量的改善要明显优于其它土地利用方式。
[1] Doran J W, Parkin T B. Defining and Assessing Soil Quality[M]//Doran J W, Coleman D C, Bezdicek D F, et al. Defining Soil Quality for a Sustainable Environment. Soil Science Society of America Special Publication 35. SSSA and ASA, Madison, WI,USA, 1994: 1-21.
[2] 赵其国, 孙波, 张桃林. 土壤质量与持续环境:Ⅰ. 土壤质量的定义及评价方法[J]. 土壤, 1997, 29(3): 113-120.Zhao Q G, Sun B, Zhang T L. Soil quality and sustainable environment:Ⅰ. Definition and evaluation method of soil quality[J]. Soils, 1997, 29(3): 113-120.
[3] Liu Z J, Zhou W, Shen J B, et al. Soil quality assessment of albic soils with different productivities for eastern China[J]. Soil and Tillage Research, 2014, 140: 74-81.
[4] 田耀华, 冯玉龙. 微生物研究在土壤质量评估中的应用[J]. 应用与环境生物学报, 2008, 14(1): 132-137.Tian Y H, Feng Y L. Application of microbial research in evaluation of soil quality[J]. Chinese Journal of Applied and Environmental Biology, 2008, 14(1): 132-137.
[5] Bastida F, Zsolnay A, Hernandez T, et al. Past, present and future of soil quality indices: A biological perspective[J]. Geoderma,2008, 147: 159-171.
[6] Guo L L, Sun Z G, Zhu O Y, et al. A comparison of soil quality evaluation methods for Fluvisol along the lower Yellow River[J].Catena, 2017, 152: 135-143.
[7] 李卉, 李宝珍, 邹冬生, 等. 水稻秸秆不同处理方式对亚热带农田微生物生物量碳、氮及氮素矿化的影响[J]. 农业现代化研究, 2015, 36(2): 303-308.Li H, Li B Z, Zou D S, et al. Impacts of rice straw and its biochar produce on the amounts of microbial biomass carbon and nitrogen and the mineralization of soil organic nitrogen in subtropical croplands[J]. Research of Agricultural Modernization, 2015,36(2): 303-308.
[8] Paz-Ferreiro J, Fu S L. Biological indices for soil quality evaluation: Perspectives and limitation[J]. Land Degradation and Development, 2016, 27: 14-25.
[9] Andrews S S, Karlen D L, Cambardella C A. The soil management assessment framework: A quantitative soil quality evaluation method[J]. Soil Science Society of America Journal, 2004, 68:1945-1962.
[10] Meng Q F, Zhang J, Li X L, et al. Soil quality as affected by longterm cattle manure application in solonetzic soils of Songnen Plain[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(6): 84-91.
[11] Nakajima T, Lal R, Jiang S G. Soil quality index of a crosby silt loam in central Ohio[J]. Soil and Tillage Research, 2015, 146:323-328.
[12] 邓绍欢, 曾令涛, 关强, 等. 基于最小数据集的南方地区冷浸田土壤质量评价[J]. 土壤学报, 2016, 53(5): 1326-1333.Deng S H, Zeng L T, Guan Q, et al. Minimum dataset-based soil quality assessment of waterlogged paddy field in south China[J].Acta Pedologica Sinica, 2016, 53(5): 1326-1333.
[13] Liu D W, Wang Z M, Song K S, et al. Land use/cover changes and environmental consequences in Songnen plain, Northeast China[J]. Chinese Geographical Science, 2009, 19(4): 299-305.
[14] Yu P J, Han K X, Li Q, et al. Soil organic carbon fractions are affected by different land uses in an agro-pastoral transitional zone in Northeastern China[J]. Ecological Indicators, 2017, 73: 331-337.
[15] 陈玉洁, 张平宇, 刘世薇, 等. 东北西部粮食生产时空格局变化及优化布局研究[J]. 地理科学, 2016, 36(9): 1397-1407.Chen Y J, Zhang P Y, Liu S W, et al. The spatio-temporal pattern change and optimum layout of grain production in the west of northeast China[J]. Scientia Geographica Sinica, 2016, 36(9):1397-1407.
[16] Yu P J, Li Q, Jia H T, et al. Effect of cultivation on dynamics of organic and inorganic carbon stocks in Songnen Plain[J].Agronomy Journal, 2014, 106(5): 1574-1582
[17] 关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986.Guan S Y. Soil Enzyme and Its Research Methods[M]. Beijing:Agricultural Press, 1986.
[18] 于镇华. 垦殖与自然恢复黑土微生物群落结构及生态功能的季节变化[D]. 长春: 中国科学院东北地理与农业生态研究所,2012.Yu Z H. Seasonal variations of microbial community structures and functions in cultivated and natural restored Mollisols[D].Changchun: Northeast Institute of Geography and Agroecology,Chinese Academy of Sciences, 2012.
[19] Raiesi F. A minimum data set and soil quality index to quantify the effect of land use conversion on soil quality and degradation in native rangelands of upland arid and semiarid regions[J].Ecological Indicators, 2017, 75: 307-320.
[20] Askari M S, Holden N M. Quantitative soil quality indexing of temperate arable management systems[J]. Soil Tillage and Research, 2015, 150: 57-67.
[21] Raiesi F, Beheshti A. Soil specific enzyme activity shows more clearly soil responses to paddy rice cultivation than absolute enzyme activity in primary forests of northwest Iran[J]. Applied Soil Ecology, 2014, 75: 63-70.
[22] Somova L A, Pechurkin N S. Functional, regulatory and indictor features of microorganisms in man-made ecosystems[J]. Advance in Space Research, 2001, 27(9): 1563-1570.
[23] 刘长红, 袁野, 杨君, 等. 稻田改为旱地后土壤有机碳矿化及微生物群落结构的变化[J]. 应用与环境生物学报, 2015, 21(5):960-966.Liu C H, Yuan Y, Yang J, et al. Variation in soil organic carbon mineralization and microbial community structure induced by the conversion from double rice[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(5): 960-966.
[24] 杨瑞, 刘帅, 王紫泉, 等. 秦岭山脉典型林分土壤酶活性与土壤养分关系的探讨[J]. 土壤学报, 2016, 53(4): 1037-1046.Yang R, Liu S, Wang Z Q, et al. Relationships between the soil enzyme activity and soil nutrients in forest soils typical of the Qinling Mountain[J]. Acta Pedologica Sinica, 2016, 53(4): 1037-1046.
[25] Li Q, Yu P J, Li G D, et al. Gras-legume ratio can change soil carbon and nitrogen storage in a temperate steppe grassland[J].Soil and Tillage Research, 2016, 157: 23-31.
