一株塔宾曲霉的分离鉴定及其在地沟油鉴别中的应用
2018-01-22,,,,,,*
,,,,, ,*
(1.西南林业大学,西南地区生物多样性保育国家林业局重点实验室,云南昆明 650224;2.云南省林业科学院,国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南省森林植物培育与开发利用重点实验室,云南昆明 650201)
地沟油是过氧化值、酸价、水分、羰基价、丙二醛、AFB1等指标严重超标的非食用油,质量、卫生情况极差,一般分为3类[1]:一是狭义的地沟油,即将下水道中的油腻漂浮物或者将宾馆、酒楼的剩饭、剩菜(通称潲水)经过简单加工、提炼出的油;二是劣质猪肉、猪内脏、猪皮加工以及提炼后产出的油;三是用于油炸食品的油使用次数超过规定要求后,再被重复使用或往其中添加一些新油后重新使用的油[2]。近年来,随着我国餐饮业规模日益扩大,餐饮废水中排除的废弃油脂日益增多,每年大约200~300万吨地沟油返回餐桌[3]。据实验测定,长期摄入地沟油会对人体造成严重伤害,其结果会导致发育障碍,肠炎,肝、心、肾肿大,以及脂肪肝等[4]。因此,鉴别地沟油的检验方法的研究对地沟油的治理意义重大。
由于地沟油和食用油在制作工艺和成分上十分相似,传统的物理和化学检测不能有效鉴别出地沟油和普通食用油。于是一些不法商贩因地沟油价格低廉,来源广泛,化学结构复杂等特点[5],将地沟油经过简单处理后直接卖给了酒店和食堂充当食用油,严重威胁着人类的健康。截至目前,我国每年破获的地沟油案例屡见不鲜,并且一些政府部门也全力组织科研攻关,研究了众多鉴别 “地沟油”的方法[6-8]。其中较为常见的方法包括:感官法、色差法、电导率法、折光率法、基因成分分析法等。但利用微生物的特异性来鉴别地沟油和食用油的研究尚未见报道。
与普通食用油相比,地沟油中滋生着大量的微生物,其中还含有一些特殊的物质,一些微生物对地沟油中的微小差异是十分敏感的,并且大部分微生物会随着环境的改变,在一定的限度内,其形态、生理、生化、生长繁殖等特征甚至微生物群落都有可能发生改变[9]。因此,利用地沟油中特殊的物质或者生境来分离培养特异菌株,并应用于地沟油的鉴别研究之中,对于地沟油的鉴别检测技术的发展意义重大。本实验以地沟油中的真菌微生物为主要来源,筛选出能高效利用地沟油的特异菌株DGY03,并将其接种于以地沟油和标准食用油为唯一营养源的培养基中,比较了其在地沟油和食用油培养基上的生长速度、菌落形态以及培养基颜色变化等特征。确定了DGY03作为指示菌鉴别地沟油的可行性,为后期微生物作为指示菌鉴别地沟油打下坚实的基础。
1 材料和方法
1.1材料与仪器
地沟油 潲水油,由某火锅店提供;大豆油、菜籽油、玉米油、花生油为标准食用油 由某大型超市提供;琼脂、培养皿、试管、聚乙烯醇等 昆明丰科生物科技有限公司;牛肉膏、氢氧化钠、磷酸、活性白土 昆明爱卓商贸有限公司;真菌DNA快速提取试剂盒(溶液型)、2×Taq PCR MasterMix、ITS通用引物(ITS1-ITS4)等均由上海生物工程技术服务有限公司提供。
DF-3恒温磁力搅拌器 苏州威尔实验用品有限公司;2XZ直联型旋片式真空泵 浙江扬子江泵业有限公司;UV-2450紫外分光光度计 津岛有限公司;DM750显微镜 北京中仪光科科技发展有限公司;立式压力蒸汽灭菌器 上海博迅医疗设备厂;HH-2数显电子恒温水浴锅 丹瑞电器厂;HC-2518R高速冷冻离心机 安徽中科中佳仪器有限公司;SW-CJ-1D洁净工作台 江苏苏洁净化设备厂;HH.B11-BS电热恒温培养箱 上海跃进医疗器械有限公司。
1.2实验方法
1.2.1 培养基的配制 富集培养基:蛋白胨10.0 g/L,马铃薯粉5.0 g/L,葡萄糖15.0 g/L,NaCl 5.0 g/L,氯霉素0.025 g/L。
真菌分离培养基:马铃薯200.0 g,葡萄糖20.0 g,琼脂20.0 g,放入三角瓶中,加蒸馏水至1000 mL,121 ℃灭菌20 min。
平板筛选培养基:(NH4)SO41.0 g,K2HPO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,精炼地沟油10 mL,琼脂20.0 g,加蒸馏水至1000 mL,pH7.0~pH7.5,121 ℃灭菌20 min。
复筛培养基:精炼地沟油10 mL,琼脂20.0 g,pH7.0~pH7.2,加蒸馏水至1000 mL,121 ℃灭菌20 min。
应用培养基:精炼地沟油、大豆油、菜籽油、玉米油、花生油各10 mL,分别加入琼脂20.0 g,pH7.0~pH7.2,加蒸馏水至1000 mL,121 ℃灭菌20 min。配成五种以不同样品油为唯一营养源的培养基。其中实验所需的精炼地沟油均为除臭后的地沟油,且在配制各种培养基时,需预先将样品油与聚乙烯醇(体积分数为20%)以1∶3的比例混合,搅动乳化5 min,即配制成乳化液。灭菌后,再将其加入到培养基中。
1.2.2 地沟油的精炼
1.2.2.1 地沟油的精炼工艺 地沟油的精炼工艺主要包括脱胶、脱酸、脱色以及脱臭等流程。其最佳工艺参数参照餐饮业潲水油精炼工艺的方法[10]。即首先向地沟油中加入0.10%(v:v)磷酸,在55 ℃水浴35 min后,加2%的去离子水(v:v)进行脱胶;其次加入0.33%的超碱(氢氧化钠占粗油重的百分数)使其碱液浓度为17.58°Be,75 ℃进行碱练;然后加入4.0%(w∶w)的活性白土,按搅拌速度为50 r/min,在65 ℃水浴中搅拌35 min进行脱色;最后在残压为0.53 Pa,脱臭温度为256 ℃,于直联型旋片式真空泵中脱臭5.6 h形成精炼地沟油。
1.2.2.2 地沟油的理化指标检测 地沟油的理化指标检测参照国家食用油卫生标准GB2716-2005对油脂的各种理化指标作出的规范和限定,本实验主要对精炼地沟油的酸价(AV)、过氧化值(POV)、羟基价、以及碘价(I.V)进行了测定,其测定方法均参照餐饮业潲水油脂的理化检测方法[10]。
1.2.3 实验样品的预处理和真菌的分离纯化 由于实验所用的地沟油样品含有部分颗粒状杂质,需对地沟油样品进行预处理,其处理方法参照地沟油与食用油中微生物群落结构多样性比较[9]的方法。然后取样品油10 mL,加入30 mL灭菌的聚乙烯醇(体积分数为20%)在35 ℃水浴中振荡混合5 min,最后倒入100 mL灭菌的富集培养基中,制成悬液。置于28 ℃,150 r/min的摇床上振荡培养2 d。将富集液用无菌水进行梯度稀释,取稀释浓度为10-3的稀释液,涂布于分离培养基中,置于28 ℃培养箱中培养4 d,挑选出在培养基上生长良好的菌株。并进行纯化培养,挑取单菌落接种到试管斜面中,在4 ℃保存备用。
1.2.4 真菌的筛选 经分离纯化培养后,分别将纯化后的菌株接种于平板筛选培养基中,置于28 ℃培养箱中培养4 d,挑选出生长良好的菌株。并将其接种于复筛培养基中,置于28 ℃培养箱中培养7 d,观察其生长状况以及培养基颜色变化等特征,最终将能在地沟油中大量生长繁殖或者培养基有明显变色现象的菌株作为特异菌株,并进一步将其作为指示菌应用于地沟油的鉴别研究之中。
1.2.5 特异菌株的鉴定
1.2.5.1 特异菌株DNA提取和ITS PCR扩增 特异菌株DNA的提取采用真菌DNA快速提取试剂盒(溶液型)。在提取菌株DNA后,进行ITS扩增[11]。正向引物:5′-TCCGTAGGTGAACCTGCGG-3′和反向引物:5′-TCCT CCGCTTATTGATATGC-3′。PCR采用50 μL反应体系:2×Taq PCR MasterMix 25 μL,primerF(10 μmol/L)2.0 μL,primerR(10μmol/L)2.0 μL,DNA template 1.0 μL,补足ddH2O至50 μL。PCR扩增条件:94 ℃ 4 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 10 min;4 ℃ 30 min。用质量分数为0.8% 琼脂糖凝胶进行PCR 产物的检测,20 min后,用凝胶成像仪照相检测。
1.2.5.2 特异菌株ITS序列分析 将扩增的 PCR 产物送昆明擎科有限公司纯化并测序。并将测序所得序列在NCBI数据库(http://blast.st-va.ncbi.nlm. nih.gov/Blast.cgi)中进行BLAST序列相似性比对,从中获取与该菌株序列同源性较高的部分菌株序列,用ClustalX按照最大同源性的原则进行排序,并用BioEdit 5.0.9进行序列对齐,最后用MEGA 6.0软件进行系统发育树构建,以确定其种属地位。
1.2.6 特异菌株的应用 为了将筛选出的特异菌株应用于地沟油的鉴别之中,本实验以地沟油和四种标准食用油(分别为大豆油、菜籽油、玉米油、花生油)作为唯一营养源配制成应用培养基,从培养好的特异菌株的菌落边缘,用直径为5 mm的打孔器取菌饼,将菌饼用接种针接入到培养基的中心位置,菌丝面向下,每种培养基重复3次,同时以加有10 mL的无菌水作为空白对照。放入28 ℃恒温培养箱,培养7 d,观察并比较菌株在不同类型培养基上的菌落生长速度、菌落长势以及培养基颜色变化等特征。其中菌落直径的测定采用十字交叉法,菌落生长速度=(菌落平均直径-菌饼直径)/菌株培养天数。
2 结果与分析
2.1地沟油的精炼结果
依据中华人民共和国食用油卫生标准GB2716-2005对油脂的各种理化指标作出的规范和限定,本实验主要对经精炼后地沟油(图1)的酸价、过氧化值、羟基价、以及碘价进行了测定,其结果见表1。
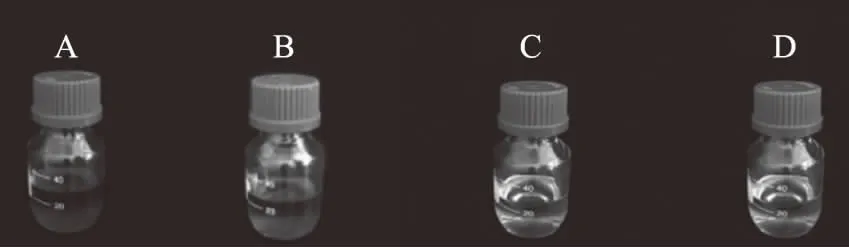
图1 地沟油精炼过程中各油样外观对比Fig.1 The comparison of respective sample oil in the oil refining process of gutter oil注:A:脱胶油;B:脱酸油;C:脱色油;D:除臭油。

检测项目植物油卫生标准(参照GB2716-2005)精炼地沟油是否超标AV(mg/g)≤3028否POV(g/100g)≤025019否羟基价(meq/kg)≤500423否IV(g/100g)约10085否
由结果可知,地沟油经精炼后其酸价、羟基价、过氧化值以及碘价的指标已达到植物油卫生标准。但与市售食用植物油相比,精炼地沟油在羟基价、过氧化值、油脂色泽等方面仍存在较小的差距。
2.2菌株分离结果
经分离纯化培养,从地沟油中分离出8株生长较好且形态各异的真菌菌株,分别编号为DGY01~DGY08。
2.3特异菌株的筛选结果
经平板筛选培养后,初步获得了2株生长良好的菌株,分别将其命名为DGY03和DGY05,其菌落形态特征及菌丝或孢子等显微结构特征如图2。由图2可知,菌株DGY03菌落平坦,呈同心圆状,边缘具有白色的菌丝体,质地丝绒状;分生孢子球形或近球形,壁近于平滑至稍粗糙;分生孢子梗发生于基质,老时黄色或黄褐色,壁平滑,顶囊球形或近球形。菌株DGY05菌落致密,菌丝有横隔,分生孢子梗亦有横隔,光滑或粗糙;分生孢子球形、椭圆形或短柱形,光滑或粗糙,大部分生长时呈蓝绿色;分生孢子梗经过多次分枝,产生几轮对称或不对称的小梗,形如扫帚,称为帚状体。

图2 菌株DGY03和DGY05在平板筛选培养基上的菌落形态和显微结构特征Fig.2 The colony morphology and microstructure characteristics of the strain DGY03 and DGY05 in filter medium注:A、B表示DGY03;C、D表示DGY05。
通过将获得的DGY03和DGY05分别接种于复筛培养基中,观察其在地沟油培养基上的生长状况以及菌落形态等特征。其结果发现,菌株DGY03在培养基中表现出较强的生长繁殖现象(图3)。即当恒温培养7 d,其菌落扩散直径为40~55 mm,但与图2相比,菌落表面不再呈同心圆状,而是呈粉末状,且边缘无明显的白色菌丝体。而菌株DGY05在培养基上则表现出生长缓慢、菌丝体不发达、无明显产孢现象等特点,不能有效地以地沟油为营养源进行生长繁殖。综上所述,本实验将能在地沟油培养基上快速生长繁殖的菌株DGY03作为特异菌株。
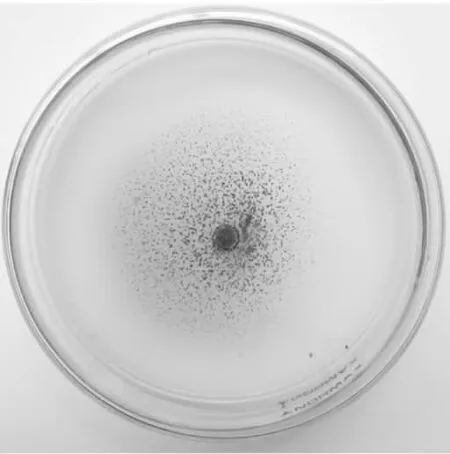
图3 菌株DGY03在地沟油培养基上的生长状况和菌落形态Fig.3 The growth and colony morphology of the strain DGY03 in the gutter oil medium
2.4特异菌株的鉴定结果
2.4.1 菌株DGY03的PCR扩增结果 用通用引物对菌株DGY03的ITS序列进行PCR扩增,得到重复性好、稳定清晰的特异扩增片断,长约650 bp(图4)。
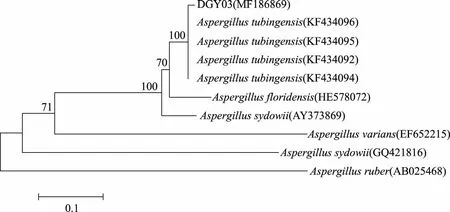
图5 基于ITS序列构建的菌株DGY03系统发育树Fig.5 The phylogenetic dendrogram of the strain DGY03 based ITS sequences

图4 菌株DGY03 rDNA ITS区段PCR产物电泳结果Fig.4 The PCR results of the strain DGY03 in rDNA ITS segment注:图谱中1、2代表DGY03,M代表标准DL2000。
2.4.2 菌株DGY03的ITS序列测定及系统进化分析 通过对菌株DGY03的ITS序列进行PCR扩增,获得了大约650 bp的拼接序列(Genbank登录号:MF186869)。将DGY03在NCBI中BLAST同源性比对后,构建确定其分类地位的系统发育树(图5),由图5可知DGY03与塔宾曲霉(Aspergillustubingensis)的同源性达100%,由此可将DGY03归为塔宾曲霉,属子囊菌门,散囊菌纲,散囊菌目,曲霉科,曲霉属。
2.5菌株DGY03的应用结果分析
本实验通过分别比较菌株DGY03在地沟油和四种不同类型食用油培养基上的菌落生长速度、菌落长势、菌落形态以及培养基颜色变化等特征(表2,图6),研究其作为指示菌鉴别地沟油的可行性。

表2 菌株DGY03在不同样品油培养基上生长变化情况的比较Table 2 The comparison of growth and variation of the strain DGY03 in the different sample oil culture medium

图6 菌株DGY03在地沟油培和花生油培养基上的生长状况和菌落形态的比较Fig.6 The comparison of growth and colony morphology of strain DGY03 in gutter oil and peanut oil注:A地沟油培养基 B 花生油培养基。
由表2和图6可知,菌株DGY03在地沟油和食用油培养基上的菌落表面形态和培养基颜色变化方面基本一致,无明显差异现象。但菌株DGY03在地沟油培养基上的菌落生长速度和菌落长势明显优于其它四种食用油培养基,且菌株DGY03在四种食用油培养基上菌落生长速度和菌落长势基本一致。其在大豆油、菜籽油、玉米油、花生油培养基上的菌落生长速度分别为0.21、0.28、0.24、0.29 cm/d,而在地沟油培养基上的菌落生长速度为0.64 cm/d,对照组则无明显生长现象。由此说明由于地沟油成分复杂,其内所含的某些特殊成分能够为其生长繁殖提供部分营养物质,从而使菌株DGY03在地沟油培养基上更好的生长繁殖。
因此综上所述,通过比较菌株DGY03在地沟油和食用油培养基上的菌落生长速度以及菌落长势等变化特征,能够有效地区别出地沟油与食用油间的差别。由此初步推断,可以利用微生物对地沟油的特异性来鉴别地沟油。
3 结论
本研究对从地沟油中分离得到的8株真菌进行了特异性研究,经筛选分离培养出了一株能在只含有精炼地沟油的培养基上大量生长繁殖的特异菌株DGY03,并通过该菌株的菌落形态、微观结构以及rDNA ITS序列分析相结合,判断该特异菌株为塔宾曲霉(Aspergillustubingensis)。同时根据该菌株在地沟油和食用油培养基上生长变化情况等特征的比较,初步探讨了其在地沟油鉴别领域的应用价值。由实验结果可知,菌株DGY03在地沟油培养基上无论从菌落生长速度还是菌落长势方面比较都明显优于大豆油、菜籽油等四种食用油,这说明了由于地沟油来源广泛,其中含有部分供微生物生长所需的微量元素和营养物质,经精炼后的地沟油也无法完全去除。故经精炼后的地沟油不仅能为菌株DGY03提供丰富的碳源,而且还能提供部分供其生长所需的特殊营养物质。同时由于实验所需的大豆油、菜籽油、玉米油以及花生油都是市场上购买的未经使用过的标准食用油,其内所含营养物质相较于地沟油更为单一,部分可能缺乏供其生长所需的必要物质,大大限制了该菌株在其培养基上生长繁殖,故表现出菌丝体不发达,生长速度较慢等特征。由此可见,利用地沟油所含物质的特殊性或者丰富性来筛选分离菌株,并根据其在不同样品油培养基上的菌落生长速度以及菌落长势等差异可应用于地沟油的鉴别之中。
由于运用微生物作为指示菌鉴别地沟油,首先得收集大量的不同来源的地沟油,大量筛选菌株,筛选出能对多种不同来源地沟油敏感的菌株,并且还要与市场上各种标准食用油进行对比分析,从而才能最终确定敏感指示菌株;其次菌株长时间的保藏,在应用方面菌株可能存在退化的可能,这还需不断对指示菌进行复壮才能达到检测效果;然后由于地沟油精炼技术不断改进和提高,精炼后的地沟油在理化性质方面已经接近食用油的标准,这对于指示菌的敏感性将进一步增加其难度;最后运用指示菌鉴别地沟油需要研究标准检测方法和操作流程,这需要做大量的研究工作。本实验只针对从地沟油中分离到的部分真菌进行简单的筛选和观察,目的在于运用微生物学方法研究鉴别地沟油的可行性,这离实际应用仍然存在一定差距,后期还需要选取不同来源的地沟油,对其培养条件进行优化,确定菌株DGY03是否为地沟油所特有的菌株,从而将其作为鉴定地沟油的标准。截至目前,科学家们并没有找到一种较可靠的方法来检测和鉴别地沟油[12],但随着目前指示菌的深入研究[13-14]以及微生物学和基因工程的快速发展,相信在不久的将来从微生物角度出发有望为地沟油鉴别领域开辟一条新的思路。
[1]王梅.杜绝食用地沟油[J].人生与伴侣:新养生,2006(12):11.
[2]焦云鹏.地沟油鉴别和检测的研究进展[J].现代食品科技,2008,24(4):37-80.
[3]刘凤玲,李玉香,李文华.地沟油快速检测研究进展[J].中国医药科学,2015,5(17):38-39.
[4]段宝荣,谭树志.地沟油检测技术及应用进展[J]. 西部皮革,2011,33(12):51-54.
[5]王嵬,刘连利,仪淑敏.地沟油鉴别检验方法研究进展[J].食品安全质量检测学报,2015,6(1):219-221.
[6]杨扬,殷乐,尹芳华,等.几种食用油的核磁共振光谱特征与地沟油的快速检测[J].中国油脂,2015,40(7):45-50.
[7]宋崇富,田志美,杨海城,等.基于电导率测定的地沟油快速检测方法研究[J].广州化工,2017,45(2):104-106.
[8]王婉,于清峰,肖莹,等.高效液相色谱-荧光衍生法快速测定地沟油中的长链脂肪醛[J].分析化学,2017,45(5):770-776.
[9]刘绍雄,张敬宜,王金华,等.地沟油与食用油中微生物群落结构多样性的比较[J].江苏农业科学,2013,41(3):264-267.
[10]黄军.餐饮业稍水油的精炼工艺、理化检测及无害化饲用研究[D].南昌:南昌大学,2008,14-77.
[11]燕勇,李卫平,高雯洁,等.rDNA-ITS序列分析在真菌鉴定中的应用[J].中国卫生检验杂志,2008(10):1958-1961.
[12]张慧,毛润乾,郑基焕,等.地沟油高光谱透射检测分析[J].粮食与油脂,2017,30(5):31-32.
[13]董向丽,高晓明,邢小霞,等.敏感指示菌用于农药残留检测初探[J].莱阳农学院学报:自然科学版,2006,23(4):323-325.
[14]封倩,李翠枝,郭军.抗生素残留检测指示菌的初步筛选[J].畜牧与饲料科学,2009,30(3):40-42.
