草苁蓉环烯醚萜苷含药血清诱导人肝癌SMMC-7721细胞凋亡中PI3K/Akt通路的作用
2018-01-22,,,,,*
, ,,,,*
(1.延边大学附属医院,吉林延吉 133000;2.延边大学基础医学院,吉林延吉 133000)
肝细胞性肝癌(Hepatocellular Carcinoma,HCC,简称肝癌)是常见的恶性肿瘤,地球上发病率排第6位,死亡率为癌症谱的前三位[1]。研究发现,多种信号通路参与肝细胞的增殖与凋亡[2],而诱导肿瘤细胞凋亡是目前研究的热点。PI3K/Akt作为调节Bcl-2家族的主要通路之一,调节Bcl-2家族的磷酸化水平,从而调控细胞凋亡[3-4]。
民族传统中药草苁蓉又称不老草,具有补肾壮阳、滋补强身之功效。草苁蓉环烯醚萜苷(Iridoid glycosides from Boschniakia rossica,IGBR)是草苁蓉重要活性成分,具有抗癌、诱导凋亡、清除自由基、保肝等作用[5-6]。本课题组以往主要是在大鼠肝癌癌前病变的模型中研究IGBR对细胞凋亡的作用,而其在体外(细胞培养)实验中是否可以通过细胞凋亡相关信号通路影响肝癌细胞的凋亡,目前尚未研究。
本课题组前期研究表明,当IGBR直接作用于肝癌细胞时,虽然有一定的抑制作用,但细胞存活率仍无显著差异,有90%以上的肝癌细胞继续保持生长。本实验通过给Wistar雄性大鼠灌胃IGBR来制备IGBR含药血清,观察其诱导人肝癌SMMC-7721细胞凋亡及在这一过程中细胞凋亡相关的PI3K/Akt信号通路的作用。
1 材料与方法
1.1材料与仪器
Wistar雄性大鼠体重(180±20) 延边大学实验动物中心(许可证号:SCXK(吉)2011-0007);IGBR 由延边大学基础医学院生化教研室全吉淑教授惠赠;5-氟尿嘧啶(5-FU) 山东新时代药业有限公司;人肝癌SMMC-7721细胞 由中国科学院上海生命科学研究院提供;DMEM/HIGH GLUCOSE 美国HyClone公司;Penicilin-Streptomycin Solution 美国Gen DEP OT公司;Cell Titer 96 Aqueous One Solution Cell Proliferation Assay Kit 美国Promega公司;Dimethyl sulfoxide(DMSO) 美国Sigma公司;FITC Annexin V Apoptosis Detection Kit I 美国BD Biosciences公司;RPMI-1640培养基 美国Gibco公司;胎牛血清 美国Gibco公司;AO/BE双染色试剂盒 北京索莱宝科技有限公司;抗Bax、Bcl-2多克隆抗体 北京中杉金桥公司;β-actin、兔抗人Akt、p-Akt抗体 Cell Signaling Technology公司;ECL化学发光试剂盒 美国Thermo Scientific。
Neubauer-improved型细胞计数板 德国Marienfeld;BioTek Eon微孔板分光光度计 北京拜西欧斯生物技术有限公司;IX70-1120倒置显微镜 OLYMPUS公司;CO2培养箱 Thermo公司;无菌超净台 BIOAIR公司;PVDF膜 美国BioRad公司;Tlot转印槽 美国Bio Rad公司;凝胶显像仪 美国Protein Simple公司。
1.2实验方法
1.2.1 细胞培养 将人肝癌SMMC-7721细胞置于37 ℃、5% CO2恒温培养箱中,培养于10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI-1640培养液中,每2~3 d传代一次,取对数生长期(7 d)细胞进行实验[7]。
1.2.2 药物血清制备 将Wistar雄性大鼠随机分为对照组、5-FU组、IGBR低、中、高剂量组每组6只;对照组给予生理盐水2 mL灌胃;5-FU组按照75 mg/kg的剂量灌胃5-FU;IGBR组分别以125、250、500 mg/kg的剂量给予大鼠灌胃IGBR,每天一次,连续用药1 月后,处死各组大鼠,取心脏血(各组6 只大鼠血清的混合物)经3000 r/min,离心20 min,56 ℃恒温箱中水浴30 min用以灭活血清中补体等活性成分,-20 ℃保存备用。
1.2.3 MTT法测定细胞活力 将人肝癌SMMC-7721细胞加入96 孔板中,100 μL悬液内含1×103个细胞,共200 μL;24 h后吸弃培养液,加入含不同终浓度IGBR无血清细胞培养液100 μL,处理不同时间后吸去培养液。设置阴性对照组(只加等量二甲基亚砜(DMSO))、空白对照组(只加等量培养液)和实验组;培养24、48 h后,每孔加入20 μL MTT(以无血清细胞培养液稀释,终浓度为0.5 mg/mL),放入5% CO2,37 ℃的细胞培养箱中孵育30 min;加入200 μL DMSO;振荡器振荡10 min,充分溶解;酶标仪波长490 nm测吸光度值并计算细胞存活率:
细胞存活率(%)=实验组OD/阴性对照组OD×100
1.2.4 流式细胞仪检测细胞凋亡 取人肝癌SMMC-7721细胞(5×105个/培养瓶),进行细胞培养。除对照组,5-FU、IGBR分别作用24 h后收获细胞。用预冷的PBS缓冲液冲洗肝癌细胞加入100 μL 1×Binding Buffer重悬细胞,置于室温下,避光10 min;加入5 μL Annexun V-FITC和5 μL PI Staining Solution,混匀;加入400 μL 1×Binding Buffer,混匀;流式细胞仪观察细胞凋亡。
1.2.5 Western blot检测蛋白表达 提取细胞总蛋白后检测蛋白浓度,配制5%的浓缩胶和12%的分离胶进行电泳,电转移至PVDF膜。5%脱脂奶粉中室温封闭1.5~2.0 h,分别加入1∶500稀释的一抗Akt和p-Akt抗体、抗Bax和Bcl-2多克隆抗体,4 ℃过夜(12 h);加入1∶1000稀释的二抗,室温下孵育2~3 h,TBS洗膜3次后,ECL发光液滴加在PVDF膜上,采用凝胶成像系统成像。PI3K抑制剂LY294002作用细胞以20 μmol/L浓度孵育30 min后,再以80 μmol/L IGBR药物血清处理细胞48 h,检测LY294002对凋亡特征性蛋白的影响。
1.3数据处理

2 结果与分析
2.1IGBR药物血清对人肝癌SMMC-7721细胞活力的影响
由表1可知,IGBR药物血清可降低人肝癌SMMC-7721细胞活力,并呈浓度和时间依赖性。5-FU(75 mg/kg)和低(125 mg/kg)、中(250 mg/kg)、高(500 mg/kg)浓度IGBR灌胃后取得的含药血清作用人肝癌SMMC-7721细胞24 h后,细胞活力分别降低为75%、88%、85%和80%,与对照组相比差异显著(p<0.05);而作用48 h后,细胞活力分别降低为52%、66%、65%和62%,与对照组相比差异显著(p<0.05)。

表1 5-FU和IGBR含药血清对SMMC-7721肝癌细胞存活率的影响Table 1 Effects of serum containing 5-FU and IGBR on the survival rate of SMMC-7721 hepatoma cells

图1 给药48 h后人肝癌SMMC-7721细胞凋亡率的检测Fig.1 After administration of 48 h,the cell apoptosis rate was detected by SMMC-7721
注:*与对照组比较,p<0.05;#与对照组比较,p<0.05。2.2IGBR含药血清对人肝癌SMMC-7721细胞凋亡的影响
流式细胞仪检测结果显示,IGBR作用48 h后,与对照组比较,5-FU组与IGBR组凋亡率升高(p<0.05),两组间无显著差异(p>0.05),IGBR组随给药剂量的增加其凋亡程度加重,见图1。
2.3IGBR含药血清对人肝癌SMMC-7721细胞中PI3K/Akt通路相关蛋白表达的影响
PI3K/Akt通路在细胞增殖、凋亡等过程中发挥重要的作用,本研究也探讨了IGBR含药血清对人肝癌SMMC-7721细胞PI3K/Akt通路的影响,由图2可知,5-FU组和IGBR组人肝癌SMMC-7721细胞p-Akt蛋白表达降低,与对照组相比差异显著(p<0.05),随着IGBR含药血清浓度的增加,p-Akt蛋白表达逐渐减少,但不影响总Akt蛋白表达水平。以上结果可知,IGBR含药血清可纯化人肝癌SMMC-7721细胞的PI3K/Akt通路。

图2 IGBR处理人肝癌SMMC-7721细胞p-Akt、Akt蛋白表达量Fig.2 The expression of p-Akt and Akt protein in SMMC-7721 cells treated with IGBR(±s,n=3)注:*与对照组比较,p<0.05;#与对照组比较,p<0.05;图3同。
2.4IGBR含药血清对人肝癌SMMC-7721细胞中Bax及Bcl-2蛋白表达的影响
以不同浓度IGBR含药血清处理人肝癌SMMC-7721细胞,Western blot检测结果显示,5-FU组和IGBR组Bax表达水平升高,而Bcl-2表达水平降低,与对照组相比显著差异(p<0.05),但两组间无显著差异(p>0.05),且随着IGBR含药血清浓度的增加,上述变化更明显,见图3。
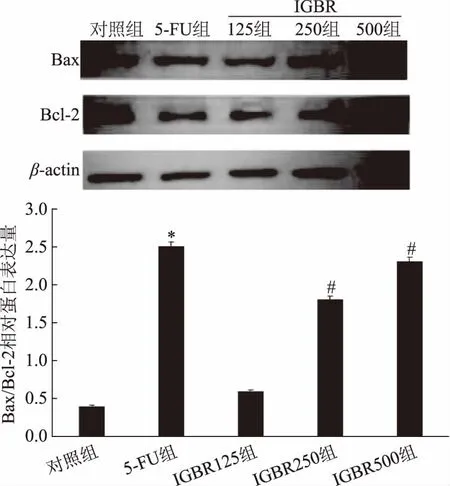
图3 IGBR处理对人肝癌SMMC-7721细胞Bax和Bcl-2蛋白表达的影响Fig.3 Effects of IGBR treatment on the expression of Bax and Bcl-2 proteins in SMMC-7721 cells(±s,n=3)
2.5IGBR含药血清联合抑制剂对人肝癌SMMC-7721细胞中PI3K/Akt通路相关蛋白及Bax、Bcl-2表达的影响
用PI3K/Akt信号通路特异性的抑制剂LY294002作用于细胞后,与对照组相比,抑制剂单独作用后p-Akt蛋白表达降低,Bax与Bcl-2比值增加(p<0.05),而抑制剂与IGBR联合作用后p-Akt蛋白表达量显著降低,Bax与Bcl-2比值显著增加(p<0.05),见图4。研究证明,PI3K/Akt信号通路参与了IGBR诱导的肝癌细胞凋亡。

图4 IGBR联合抑制剂处理人肝癌SMMC-7721细胞p-Akt/Akt、Bax/Bcl-2相对表达量Fig.4 The relative expression of p-Akt/Akt and Bax/Bcl-2 in SMMC-7721 cells treated with IGBR combined inhibitor注:#与对照组比较,p<0.05;Δ与对照组比较,p<0.05;#Δ与对照组比较,p<0.05。
3 讨论
P13K/Akt信号通路通过影响其下游多种效应分子而发挥抗凋亡作用。PI3K/Akt及其相关蛋白经过基因或抑制剂的干预,可阻止下游抗凋亡基因的活化,而促进细胞凋亡,目前成为研究肿瘤治疗的焦点[8]。PI3K/Akt信号通路激活参与肿瘤发生、发展,也是肝癌发生、发展中一个主要调节途径。PI3K/Akt信号通路被活化后促进细胞增殖存活,抑制细胞凋亡,加速肿瘤的发生、发展[9-10]。PI3K使Akt激活后,磷酸化下游底物,影响细胞分裂、生存、代谢等[11-12]。活化的Akt能够通过磷酸化调节转录因子家族发挥抑制细胞凋亡作用。磷酸化Akt具有生物活性,可通过磷酸化凋亡相关蛋白Bax、Caspase-9和一些蛋白激酶来进一步控制细胞凋亡[13-16]。
Bcl-2家族成员定位于胞质或细胞骨架,遇到死亡信号后改变构象,转位于线粒体外膜上,受上游信号通路的调节可发生Bax表达升高,构象改变、BAD和Bik的磷酸化失活等,影响凋亡相关蛋白的平衡、线粒体的结构与功能,决定细胞生死[17]。PI3K/Akt信号通路可影响Bcl-2家族的构象或二聚体的形成等,从而调控细胞凋亡[4,18]。研究表明,细胞凋亡的发生受多种基因的调控,其中Bax和Bcl-2备受关注,且其比值决定细胞接受凋亡信号后存活与否,在调控凋亡中起关键作用[19-21]。Bax为凋亡促进蛋白,Bcl-2为凋亡抑制蛋白,细胞中Bax升高则形Bax同源二聚体,加速凋亡;反之形成Bax/Bcl-2异源二聚体,而抑制凋亡[22-23]。
本实验发现,IGBR含药血清可降低人肝癌SMMC-7721细胞活力,诱导其凋亡,并呈浓度依赖性。IGBR含药血清干预后,人肝癌SMMC-7721细胞p-Akt、Bcl-2蛋白的表达水平下降,Bax蛋白的表达水平增加,而总Akt蛋白未见明显变化。进一步研究表明IGBR含药血清能够抑制磷酸化Akt的表达,抑制剂LY294002 促进了磷酸化Akt的减少;这些证据都表明PI3K/Akt信号通路介导了IGBR含药血清诱导的肝癌细胞凋亡。另外,本实验检测到Bax/Bcl-2比值受IGBR含药血清诱导后增加,证明IGBR含药血清确实通过Bcl-2家族诱导了细胞凋亡。
4 结论
细胞凋亡可导致细胞死亡,本研究通过MTT法、流式细胞义检测和Western blot检测表明IGBR含药血清可抑制人肝癌SMMC-7721细胞的增殖,抑制Akt蛋白磷酸化作用;并通过PI3K/Akt信号通路参与Bax及Bcl-2蛋白的调控,IGBR诱导人肝癌SMMC-7721细胞发生凋亡。
总之,肝癌细胞生长中有复杂的信号网络,调节着肿瘤的生长、分化、转移和预后。利用细胞信号通路探寻阻断肿瘤形成的机制,为肝癌的诊治带来新的契机,进而为积极开展临床实验,研发中药抗癌药提供科学依据。
[1]Forner A,Llovet J M,Bruix J. Hepatocellular carcinoma[J]. Lancet,2012,379(9822):12 45-1255.
[2]Wei Z,Doria C,Liu Y. Targeted therapies in the treatment of advanced hepatocellular carcinoma[J]. Clinical Medicine Insights Oncology,2013,20(7):87-102.
[3]Liu Y,Liu H,Zou J,et al. Dengue virus subgenomic RNA induces apoptosis through the Bcl-2-mediated PI3k/Akt signaling pathway[J]. Virology,2014,448:15-25.
[4]Xia Y P,Dai R L,Li Y N,et al. The protective effect of sonic hedgehog is mediated by the phosphoinositide[corrected]3-kinase/AKT/Bcl-2 pathway in cultured rat astrocytes under oxidative stress[J]. Neuroscience,2012,209:1-11.
[5]尹学哲,许惠仙,赵文玺,等. 草苁蓉水萃取物对脂多糖与D-氨基半乳糖所致小鼠肝脏氧化应激和细胞凋亡的影响[J].食品与生物学技术学报,2013,32(5):469-473
[6]XIAO Z,SHAN J,LI C,et al. Mechanisms of cyclosporine-induced renal cell apoptosis:a S-ystematic review[J]. American Journal of Nephrology,2013,37(1):30-40.
[7]张萌,彭利,乔治斌,等. 罗格列酮诱导人肝癌HepG2细胞凋亡中p38MAPK通路的作用[J]. 肿瘤防治研究,2014,41(11):1181-1185.
[8]Kumar A,Rajendran V,Sethumadhavan R,et al. AKT kinase pathway:a leading targetin Cancer research[J]. The Scientific World Journal,2013:756134.
[9]Kumar D,Shankar S,Srivastava R K. Rottlerin induces autophagy and apoptosis in prostate cancer stem cells via PI3K/Akt/m TOR signaling pathway[J]. Cance Letters,2014,43(2):179-189.
[10]Li Y,Zhao H,Wang Y,et al. Isoliquiritigenin induces growth inhibition and apoptosis through downregulating arachidonic acid metabolic network and the deactivation of PI3K/Akt in human breast cancer[J]. Toxicology and applied Pharmacology,2013,272(1):37-48.
[11]Polivka J Jr,Janku F. Molecular targets for cancer therapy in the PI3K/AKT/m TOR pathway[J]. Pharmacol Ther Apeutics,2014,142(2):164-175.
[12]Braccini L,Ciraolo E,Martini M,et al. PI3K keeps the balance between metabolism and can cer[J]. Advances in Biological Regulation,2012,52(3):389-405.
[13]Qin H,Du X,Zhang Y,et al. Platycodin D,a triterpenoid saponin from Platycodon grandiflor um,induces G2/M arrest and apoptosis in human hepatoma Hep G2 cells by modulating the PI3K/Akt pathway[J]. Tumour Biology,2014,35(2):1267-1274.
[14]Dey J H,Bianchi F,Voshol J,et al. Targeting fibroblast growth factor receptors blocks PI3K/AKT signaling,induces apoptosis,and impairs mammary tumor outgrowth and metastasis[J]. Cancer Research,2010,70(10):4151-4162.
[15]Liu C M,Ma J Q,Sun Y Z,et al. Puerarin protects rat kidney from lead-induced apoptosis by modulating the PI3K/Akt/e NOS pathway[J]. Toxicology and Applied Pharmacology,2012,258(3):330-342.
[16]Franke T F,Hornik C P,Segev L,et al. PI3K/Akt and apoptosis:size matters[J].Oncogene,2003,22(56):8983-8998.
[17]杨连君,曹雪涛,于益芝. bcl-2,bax 与肿瘤细胞凋亡[J].中国肿瘤生物治疗杂志,2003,10(3):232-234.
[18]Liu Y,Liu H,Zou J,et al. Dengue virus subgenomic RNA induces apoptosis through the Bcl-2-mediated PI3k/Akt signaling pathway[J]. Virology,2014,448:15-25.
[19]Cory S,Adams J M. Killing cancer cells by flipping the Bcl-2/Bax switch[J]. Cancer Cell,2005,8(1):5-6.
[20]Baraz L,Haupt Y,Elkin M,et al.Tumor suppressor p53 regulates Heparanase gene expression[J]. Oncogene,2006,25(28):3939-3947.
[21]Stefanaki C,Aatoniou C,Stefanaki K,et al. Bcl-2 and Bax in congenital naevi[J]. The British Journal of Dermatology,2006,154(6):1175-1179.
[22]Xiang J,Xiang Y,Lin S,et al. Anticancer effects of depro-teinized asparagus polysaccharide on hepatocellular carcinomainvitroandinvivo[J].Tumour biology,2014,35(4):3517-3524.
[23]Gonzalez-Sanchez E,Marin J J,Perez M J. The expression of genes involved in hepatocell ular carcinoma chemoresistance is affected by mitochondrial genome depletion[J]. Molecular Pharmaceutics,2014,11(6):1856-1868.
