酶法制备大豆肽的相对分子量分布及降压作用研究
2018-01-22,,,,,,,,,*
, ,,,,,, , ,*
(1.山东中医药大学,山东济南 250355;2.安徽生物肽产业研究院有限公司,安徽芜湖 241000;3.青岛大学附属医院,山东青岛 266000)
我国是世界大豆的主产国之一,大豆资源丰富,大豆分离蛋白是大豆榨油的副产品,目前主要用于饲料,开发利用率不高,浪费严重,这不仅是对可利用粮食资源的极大浪费,而且对环境造成一定程度的污染[1]。大豆分离蛋白中氨基酸种类有近20种,并含有人体必需氨基酸,其营养丰富,不含胆固醇,是植物蛋白中为数不多的可替代动物蛋白的品种之一。但大豆分离蛋白分子量大,生物利用度低等缺点,然而大豆肽的相对分子量更小,较容易被吸收利用,活性强,尤其是具有降血压、降低胆固醇、抗氧化、抗疲劳等独特的生理活性[2-5]。因此,大豆肽作为一种比大豆分离蛋白更佳的新型大豆深加工产品,已经在食品饮料行业、医药行业等领域显示出独特的开发前景。但目前研究主要在大豆分离蛋白酶解工艺的考察,但对大豆肽酶解液的相对分子量组分分布及降压活性片段的报道较少。本研究通过采取双酶复合酶解大豆分离蛋白,酶解液通过纳滤、超滤以获得具有较高生理活性的活性肽;采用高效液相色谱法,对大豆酶解液的相对分子量分布进行测定,将处理后活性分子量组分进行药理实验,研究其对大鼠高血压模型的影响,为大豆蛋白科学合理的应用提供理论和实验依据。
1 材料与方法
1.1材料与仪器
大豆分离蛋白 山东禹王生态食业有限公司,蛋白质含量≥90%;胰蛋白酶、菠萝蛋白酶 批号20151015、20150207,酶活力均≥2500 U/mg,国药集团化学试剂有限公司;左旋硝基精氨酸(L-NNA)、血管紧张素转换酶(ACE)标准样品 Sigma公司;托普利片 山西津华晖星制药有限公司,25 mg/片,批号:160803;相对分子质量标定物牛血清白蛋白(分子质量:66430 Da,批号:081608)、低分子肝素钠(分子质量:3700 Da,批号:160406)、人血管紧张素Ⅱ(分子质量:1045.5 Da,批号:20150420)、乙氨酰乙氨酰乙氨酸(分子质量:189.1 Da,批号:20150626) 由中国计量科学研究院提供;氯化钙、氢氧化钠、盐酸 济宁宏明化学试剂有限公司;茚三酮 济南跃阳化工有限公司;以上试剂为分析纯;水 纯水。SD大鼠 50只,体重180~200 g,雌雄各半,由济南朋悦实验动物繁育有限公司提供,批号20170220,动物合格证号:SCXK(鲁)2017-0003。
LC-2010A型高效液相色谱仪 日本岛津公司;包括紫外检测器、DAD检测器、CLASS-VP工作站;UV1100型紫外可见分光光度计 上海天美科学仪器有限公司等。
1.2实验方法
1.2.1 菠萝蛋白酶与胰蛋白酶水解大豆分离蛋白的单因素实验 大豆分离蛋白中含有一定量的膳食纤维和淀粉[6],具有较强的吸水膨胀能力,料液比过低时(1∶10 g/mL)物料变得粘稠,流动性差,难以搅拌;当料液比为1∶20 g/mL时流动性较好时,分别考察菠萝蛋白酶、胰蛋白酶的酶解时间、酶底比、酶解pH、酶解温度等因素对大豆分离蛋白水解度的影响。
1.2.1.1 酶解时间的确定 在料液比为1∶20 g/mL时,调节pH为7.0、温度为50 ℃、加入底物量3.0%蛋白酶,分别在酶解时间为1、2、3、4、5 h时进行酶解反应,初步确定菠萝蛋白酶、胰蛋白酶酶解时间。
1.2.1.2 酶与底物的比的确定 在料液比为1∶20 g/mL时,调节pH为7.0、温度为50 ℃、酶解时间为3 h,分别在酶底比为1.0%、2.0%、3.0%、4.0%、5.0%时测其水解度,初步确定菠萝蛋白酶、胰蛋白酶酶解酶底比。
1.2.1.3 酶解pH的确定 在料液比为1∶20 g/mL时,调节温度为50 ℃、加入底物量3.0%蛋白酶、酶解时间为3 h,分别测定在酶解pH为5.0、6.0、7.0、8.0、9.0时的水解度,初步确定菠萝蛋白酶、胰蛋白酶酶解玉米蛋白的最佳酶解pH。
1.2.1.4 酶解温度的确定 在料液比为1∶20 g/mL时,调节pH为7.0、加入底物量3.0%蛋白酶、酶解时间为3 h,分别在温度为35、40、45、50、55 ℃时进行酶解反应,初步确定菠萝蛋白酶、胰蛋白酶酶解温度。
1.2.2 双酶复合酶解正交实验设计 前期实验通过单因素考察及正交实验优化出菠萝蛋白酶对大豆分离蛋白的最佳酶解工艺:在料液比为1∶20 g/mL的情况下,酶解温度50 ℃,菠萝蛋白酶酶底比3.0%,酶解pH7.0条件下酶解2 h;本实验通过胰蛋白酶单因素实验确定以胰蛋白酶酶解时间、酶解温度、酶底比、酶解pH为胰蛋白酶双酶复合酶解的考察因素,采用4因素3水平实验设计,即L9(34)正交表进行实验,见表1。

表1 双酶复合酶解正交实验因素水平表Table 1 Factors and levels table of orthogonal experiment of double enzyme complex enzyme hydrolysis
1.2.3 菠萝蛋白酶、胰蛋白酶单酶及双酶(不同顺序)复合酶解对比研究 单酶酶解(菠萝蛋白酶):在料液比为1∶20 g/mL的情况下,酶解温度50 ℃,酶底比3.0%,酶解pH7.0条件酶解2 h。
单酶酶解(胰蛋白酶):在料液比为1∶20 g/mL的情况下,酶底比4.0%加入胰蛋白酶,控制温度为40 ℃、酶解pH为8.0条件下酶解4 h。
双酶酶解(先菠萝蛋白酶后胰蛋白酶):在料液比为1∶20 g/mL的情况下,酶解温度50 ℃,酶底比3.0%,酶解pH7.0条件下先用菠萝蛋白酶酶解2 h后,再以酶底比4.0%加入胰蛋白酶,温度为40 ℃、酶解pH8.0条件下酶解4 h。
双酶酶解(先胰蛋白酶后菠萝蛋白酶):在料液比为1∶20 g/mL的情况下,在酶解温度40 ℃,酶底比4.0%,酶解pH8.0时先用胰蛋白酶酶解4 h后,再以酶底比3.0%加入菠萝蛋白酶,控制温度为50 ℃、酶解pH为7.0条件下酶解2 h。
1.2.4 大豆分离蛋白水解度(DH)的测定 茚三酮法[7]蛋白质水解过程中被裂解的肽键数h(mmol/g)与蛋白质的总肽键数htot(mmol/g)之比称为水解度(the degree of hydrolysis);
DH(%)=h/htot×100
式中,h-水解后每克蛋白质被裂解的肽键毫摩尔数(mmoL/g);htot-每克原料蛋白质的肽键毫摩尔数(mmoL/g)。
1.2.5 体外降压肽对ACE抑制率的测定 前期的活性分析以其天然底物血管紧张素,采用放射色谱法、比色法或放射免疫法等方法分析,但由于该过程操作较复杂、干扰多、底物昂贵等缺点而不适合广泛应用,故采用HPLC体外检测分析不同酶解条件下制备的酶解降压肽对应的ACE抑制活性。有关步骤参照 Cushman(1971)和Toshiro(1993)改进的方法进行[8-9]。将各酶解液反应值 A与空白样品值 A(control)对照,分析所得酶解降压肽的 ACE抑制率。其计算公式为:
ACE抑制率(%)=(A-Acontrol)/A×100
1.2.6 大豆肽超滤分段实验 将预先处理后的酶解液样品进行离心操作,4500 r/min离心5 min后合并上清液,去离子水定容至3000 mL。将已处理的3000 Da超滤膜装入膜处理设备,去离子水清洗5 min后,将离心后的酶解液样品倒入样品池内,进行超滤操作[10]。参数为压力0.20 MPa,超滤时间120 min,温度35 ℃,分别收集>3000 Da样品和<3000 Da样品。将超滤处理完的<3000 Da样品进行1000 Da超滤膜实验,分别制得<1000 Da样品和1000~3000 Da样品。
1.2.7 标记物标准曲线的测定
1.2.7.1 色谱条件 色谱柱为TSKgeLG2000SWXL(7.8 mm×300 mm,平均孔径512A),流动相为0.1 mol/L NaCl+0.05% NaN3+0.1 mol/L磷酸缓冲液(pH6.7),柱温为室温(25 ℃),流速0.5 mol/min,检测波长280 nm[11]。
1.2.7.2 标准分子量对照品溶液制备 分别取牛血清白蛋白(分子量66430 Da)5 mg、低分子肝素钠(分子量3700 Da)3 mg、血管紧张素(分子量1045.5 Da)3 mg、乙氨酰乙氨酰乙氨酸(分子量189.1 Da)2 mg溶解至10 mL去离子水中,作为标准分子对照品溶液。
1.2.8 大豆肽(1000~3000 Da)体内活性测定实验
1.2.8.1 L-NNA致大鼠高血压动物模型的建立 用L-NNA对大鼠腹腔注射进行诱导,每日15 mg/kg/d,分2次腹腔注射,连续应用4周[12]。
1.2.8.2 分组及给药 将50只大鼠,分成5组,分别为模型对照组(纯水)、卡托普利组(1.0 mg/mL)、大豆肽低剂量组(0.6 g/mL)、大豆肽中剂量组(0.8 g/mL)和大豆肽高剂量组(1.0 g/mL)。模型对照组:造模后1周给2 mL/d纯净水灌胃,连续4周;卡托普利组:造模后1周给2 mL/d卡托普利液灌胃,连续4周;大豆肽三个剂量组:造模后1周按照不同浓度给予超滤后1000~3000 Da大豆肽酶解液2 mL/d,连续4周。
1.2.8.3 血压的测量 测压前将大鼠放入(37±1) ℃电热恒温箱内,加热使大鼠尾动脉充分扩张,用大鼠血压测定仪间接测大鼠尾动脉的收缩压,分别测定造模前、造模后及造模后2周、4周的血压。
1.3数据处理
2 结果与分析
2.1菠萝蛋白酶、胰蛋白酶酶解大豆分离蛋白的单因素实验
医护人员应当做好患者的饮食护理工作。对妇产科患者来说,其日常主食应当以营养为主[4],所以,护理人员应当依据患者自身的情况来确定每天的进食量,对妊娠患者在餐前和餐后对患者的血糖进行测量。一旦个别患者的血糖发现较大变化,则应当及时向主治医生汇报,立即调整饮食结构。
2.1.1 酶解时间对水解度的影响 由图1可知,随着酶解反应时间的延长,水解度呈不断增大的趋势,胰蛋白酶水解到3 h时,水解度较高,但再继续延长酶解时间,水解度变化不大;菠萝蛋白酶水解到2 h时,水解度较高,再继续延长酶解时间,水解度变化不大;菠萝蛋白酶属于巯基蛋白酶,作用位点较广泛无特异性,酶解速度快;胰蛋白酶属于丝氨酸蛋白酶,能选择性地水解蛋白质中赖氨酸或精氨酸的羧基端肽键,专一性较强,酶解时间相对较长[2],所以考虑经济效益,胰蛋白酶酶解时间3 h为宜、菠萝蛋白酶酶解时间2 h为宜。

图1 酶解时间对菠萝蛋白酶、胰蛋白酶酶解水解度的影响Fig.1 Effect of enzymolysis time on the hydrolysis degree of bromelain and trypsin
2.1.2 酶底比对水解度的影响 由图2可以看出,菠萝蛋白酶与胰蛋白酶的水解度随着酶底比的增加而增加,当菠萝蛋白酶酶底比在1.0%~3.0%范围内时,当胰蛋白酶酶底比在1.0%~3.0%范围内时,水解度增加较为明显,继续增大酶底比时,水解度的增加趋势则较为平缓。这是因为随着酶底比的增加,酶浓度增大,使蛋白质充分酶解,当酶浓度达到一定值后逐渐趋于饱和,酶解反应也随之趋于平缓;在酶解过程中酶的价格相对较高,故最佳的加酶量既能完全酶解蛋白又能够节约成本,所以菠萝蛋白酶得酶底比确定为3.0%较为合适,胰蛋白酶的酶底比为3.0%为最优。

图2 酶底比对菠萝蛋白酶、胰蛋白酶酶解水解度的影响Fig.2 Effect of Substrate Ratio on the hydrolysis degree of bromelain and trypsin
2.1.3 酶解pH对水解度的影响 由图3可以看出,胰蛋白酶在酶解pH为5.0~8.0时、菠萝蛋白酶在酶解pH为5.0~7.0时水解度随着酶解pH的增大而增大,当继续增大酶解pH时,水解度均开始减小,这是由于不同的酶酶活力的适宜pH范围不同。菠萝蛋白酶属于植物酶,胰蛋白酶是胰腺的外分泌部分泌的,在小肠里对蛋白质消化有无法替代的作用,而小肠中为碱性环境;胰蛋白酶最适酶解pH为8.0,菠萝蛋白酶最适酶解pH为7.0。

图3 酶解pH对菠萝蛋白酶、胰蛋白酶酶解水解度的影响Fig.3 Effect of enzymatic hydrolysis of pH on the hydrolysis degree of bromelain and trypsin
2.1.4 酶解温度对水解度的影响 由图4可以看出,胰蛋白酶的最适温度在(35~45) ℃范围内,当温度达到40 ℃时,模拟了人体内温度,故胰蛋白酶酶解效果最佳,当达到40 ℃后继续升高温度,水解度反而减小;菠萝蛋白酶的最适反应温度介于(45~55) ℃,达到50 ℃后继续升高温度,水解度减小,这是因为随着温度的升高,酶促反应速度加快,当高于最适反应温度后,酶活力减小,水解度也随之减小,故胰蛋白酶酶解温度确定为40 ℃,菠萝蛋白酶酶解温度确定为50 ℃为宜。

图4 酶解温度对菠萝蛋白酶、胰蛋白酶酶解水解度的影响Fig.4 Effect of enzymolysis temperature on the hydrolysis degree of bromelain and trypsin
2.2双酶复合酶解制备大豆肽工艺优化研究
2.2.1 双酶复合酶解制备大豆肽的正交实验 由表2双酶复合酶解正交实验极差分析表明,由极差R得出影响因素大小顺序为:C>B>D>A,即酶底比>酶解温度>酶解pH>酶解时间;由均值k得出最佳因素组合为 A2B2C3D2,即在在料液比1∶20 g/mL的情况下先用菠萝蛋白酶在酶解温度50 ℃,酶底比3.0%,酶解pH7.0条件下酶解2 h后,再以酶底比4.0%加入胰蛋白酶,控制温度为40 ℃、酶解pH为8.0条件下酶解4 h。

表2 双酶复合酶解正交实验结果Table 2 Results of orthogonal test of double enzyme complex enzyme hydrolysis
2.2.2 双酶复合酶解正交实验方差分析 由方差分析表3的F值可知,4种因素对实验结果的影响程度各不相同,影响程度依次为:酶底比>酶解温度>酶解pH>酶解时间。由p值可知,因素C即酶底比有显著性差异(p<0.01),这与直观考察实验结果一致。
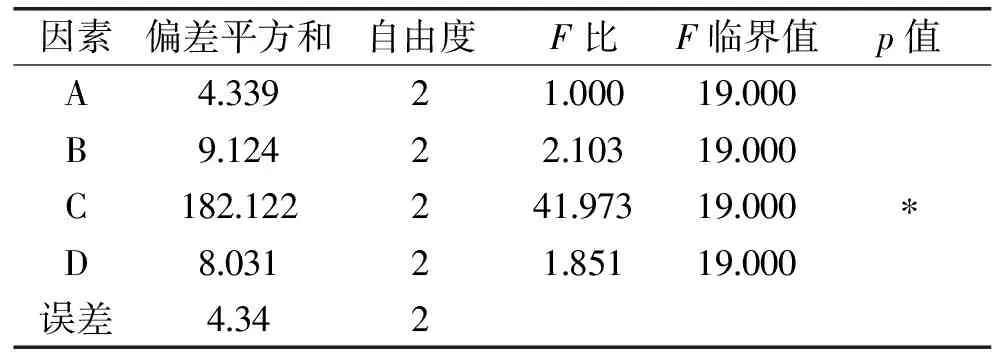
表3 正交实验方差分析表Table 3 Variance Analysis of orthogonal experiment
注:*代表p<0.05具有统计学意义。
2.2.3 验证性实验 依据最佳双酶复合酶解的条件:料液比为1∶20 g/mL的情况下,在酶解温度50 ℃,酶底比3.0%,酶解pH7.0条件下先用菠萝蛋白酶酶解2 h后,再以酶底比4.0%加入胰蛋白酶,控制温度为40 ℃、酶解pH为8.0条件下酶解4 h,大豆分离蛋白的水解度较好为35.31%。

表6 各组大鼠血压变化Table 6 The changes of blood pressure of rats(±s,n=10)
注:与模型对照组比较,*p<0.05 为有显著性差异;**p<0.01 为有极显著性差异。
2.3菠萝蛋白酶、胰蛋白酶单酶及双酶酶解对比研究
从表4可知,双酶复合酶解较单酶酶解水解度和ACE抑制率高,在双酶复合酶解中先用菠萝蛋白酶酶解在胰蛋白酶酶解最优,故本实验选择先菠萝蛋白酶酶解再胰蛋白酶酶解的双酶酶解工艺。

表4 单酶及双酶对比研究Table 4 Comparison of single and double enzyme enzyme
2.4不同分子量大豆肽百分比
在双酶复合酶解液后,通过超滤后得到不同分子量的大豆肽,从表5中可知,1000~3000 Da的分子量比重较大为67.99%,对ACE抑制率较高,从而推断出活性片段为1000~3000 Da。
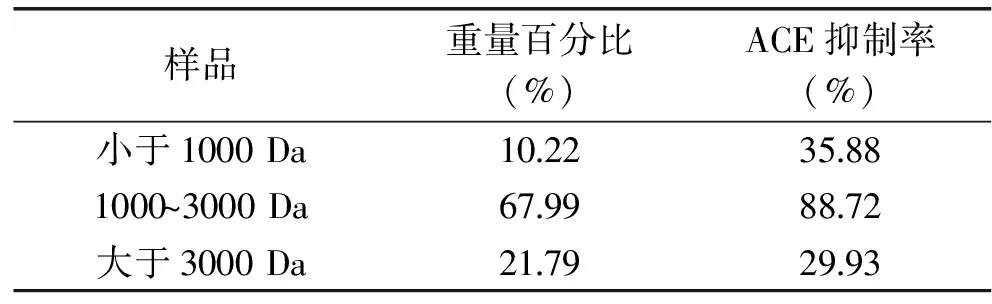
表5 不同分子量大豆肽百分比结果Table 5 The percentage of soybean peptides with different molecular weight
2.5样品分子量分布测定
取标记物溶液、大豆蛋白原液、大豆蛋白酶解液按1.2.7.1项下色谱条件进行测定,标记物溶液及各供试结果见图5~图7。
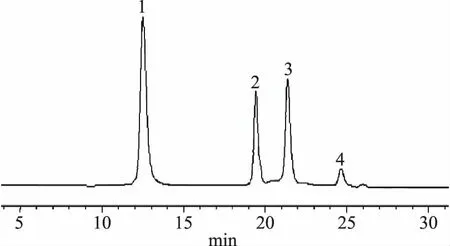
图5 对照品溶液色谱图Fig.5 Chromatogram of reference solution注:1:牛血清白蛋白,2:低分子肝素,3:血管紧张素,4:乙氨酰乙氨酰乙氨酸。

图6 大豆分离蛋白溶液色谱图Fig.6 Chromatogram of soybean protein solution
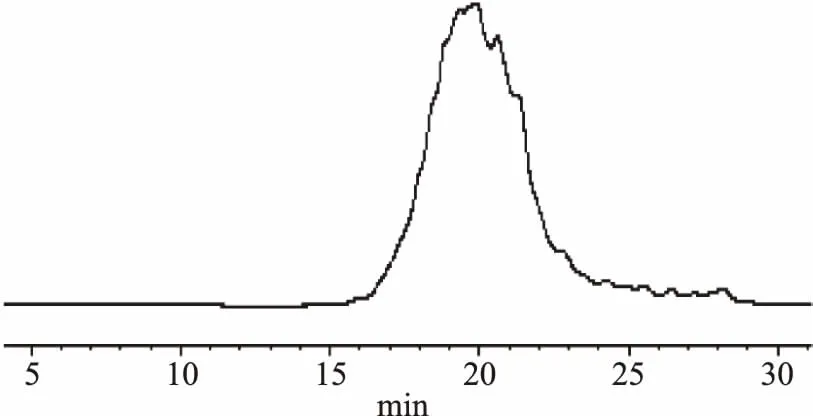
图7 大豆肽溶液色谱图Fig.7 Chromatogram of soybean peptide solution
由图5可知,以四种对照品相对分子量的对数和保留时间做曲线,得出标准曲线为Y=-4.6982X+34.91,R2=0.9993,说明线性良好;依据标准曲线,由图6、图7可知,大豆分离蛋白原液含有的蛋白质及多肽的相对分子质量主要区间在5000~1.0×105Da,在双酶复合酶解下,酶解液的蛋白质及多肽的相对分子质量主要区间在500~4000 Da;即在双酶的作用下,大豆分离蛋白的大分子蛋白质成分酶解为小分子肽类,证明双酶酶解效果明显。
2.6各组间大鼠血压变化
从表6中可以看出,造模前各组大鼠血压无显著性差异,造模后2周,模型对照组血压仍持续升高,说明 L-NNA 诱发的高血压病大鼠模型成功。与模型对照组相比,各组均有显著性差异(p<0.05),大豆肽高剂量组与卡托普利组有极显著性差异(p<0.01),即大豆肽高剂量组与卡托普利组效果相当。
3 结论
本实验前期通过单因素及正交实验法对菠萝蛋白酶的工艺参数进行了优化,在料液比1∶20 g/mL的情况下菠萝蛋白酶在酶解温度50 ℃,酶底比3.0%,酶解pH7.0条件下酶解2 h后,水解度为22.93%,对ACE抑制率较好为38.89%。对菠萝蛋白酶与胰蛋白酶单酶酶解进行对比研究可知胰蛋白酶酶解水解度稍低,但对ACE抑制率较好,在双酶酶解过程中,先使用菠萝蛋白酶酶解使大豆分离蛋白水解成适当片段,胰蛋白酶作为人体重要的消化酶,在通过半仿生酶解不同切位点生成具有适宜片段的肽,从而提高对ACE的抑制率,然而胰蛋白酶酶解大豆分离蛋白的有效切位点还需要研究。从分子量分布图谱可知双酶酶解后的大豆肽分子量明显降低,将超滤处理后的1000~3000 Da活性片段,通过体内药理实验可得大豆肽与卡托普利组效果相当,但大豆肽的活性片段氨基酸的组成还需进一步考察测定。
[1]刘大川. 中国大豆蛋白工业现状及发展趋势[A]. 中国粮油学会.中国粮油学会第二届学术年会论文选集(综合卷)[C].中国粮油学会,2002:4.
[2]张晓梅.降血压和降胆固醇大豆肽的分离纯化[D].无锡:江南大学,2006.
[3]王莉娟,陶文沂.大豆肽体外抗氧化活性研究[J].生物加工过程,2008(4):69-73.
[4]陈园园.大豆肽的酶解制备与抗疲劳、抗氧化功能研究[D].无锡:江南大学,2008.
[5]高绿莎.大豆肽缓解体力疲劳活性研究与产品研制[D]. 长春:吉林大学,2015.
[6]李婷,赵沙沙,阮奇珺,等.碱性蛋白酶和木瓜蛋白酶对热变性大豆分离蛋白的酶解研究[J].中国油脂,2014(4):35-38.
[7]檀志芬,生庆海,邱泉若. 蛋白质水解度的测定方法[J]. 食品工业科技,2005(7):174-175,178.
[8]Cushman DW,Matsui T. Spectrophotometric assay and proper ties of the angiotensin-converting enzyme of rabbitlung[J].Bi Pharm,1971,20:1673-1675.
[9]Toshiro,Ondetti M.Inhibitionofangiotensin-convertingenzyme by Bacilluslicheni for misalkaline protease hydrolyzates derived from sardine muscle[J].Biosci Biotech Biochem,1993,67:921-924.
[10]陈山,杨晓泉,郭祀远,蔡妙颜.大豆肽超滤分离纯化过程的研究[J].食品与发酵工业,2003(1):49-52.
[11]陈星,李晓磊,吴琼.不同蛋白酶酶解产物活性大豆肽分子量分布状态的研究[J].西南大学学报(自然科学版),2010(7):1-7.
[12]韩学杰,张立石,王克林,等.降血压食品功能因子对造模性高血压大鼠功效的研究[J]. 中国中医基础医学杂志,2003(11):24-27.
