体外评估十株乳杆菌对免疫细胞活性的影响
2018-01-22,,
, ,
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
乳酸菌是一种能够发酵糖类产生大量乳酸的细菌的统称[1],是人体肠道中最重要的益生菌,它们对维持人体肠道环境的微生态平衡和提高机体免疫力起着关键作用[2-5]。乳酸菌表面存在肽聚糖、脂磷壁酸、表层蛋白和其他细胞壁相关多糖[6-7],另外,乳酸菌可以向胞外分泌具有免疫调节作用的物质,如胞外多糖和分泌蛋白。这些表面成分可以参与免疫调节或直接引起免疫应答[8-10]。因此,通过实验筛选出具有较高免疫活性的乳酸菌,能够为开发新的微生物资源提供理论支撑。
采用动物实验的方法可以筛选出具有免疫活性的乳酸菌[11-12],但因其周期较长、耗费较大,实际运用效率不高。而细胞模型能够弥补动物模型的上述不足,可以较快筛选出具有功能性成分的乳酸菌。免疫细胞是机体免疫系统的重要组成部分,是机体发挥免疫调节作用的主要来源,细胞免疫功能主要是通过免疫细胞本身及其分泌出的细胞因子和抗体来完成的[13]。脾淋巴细胞和巨噬细胞是机体主要的免疫细胞,脾淋巴细胞增殖活性的高低在评价细胞免疫功能强弱中具有重要意义[14],巨噬细胞在机体非特异性和特异性免疫功能中扮演着重要角色,具有吞噬、杀伤、递呈抗原,分泌生物活性物质以及抑制肿瘤等多种功能[15-18]。因此通过研究乳酸菌与脾淋巴细胞、乳酸菌与巨噬细胞的体外相互作用,可以筛选出具备较高免疫活性的乳酸菌。
本实验从脾淋巴细胞体外增殖、巨噬细胞吞噬中性红能力和巨噬细胞能量代谢水平三方面来评价十株乳酸菌对免疫细胞功能和代谢的影响,以获得具有良好调节免疫细胞活性的乳杆菌,为研究益生菌调节免疫机制提供理论依据。
1 材料与方法
1.1材料与仪器
鼠李糖乳杆菌(KLDS 1.0205、KLDS 1.0911、KLDS 1.0912)、植物乳杆菌(KLDS 1.0386、KLDS 1.0344、KLDS 1.0317、KLDS 1.0318)、嗜酸乳杆菌(KLDS 1.1003)、瑞士乳杆菌(KLDS 1.0903)、副干酪乳杆菌(KLDS 1.0351) 均由东北农业大学乳品科学教育部重点实验室从内蒙古传统乳制品中分离纯化并保藏;BALB/c小鼠,雌性,清洁级,6~8周龄 北京维通利华实验动物技术有限公司;鼠房保持饲养环境温度(23±2) ℃,每天人工灯光照明12 h,标准小鼠饲料喂养,自由饮用蒸馏水;Man-Rogosa-Sharp(MRS)培养基。具体配制方法参照文献[19];RPMI-1640培养液 美国Hyclone公司;胎牛血清 Vitrocell公司;刀豆蛋白(ConA)、台盼蓝染色液、中性红染色液、红细胞裂解液、Hank’s液 Solarbio公司;CCK-8 日本同仁化学研究所;蛋白胨、酵母粉、牛肉膏、葡萄糖等均为生化分析纯。
DHP-9272型电热恒温培养箱 上海一恒科技有限公司;LDZF-50KB-II立式压力蒸汽灭菌器 上海申安医疗器械厂;HF90型CO2培养箱 香港力康发展有限公司;Model 680型酶标仪 美国Beckman公司;PL2002型及AL104型电子天平 梅特勒-托利多仪器(上海)有限公司;20~200、100~1000 μL可调定量移液枪 德国Eppendorf公司;96孔培养板 美国NEST公司;AE-30倒置生物显微镜 麦克奥迪实业集团有限公司;VD-1320型洁净工作台 北京东联哈尔仪器制造有限公司;LD4-2型低速离心机 北京医用离心机厂。
1.2实验方法
1.2.1 菌悬液的制备 将实验菌株以2%的接种量接种至MRS培养基中,37 ℃培养至生长稳定期(16 h),将菌液在4 ℃条件下3000 r/min离心10 min后,用无菌0.01 mol/L、pH7.4的PBS重悬菌沉淀,重复两次,弃去上清液,用含10%胎牛血清的RPMI-1640完全培养液重悬菌沉淀,调整各菌株的菌悬液浓度为108CFU/mL,4 ℃冷藏备用[20]。
1.2.2 小鼠脾淋巴细胞的制备 固定小鼠,摘眼球放血,颈椎脱臼处死小鼠后,将其放入盛有75%乙醇的烧杯中浸泡3~5 min,在超净台上沿腹腔中线剪开小鼠胸腔,无菌取出脾脏,将其置于200目不锈钢网筛,网筛中央浸没于盛有Hank’s液的平皿中,用无菌注射器芯研磨脾脏组织,用Hank’s液把网上剩余组织吹洗掉,收集脾脏组织悬液于无菌离心管中,1000 r/min离心5 min,弃去上清液,加入2~3 mL红细胞裂解液到洗过的细胞中,混匀后静置2~3 min,待红细胞完全破碎,再以1000 r/min离心5 min后弃上清液,以除去血红细胞,再用RPMI-1640不完全培养基离心洗涤细胞2次。收集细胞,含10%胎牛血清的RPMI-1640完全培养基重悬细胞,细胞悬液用台盼蓝染色后,血球计数板计数,确保活细胞比例不小于95%,计数后用含10%胎牛血清的RPMI-1640完全培养基调整脾细胞浓度为1×106个/mL备用[21]。
1.2.3 乳酸菌体外对脾淋巴细胞增殖的影响 在无菌96孔细胞培养板中,设空白调零组(只加培养液200 μL/孔)、阴性对照组(终浓度为1×106个/mL的淋巴细胞悬液180 μL/孔,20 μL培养液/孔)、阳性对照组(淋巴细胞悬液180 μL/孔和20 μL/孔终浓度为5 μg/mL的ConA)、乳酸菌对照组(培养液180 μL/孔和20 μL/孔终浓度为107CFU/mL以及108CFU/mL的待测菌悬液)、实验组(加淋巴细胞悬液180 μL/孔,20 μL/孔终浓度为107CFU/mL和108CFU/mL待测菌悬液,即使不同乳酸菌与细胞以10∶1、100∶1比例共同培养)[22-23]。所有实验均重复3次。加样混匀后,置于37 ℃、5% CO2细胞培养箱中连续培养48 h后,加入新鲜配制成CCK-8溶液20 μL/孔,继续培养4 h,振荡混匀,然后用酶标仪在450 nm波长处测定光密度值,根据下列公式计算脾淋巴细胞转化值和脾淋巴细胞增殖指数(PI)。
脾淋巴细胞转化值=OD1-OD2
式(1)
式中:OD1为实验组OD值;OD2为阴性对照组OD值。
式(2)
式中:OD1为实验组OD值;OD2为阳性对照组OD值;OD3为乳酸菌OD值;PI>1时提示促进增殖;PI<1时提示抑制增殖。
1.2.4 腹腔巨噬细胞吞噬能力测定 腹腔巨噬细胞的制备[24-25]:小鼠眼球放血,颈椎脱白处死后,置于75%乙醇溶液中浸泡5 min以消毒皮肤,暴露出腹膜壁,酒精擦洗腹部后,用无菌注射器抽10 mL Hank’s液,注入腹腔中,轻柔敲打2 min,使腹腔巨噬细胞尽可能多地悬浮在液体中;另取一支注射器抽出腹腔悬液,收集于无菌离心管中,1000 r/min离心5 min,弃上清液;用RPMI-1640完全培养液吹打细胞使其成为单细胞悬液,血球计数板计数,确保活细胞比例不小于95%,调整细胞浓度为1×106个/mL用于实验。
巨噬细胞吞噬中性红能力测定[20]:将巨噬细胞接种于96孔板(100 μL/孔),细胞在37 ℃、5% CO2培养箱中培养4 h,弃去上清液,贴壁细胞即为巨噬细胞。在每孔重新加入含10%血清的RPMI-1640培养液和终浓度分别为107CFU/mL和108CFU/mL的菌悬液各100 μL,使不同乳酸菌与细胞以10∶1、100∶1比例共同孵育,对照组加等体积的无菌水。细胞在37 ℃、5% CO2培养箱中培养24 h,弃去上清液,加入0.1%中性红染色液100 μL/孔,继续培养30 min,弃去中性红染色液,用PBS清洗3次以除去未被吞噬的中性红溶液,之后加入200 μL/孔细胞裂解液(冰醋酸∶无水乙醇=1∶1,v/v),继续培养2 h,振荡混匀,用酶标仪在540 nm处测定吸光值。
1.2.5 腹腔巨噬细胞能量代谢水平的测定 将巨噬细胞接种于96孔板(100 μL/孔),细胞在37 ℃、5% CO2培养箱中培养4 h,弃去上清液,贴壁细胞即为巨噬细胞。在每孔重新加入含10%的血清RPMI-1640培养液100 μL,再加入100 μL含不同乳酸菌的菌悬液RPMI-1640完全培养液,使菌悬液终浓度分别为107~108CFU/mL。细胞在37 ℃、5% CO2培养箱中培养24 h,加入20 μL/孔CCK-8溶液,继续培养4 h,振荡混匀;然后在酶标仪上450 nm处测定各孔吸光值。结果以OD 值表示腹腔巨噬细胞能量代谢水平[24]。
1.3数据统计
所有实验均进行3次重复实验,采用Excel 2007软件处理实验数据及制图,并用统计软件包SPSS 22对实验结果进行显著性分析。
2 结果与分析
2.1十株乳杆菌对小鼠脾淋巴细胞增殖的影响
2.1.1 十株乳杆菌对小鼠脾淋巴细胞转化值的影响 当乳杆菌与细胞比例为1∶1时,乳杆菌的免疫效果较弱[22],所以本实验将各乳杆菌与小鼠脾细胞的比例设置为10∶1和100∶1。
淋巴细胞转化值的高低可以直接反应淋巴细胞活性的强弱,因此淋巴细胞转化值可以作为测定T淋巴细胞免疫功能的关键指标之一[23]。由图1可知,随着乳杆菌活菌数的增加,脾淋巴细胞的转化值也随之增大,表明十株乳杆菌对脾细胞的增殖具有剂量依赖性。乳杆菌与脾细胞的比例为10∶1和100∶1时,淋巴细胞转化值均高于阳性对照组且差异显著(p<0.05)。组内比较结果表明,当乳杆菌活菌数与细胞的比例为10∶1时,植物乳杆菌KLDS 1.0344和KLDS 1.0318的增殖效果显著高于其他菌株(p<0.05),当乳杆菌活菌数与细胞的比例为100∶1时,各组淋巴细胞转化值均有所增加,但以植物乳杆菌KLDS 1.0318的增殖效果最好。

图1 十株乳杆菌对小鼠脾淋巴细胞转化值的影响Fig.1 Effect of ten lactobacillus strains on the transformation of spleen lymphocytes in mice注:不同小写字母代表各菌株差异性不同(p<0.05),字母相同代表无差异(p>0.05),图2~图4同。

图2 十株乳杆菌对脾淋巴细胞增殖指数(PI)的影响Fig.2 Effect of ten lactobacillus strains on proliferation index(PI)of spleen lymphocytes
2.1.2 十株乳杆菌对小鼠脾淋巴细胞增殖指数的影响 由图2中数据可以看出:当各乳杆菌与脾细胞以100∶1的比例共同孵育时,除鼠李糖乳杆菌KLDS 1.0912和副干酪乳杆菌KLDS 1.0351外,其它乳杆菌的增殖指数均大于1,即能直接促使脾淋巴细胞的增殖,从而可以提高机体脾淋巴细胞的免疫应答能力。当不同乳杆菌与脾细胞的比例为10∶1时,除了植物乳杆菌KLDS 1.0318外,其它菌株的PI值均小于1,说明植物乳杆菌KLDS 1.0318具有更好提高脾淋巴细胞增殖的能力。
2.2十株乳杆菌对小鼠腹腔巨噬细胞吞噬中性红能力的影响
本研究采用巨噬细胞吞噬中性红的方法,评估十株乳杆菌对巨噬细胞吞噬作用的影响,结果如图3所示。由图中数据可以看出:当乳杆菌活菌数与细胞的比例为10∶1时,十株乳杆菌均可以明显提高巨噬细胞的吞噬作用(p<0.05)。当乳杆菌活菌数与细胞以100∶1的比例共同孵育时,巨噬细胞的吞噬作用比10∶1时增强,且植物乳杆菌KLDS 1.0318对于巨噬细胞吞噬中心红能力的诱导作用最强,说明该菌株能够增强巨噬细胞吞噬活性,从而可以参与到机体非特异性免疫反应当中。
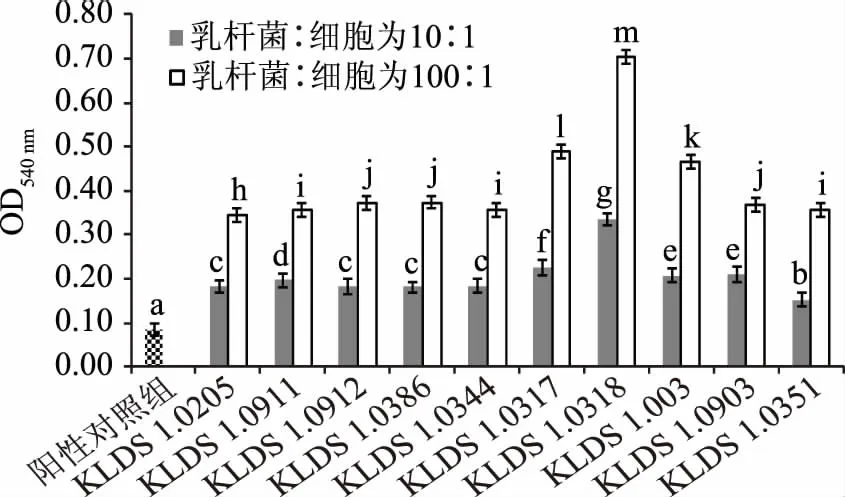
图3 十株乳杆菌对小鼠腹腔巨噬细胞吞噬中性红能力的影响Fig.3 Effect of ten lactobacillus strains on phagocytosis of neutral red in abdominal macrophages of mice

图4 十株乳杆菌对小鼠腹腔巨噬细胞能量代谢水平的影响Fig.4 Effect of ten lactobacillus strains on energy metabolism of abdominal macrophages in mice
2.3十株乳杆菌对小鼠腹腔巨噬细胞能量代谢水平的影响
由图4数据结果表明,相较于空白组,十株乳杆菌的两个剂量组对小鼠腹腔巨噬细胞能量代谢水平均有不同程度的提高,且差异显著(p<0.05)。当乳杆菌活菌数与细胞的比例为10∶1时,植物乳杆菌KLDS 1.0318对小鼠腹腔巨噬细胞能量代谢水平的影响最明显。当乳杆菌活菌数与细胞的比例为100∶1时,各组巨噬细胞能量代谢水平随活菌数的增加均有不同程度的增加。
3 讨论
3.1乳酸菌对免疫细胞活性的影响
因为动物实验周期长、耗费大,所以采用动物实验筛选具有免疫活性的乳酸菌效率不高[12]。免疫细胞是参与免疫应答或与免疫应答相关的细胞,包括淋巴细胞和单核巨噬细胞等。根据淋巴细胞的发育部位、表面、抗原、受体及功能等不同,可将淋巴细胞分为T淋巴细胞、B淋巴细胞、自然杀伤细胞(NK细胞)和杀伤细胞(K细胞)。脾脏是T淋巴细胞定居繁殖、接受抗原激活,产生效应细胞行使免疫功能的重要场所[24]。T淋巴细胞参与细胞免疫包括直接与靶细胞特异性结合破坏细胞膜杀伤靶细胞和释放淋巴因子使免疫效应扩大两种方式,淋巴细胞增殖实验是检测淋巴细胞免疫反应的有效方法之一[27-28]。王婷婷等[29]研究了三株乳杆菌对小鼠脾淋巴细胞增殖的影响,结果表明瑞士乳杆菌KLDS 1.8701对脾淋巴细胞的增殖效果最好。本实验利用CCK-8法测定乳杆菌对T淋巴细胞增殖活性的影响,结果表明,十株乳杆菌均可以不同程度提高T淋巴细胞的增殖转化能力,其中植物乳杆菌KLDS 1.0318对脾淋巴的调节活性最高,说明了乳杆菌可以改变T淋巴细胞活性,诱导其增殖和分化,从而增强机体免疫功能。单核吞噬细胞包括分散在全身各器官组织中的巨噬细胞、单核细胞及幼稚单核细胞。单核细胞由骨髓中的单核细胞前体发育分化而成,在血液中停留12~24 h,然后进入结缔组织发育成熟为巨噬细胞。巨噬细胞表面有较多的MHCII类分子,MHCII类分子可以反应细胞外部情况,如果组织中有细菌侵入,巨噬细胞进行吞食后,通过MHC提示把细菌碎片给辅助T细胞,启动机体免疫反应。巨噬细胞表面还有MHCI类分子,MHCI类分子可以提供细胞内状况,当细胞遭受病毒感染,病毒外膜碎片的氨基酸链透过MHC提示,可以提供杀手CD8+T细胞等辨识,以进行扑杀[30]。通常情况下,巨噬细胞处于休眠状态,吞噬作用不强。但巨噬细胞被免疫增强剂激活后,可以抑制肿瘤细胞的生长、增强吞噬作用和胞饮作用[31]。有研究表明巨噬细胞参与机体先天免疫反应,它和中性粒细胞作为宿主防御的第一道防线,在宿主防止微生物入侵中发挥重要作用[32]。本研究通过巨噬细胞吞噬中性红实验得出十株乳杆菌均可以明显提高巨噬细胞的吞噬能力。此外,本研究还利用CCK-8法测定乳杆菌对巨噬细胞能量代谢水平的影响,结果显示十株乳杆菌均可以不同程度刺激小鼠腹腔巨噬细胞能量代谢水平的提高,其中植物乳杆菌KLDS 1.0318对于提高巨噬细胞吞噬活性显著高于其余菌株。
3.2乳酸菌剂量的选择
调节免疫活性需要的乳酸菌浓度一直备受关注。李艾黎[22]等将乳杆菌的剂量调整至高、中、低三个浓度,发现不论是活性乳杆菌还是热致死乳杆菌,其对小鼠脾脏细胞的增殖作用都随菌浓度的增加而提高,表现出剂量依赖性。活性和热致死乳杆菌剂量为107CFU/mL(即细菌与细胞的比例为10∶1)的效果最为明显(p<0.05),且活菌制剂的免疫调节作用优于热致死菌体(p<0.05)。而本实验将细菌与细胞的比例提高到了100∶1,结果表明了在此条件下,十株乳杆菌对脾淋巴细胞增殖活性作用和对巨噬细胞吞噬作用以及对巨噬细胞能量代谢水平的影响相较于细菌与细胞的比例为10∶1条件下能够更好表现出菌株差异性,但具体的有效剂量可能会因为多种因素的影响而存在较大差异,包括菌种差异、菌的活性、个体差异、生理特性、其他膳食因素等,因此尚待进一步的研究。
3.3乳酸菌免疫调节活性成分
乳酸菌表面有肽聚糖、胞壁磷壁酸、脂磷壁酸、表层蛋白以及细胞壁相关多糖。此外,乳酸菌还可以向细胞外分泌一些具有免疫调节活性的物质,如胞外多糖和其他分泌蛋白[33]。这些表面成分参与免疫调节或直接引起免疫应答,因而构成了乳杆菌发挥益生功效的物质基础。多糖类的成分可以激活巨噬细胞,增强其吞噬功能,分泌细胞因子,帮助机体抵抗病原菌与病毒的感染[34]。另外,乳酸菌的免疫调节活性具有一定的菌株特异性。Kimoto等[35]研究了16株乳酸乳球菌的免疫调节活性,其中有6株球菌能诱导细胞产生IL-12、IL-6和TNF-α。RYU等[36]认为革兰氏阳性菌免疫刺激作用强弱的差别在于其细胞壁上的脂磷壁酸结构不同,因此造成了对TOLL样受体的激活能力有差异。也有人认为是乳酸菌细胞壁表面其他成分,如疏水性、表层蛋白、胞外多糖等对免疫调节发挥着关键作用[37]。本研究以完整菌体与免疫细胞共同孵育,结果显示在细菌与细胞的比例为100∶1条件下,十株乳杆菌对小鼠脾淋巴细胞的增殖具有不同程度的促进作用,同时增强了巨噬细胞吞噬活性及其能量代谢水平,其中植物乳杆菌KLDS 1.0318的免疫调节活性最高,说明该菌具有调节动物机体免疫功能的潜力。但具体的有效成分及其对免疫细胞因子的影响还有待研究。
4 结论
十株乳杆菌均可以在不同程度上诱导小鼠脾淋巴细胞体外增殖,其中植物乳杆菌KLDS 1.0318对脾淋巴细胞的调节活性较高,在乳杆菌活菌数为107CFU/mL和108CFU/mL时,其增殖指数均大于1,显著高于其余菌株,表现出更强的刺激增殖作用。十株乳杆菌均可在一定程度上提高巨噬细胞活性,当乳杆菌活菌数为108CFU/mL时,十株乳杆菌诱导巨噬细胞吞噬中性红能力与空白对照组有显著性差异(p<0.05),表明它们能够显著提高巨噬细胞吞噬能力。当乳杆菌活菌数为107CFU/mL和108CFU/mL时,相较于空白对照组,十株乳杆菌均可以刺激小鼠腹腔巨噬细胞能量代谢水平的提高,且差异显著(p<0.05)。其中植物乳杆菌KLDS 1.0318表现出了较强的调节巨噬细胞活性的能力。
[1]杨洁彬,郭兴华.乳酸菌:生物学基础及应用[M].北京:中国轻工业出版社,1999.
[2]Salva S,Villena J,Alvarez S. Immunomodulatory activity ofLactobacillusrhamnosus strains isolated from goat milk:impact on intestinal and respiratory infections[J]. International journal of food microbiology,2010,141(1):82-89.
[3]Tsai Y T,Cheng P C,Pan T M. The immunomodulatory effects of Lactic acid bacteria for improving immune functions and benefits[J]. Applied microbiology and biotechnology,2012,96(4):853-862.
[4]Seth A,Yan F,Polk D B,et al. Probiotics ameliorate the hydrogen peroxide-induced epithelial barrier disruption by a PKC-and MAP kinase-dependent mechanism[J]. American Journal of Physiology Gastrointestinal & Liver Physiology,2008,294(4):G1060-G1069.
[5]Repa A,Grangette C,Daniel C R,et al. Mucosal co-application of lactic acid bacteria and allergen induces counter-regulatory immune responses in a murine model of birch pollen allergy[J]. Vaccine,2003,22(1):87-95.
[6]Candela M,Maccaferri S,Turroni S,et al. Functional intestinal microbiome,new frontiers in prebiotic design[J]. International Journal of Food Microbiology,2010,140(2):93-101.
[7]Chiu Y H,Tsai J J,Lin S L,et al. Characterisation of bifidobacteria with immunomodulatory properties isolated from human breast milk[J]. Journal of Functional Foods,2014,7(2):700-708.
[8]杨会玲,高玉鹏,周利勇,等. 合生素对肉仔鸡肠道微生物区系的影响[J]. 中国农业科学,2011,44(23):4882-4891.
[9]Ren D,Li C,Qin Y,et al. Evaluation of immunomodulatory activity of two potential probioticLactobacillus,strains by invivo,tests[J]. Anaerobe,2015,35(Pt B):22-7.
[10]Hidalgocantabrana C,Nikolic M,López P,et al. Exopolysaccharide-producing Bifidobacterium animalis subsp lactis strains and their polymers elicit different responses on immune cells from blood and gut associated lymphoid tissue[J]. Anaerobe,2014,26(4):24-30.
[11]托娅,苏雅勒玛,张和平. 乳杆菌Lb.casei.Zhang对小鼠血清中细胞因子水平的影响[J]. 食品科学,2007,28(8):537-542.
[12]秦顺义,黄克和,高建忠. 富硒益生菌对小鼠免疫功能及抗氧化能力的影响[J]. 营养学报,2006,28(5):423-426.
[13]芦春斌,张伟,刘标. 抗草甘麟转基因大豆饲料对雄性小鼠脾淋己细胞体外増殖的影响[J]. 大豆科学,2012,31(1):291-294.
[14]刘东方. 人源乳酸菌筛选及其对小鼠免疫调节作用的研究[D].扬州:扬州大学,2016.
[15]Abbas A K,Lichtman A H,pillai. Cellular and molecular immunology[M]. Peking University Medica,2004.
[16]Chieppa M,Bianchi G,Doni A,et al. Cross-linking of the mannose receptor on monocyte-derived dendritic cells activates an anti-inflammatory immunosuppressive program[J]. Journal of Immunology,2003,171(9):4552-4560.
[17]Fraser I P,Koziel H,Ezekowitz R A. The serum mannose-binding protein and the macrophage mannose receptor are pattern recognition molecules that link innate and adaptive immunity[J]. Seminars in Immunology,1998,10(5):363-372.
[18]徐军发,黄迪南,吕世静,等. 酵母多糖对体外培养小鼠腹腔巨隨细胞免疫功能的増强作用[J]. 广东医学院学报,2003,21(3):199-200.
[19]Messaoudi S,Madi A,Prevost H,et al.Invitroevaluation of the probiotic potential of Lactobacillus salivarius SMXD51[J]. Anaerobe,2012,18(6):584-589.
[20]Fujiwara D,Inoue S,Wakabayashi H,et al. The anti-allergic effects of lactic acid bacteria are strain dependent and mediated by effects on both Th1/Th2 cytokine expression and balance[J]. International Archives of Allergy & Immunology,2004,135(3):205-215.
[21]Yuan H,Song J,Li X,et al. Immunomodulation and antitumor activity of kappa-carrageenan oligosaccharides[J]. Cancer Letters,2006,243(2):228-234.
[22]李艾黎,马冬雪,孟祥晨,等. 乳杆菌对小鼠脾脏淋巴细胞增殖的影响[J]. 食品科学,2010,31(15):253-256.
[23]Jang S E,Joh E H,Ahn Y T,et al. Lactobacillus casei HY7213 ameliorates cyclophosphamide-induced immunosuppression in mice by activating NK,cytotoxic T cells and macrophages[J]. Immunopharmacol Immunotoxicol,2013,35(3):396-402.
[24]李敬双,刘英姿,唐雨顺,等. 苜蓿多糖对小鼠淋巴细胞增殖和NK细胞活性影响的研究[J]. 中国农学通报,2012,28(32):89-93.
[25]Joh E H,Lee I A,Jung I H,et al. Ginsenoside Rb1 and its metabolite compound K inhibit IRAK-1 activation-the key step of inflammation[J]. Biochemical Pharmacology,2011,82(3):278-286.
[26]Wei J,Wang S,Liu G,et al. Polysaccharides from Enteromorpha prolifera enhance the immunity of normal mice[J]. International Journal of Biological Macromolecules,2014,64(2):1-5.
[27]Gupta A,Khajuria A,Singh J,et al. Immunomodulatory activity of biopolymeric fraction RLJ-NE-205 from Picrorhiza kurroa[J]. International Immunopharmacology,2006,6(10):1543-1549.
[28]Manosroi A,Saraphanchotiwitthaya A,Manosroi J.Invitroimmunomodulatory effect of Pouteria cambodiana(Pierre ex Dubard)Baehni extract[J]. Journal of Ethnopharmacology,2005,101(3):90-94.
[29]王婷婷,范文广,白雪,等. 瑞士乳杆菌和嗜酸乳杆菌的益生免疫特性的研究[J]. 食品工业科技,2013,34(20):185-189.
30]林丽华,郑雅,钟文平,等.玉屏风散对鸡脾脏淋巴细胞体外增殖的影响[J]. 福建畜牧兽医,2009,31(4):1-2.
[31]Fishman M,Gunther G. Induction of tumor cell resistance to macrophage-mediated lysis by preexposure to non-activated macrophages[J]. Cellular Immunology,1986,99(1):241-256.
[32]Belardelli F. Role of interferons and other cytokines in the regulation of the immune response[J]. Apmis,2010,103 Suppl 49:161-179.
[33]Lebeer S,Vanderleyden J,Keersmaecker S C J D. Host interactions of probiotic bacterial surface molecules:comparison with commensals and pathogens[J]. Nature Reviews Microbiology,2010,8(3):171-84.
[34]任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D]. 吉林:吉林大学,2013.
[35]Kimoto H,Mizumachi K,Okamoto T,et al. New Lactococcus strain with immunomodulatory activity:enhancement of Th1-type immune response[J]. Microbiology & Immunology,2004,48(2):75-82.
[36]Ryu Y H,Baik J E,Yang J S,et al. Differential immunostimulatory effects of Gram-positive bacteria due to their lipoteichoic acids[J]. International Immunopharmacology,2009,9(1):127-33.
[37]Kotzamanidis C,Kourelis A,Litopoulou-Tzanetaki E,et al. Evaluation of adhesion capacity,cell surface traits and immunomodulatory activity of presumptive probioticLactobacillusstrains[J]. International Journal of Food Microbiology,2010,140(2-3):154.
