豆浆中挥发性成分顶空固相微萃取条件的优化
2018-01-22,,*,,,,*
,,*,,,,*
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2.东北农业大学大豆生物学重点实验室,黑龙江哈尔滨 150030)
风味是食品的重要属性之一,是评价食品质量的重要因素,也是消费者选择购买的依据。豆浆的风味特征是由多种挥发性物质共同作用的结果,但豆浆的豆腥味限制了它的应用市场,豆浆的豆腥味与其化学组成,尤其是挥发性成分有关[1-2]。因此分析检测豆浆中的挥发性成分,对于揭示豆浆豆腥味形成机理具有重要意义。
豆浆的风味体系十分复杂,研究发现豆浆中存在至少60余种挥发性风味物质,并将其按化学结构分类为醛类、酮类、醇类、烷烃类、呋喃类、酸类、酯类及其它[3-6]。Yan 等[7]采用DHS结合GC-O 方法,对豆浆的挥发性成分进行定性和定量分析,研究发现豆浆中的挥发性成分主要有己醛、1-辛烯-3-醇、反式-2-己烯醛、反式-2-辛烯醛、己醇、戊醇、壬醛、甲苯、反式-2-壬烯醛、反,反-2,4-癸二烯醛等。李景妍等人[8]研究发现豆浆挥发性成分含量约为7 mg/L,虽然含量极少,但对豆浆的质量却有极大影响,决定着豆浆的香气和口味。这些组分的多少、相互之间的量比关系,是构成高品质豆浆的关键成分。因而,评价豆浆的质量,必须从剖析豆浆微量的风味成分入手。顶空固相微萃取(HS-SPME)是近二十年来风味分析领域中最受欢迎的预处理技术,常结合气相色谱质谱联用(GC-MS)技术广泛应用于牛乳、肉制品、水果、咖啡和酒等的风味分析,具有灵敏度高、操作简单、成品较低等优点[9]。固相微萃取分析挥发性成分受纤维涂料、离子强度、搅拌速度、萃取温度和萃取时间等因素的影响。因此,利用固相微萃取豆浆分析其挥发性成分,需要优化萃取操作的条件,而目前关于豆浆中挥发性成分顶空固相微萃取条件的优化尚未见报道。
本研究采用顶空固相微萃取与气相色谱质谱联用技术结合的方法来研究采用生浆工艺制备的豆浆中挥发性成分。采用不同的萃取头、萃取温度、萃取时间、搅拌速度和解析时间对豆浆挥发性成分进行萃取,经过GC-MS检测,并比较不同条件的萃取效果,确定最优萃取条件,使得GC-MS分析检测获得的信息更全面,化合物在质谱中的响应强度更高,建立HS/SPME-GC/MS 分析方法,为进一步检测豆浆风味物质提供技术支持。
1 材料与方法
1.1材料与仪器
东农42(收获3个月) 东北农业大学大豆研究所;NaCl(纯度99.5%) 天津化学试剂一厂。
DM-Z100A自分渣磨浆机 沧州昌鸿磨浆机械有限公司;固相微萃取搅拌加热装置及萃取头 美国Supelco公司;6890/5975B气相色谱-质谱联用仪 美国Agilent公司。
1.2实验方法
1.2.1 样品制备 准确称取一定质量的东农42,自来水洗涤3次除去沙粒等杂物,蒸馏水洗2次,按料水比1∶3 (W/V,W大豆干质量)浸泡12 h,除去多余水分,以1∶7的比例用磨浆机磨浆,80目滤网过滤取浆,95 ℃加热5 min,得豆浆[10]。为减少样品造成的研究差异,同一批研究处理所用豆浆为同次制备。
1.2.2 顶空固相微萃取流程 12 mL的样品瓶中加入5 mL样品、NaCl和磁力转子后,用密封垫迅速密封样品瓶,置于磁力搅拌加热台上,将老化后的固相微萃取针插入样品瓶,边搅拌边顶空吸附,首次使用前,萃取头于250 ℃老化至无杂峰[11-12]。
1.2.3 实验条件的确定 实验对顶空固相微萃取的NaCl、搅拌速度、萃取温度、萃取时间和解析时间进行研究。
1.2.3.1 萃取头的确定 本文分别对PDMS-100 μm、PA-85 μm、PDMS/CAR-75 μm和DVB/CAR/PDMS-50/30 μm四种市售纤维的吸附效果进行比较,在NaCl质量浓度0.1 g/mL,搅拌速度600 r/min,萃取温度40 ℃,萃取时间30 min和解析时间9 min的条件下,对比分析萃取头对萃取效果的影响。
1.2.3.2 NaCl质量浓度的确定 5 mL豆浆样品中分别加入0.0、0.5、1.0、1.5、2.0 g NaCl后,置于固相微萃取平台上,搅拌速度600 r/min,萃取温度40 ℃,顶空萃取30 min,解析时间9 min的条件下对比以分析NaCl质量浓度对萃取效果的影响。
1.2.3.3 搅拌速度的确定 5 mL豆浆样品中加入0.5 g NaCl后,置于固相微萃取平台上,搅拌速度分别为400、500、600、700、800 r/min,萃取温度40 ℃,顶空萃取30 min,解析时间9 min的条件下对比以分析搅拌速度对萃取效果的影响。
1.2.3.4 萃取温度的确定 5 mL豆浆样品中加入0.5 g NaCl后,置于固相微萃取平台上,搅拌速度600 r/min,分别在萃取温度为20、30、40、50和60 ℃,顶空萃取30 min,解析时间9 min的条件下对比以分析萃取温度对萃取效果的影响。
1.2.3.5 萃取时间的确定 5 mL豆浆样品中添加0.5 g NaCl后,置于固相微萃取平台上,搅拌速度600 r/min,萃取温度40 ℃,分别萃取10、20、30、40和50 min,解析9 min结合GC-MS分析对比萃取时间对萃取效果的影响。
1.2.3.6 解析时间的确定 5 mL豆浆样品中添加0.5 g NaCl后,置于固相微萃取平台上,搅拌速度600 r/min,萃取温度40 ℃,萃取时间30 min,分别解析5、7、9、11和13 min后,利用GC-MS分析对比解析时间对萃取效果的影响。
1.2.4 气相色谱与质谱条件 色谱条件[13]:采用DB-WAX色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;柱温箱升温程序:40 ℃保持8 min,4 ℃/min升温至150 ℃,20 ℃/min升温至250 ℃,保持5 min;不分流进样,载气:99.999%高纯度氦气,载气流速:1 mL/min。质谱条件:离子源EI源;电子能量70 eV;接口温度250 ℃;离子源温度230 ℃;四级杆温度150 ℃,进样口温度250 ℃;质量扫描范围m/z 30~500,采集方式Scan。每种条件测定重复3次。
1.2.5 定性及定量分析 定性分析:豆浆中测得的挥发性化合物由计算机检索,通过质谱数据库NIST 2011谱库检索,选择匹配度大于80%的鉴定结果。定量分析:采用峰面积归一化法计算各挥发性成分的相对百分含量。
2 结果与讨论
2.1纤维头的选择
纤维头是影响萃取效果的一个至关重要的因素,不同萃取头的成分及性质不同,对各种风味物质的灵敏性和选择性存在差异[14]。由图1可知,采用PA-85 μm萃取头对豆浆挥发性物质进行萃取,共鉴定出12种化合物,总峰面积为1.55×108;PDMS-100 μm萃取头共鉴定出15种化合物,总峰面积为1.03×108;PDMS/CAR-75 μm共鉴定出18种化合物,总峰面积为2.33×108,DVB/CAR/PDMS-50/30 μm共鉴定出23种化合物,总峰面积为2.65×108。在鉴定出种类上,DVB/CAR/PDMS-50/30 μm萃取头>PDMS/CAR-75 μm萃取头>PDMS-100 μm>PA-85 μm萃取头;在萃取量(总峰面积)上,DVB/CAR/PDMS-50/30 μm萃取头>PDMS/CAR-75 μm萃取头>PA-85 μm>PDMS-100 μm萃取头。说明采用DVB/CAR/PDMS-50/30 μm萃取头所检测到的豆浆的挥发性化合物种类和含量最高。综上所述,选择DVB/CAR/PDMS-50/30 μm萃取头进行豆浆的挥发性物质检测最适宜,Achouri等人[15]采用CAR/PDMS萃取涂层的萃取头检测到豆浆中21种挥发性物质,与本研究结果基本一致。本文采用DVB/CAR/PDMS-50/30 μm萃取头,其有二乙烯苯、碳分子筛和聚二甲基硅氧烷复合材料纤维涂层萃取头能对豆浆风味物质中C3-C20大多数化合物都表现出较好的吸附能力。后续研究均选用此萃取头。

图1 不同萃取头涂层的萃取效果Fig.1 The extraction efficiency of different kinds of SPME fibre coating
2.2NaCl质量浓度的选择
NaCl的浓度对固相微萃取的萃取效果有显著的影响,添加NaCl可以增加样品的离子强度[16],提高HS-SPME分析的灵敏度[17],但是盐浓度过高可能会附在萃取头表面,致使纤维头损坏。由图2可知,随着NaCl添加量的增加,总峰面积呈现先增加后减小的趋势。加入NaCl后,各组分及总峰面积有明显的上升趋势,这是由于无机盐NaCl的加入其顶空压强增大,从而降低了风味物质在样品瓶液相的溶解度,使挥发性物质更多的挥发到样品瓶顶空[18]。在0.1 g/mL时,总峰面积达到最大。继续添加NaCl,由于样品瓶顶部的竞争作用导致萃取量下降[19]。豆浆中不同组分受盐离子的影响程度不同,随着NaCl含量的提高,可检出的醛类和酮类含量先增加后减小,但同时醇类的含量减少。综合考虑,5 mL豆浆样品中添加0.5 g NaCl,即NaCl质量浓度为0.1 g/mL为最优条件。

图2 不同NaCl质量浓度的萃取效果Fig.2 The extraction efficiency of different kinds of NaCl concentrations
2.3搅拌速度的选择
对于HS-SPME,加快搅拌速度可以提高挥发性成分在顶空中的扩散速度,从而提高萃取效率,搅拌有利于减少达到平衡所需时间,当达到平衡时,固相微萃取方法的灵敏度最高,但当搅拌到达一定速度后磁子搅拌不稳定[20]。由图3可知,随着搅拌速度的增加,总峰面积呈现先增加后基本不变的趋势。搅拌速度从400增至600 r/min时,醛类、醇类和酮类的含量均随着搅拌速度的增加而增加,而当搅拌速度超过600 r/min时,醛类、醇类和酮类的含量便不再增加,说明在该搅拌速度下,顶空内挥发性物质达到平衡状态。由于过高的搅拌速度不但会导致磁子不稳定,而且还增加能耗。所以综合考虑,本研究采用600 r/min的搅拌速度。
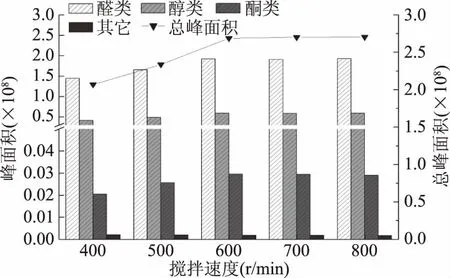
图3 不同搅拌速度的萃取效果Fig.3 The extraction efficiency of different kinds of stirring rate
2.4萃取温度的选择
萃取温度会影响SPME吸附过程中萃取涂层对风味物质的吸附量。由图4可知,随着萃取温度的升高,总峰面积呈现类似钟罩型变化,即先增加后减小。萃取温度在20~40 ℃,检测到醛类和酮类含量明显增加,醇类无明显变化,这可能是醇类的沸点较低使其在较低温度下竞争性吸附能力更强[13];40~50 ℃,相较其他温度区间而言,各类挥发性物质含量变化程度不大;当萃取温度高于50 ℃时,各类物质的含量均发生下降,可能是由于不同的挥发性组分在顶部空间的竞争所导致的。样品在40 ℃时豆浆中具有挥发性的化合物所表现出的挥发性最高,即此时出现最大吸附能力。故综合考虑,选择40 ℃作为分析豆浆挥发性物质的萃取温度。

图4 不同萃取温度的萃取效果Fig.4 The extraction efficiency of different kinds of extraction temperature
2.5萃取时间的选择
由图5可知,在萃取时间为10~30 min内,检测出的总峰面积呈不断上升的趋势;当时间进一步增加(30~50 min),总峰面积开始下降。萃取出的醛类、醇类及酮类物质含量随着萃取时间的增加,呈现先增加后减小的趋势,当萃取时间为30 min时,其含量均达到最高。说明在萃取时间为30 min时,萃取瓶内两相达到平衡,而随着时间的持续增加样品瓶中的豆浆体系为保持分配平衡而引起了挥发性组分从萃取头到样品溶液的逆行扩散[21]。萃取时间必须足以使挥发性物质浸透萃取头的纤维涂层,而这取决于挥发性物质的化学性质。仅针对豆浆中的醛、醇、酮等大多数风味物质,选择HS-SPME萃取豆浆中风味物质的时间30 min较好。

图5 不同萃取时间的萃取效果Fig.5 The extraction efficiency of different kinds of extraction time
2.6解析时间的选择
由图6研究结果可知,随着解析时间的延长,总峰面积呈现先增加后基本保持不变的趋势。解析5~9 min时,随着解析时间的延长,总峰面积和各类物质的峰面积不断增大,表明此时豆浆的挥发性物质未完全解析。当解析时间达到9 min后,总峰面积曲线无明显上升或下降趋势,表明此时风味物质总量和种类不再随解析时间增加,豆浆的挥发性物质已从萃取头上完全解析下来。在同一解析温度下,待测组分解析完全程度与解析时间直接相关。解析不完全不但会影响方法的灵敏度,而且会污染后续样品,但长时间高温解析会缩短HS-SPME萃取头的使用寿命。综合考虑,选择解析时间9 min为宜。

图6 不同解析时间的萃取效果Fig.6 The extraction efficiency of different kinds of desorption time
2.7HS-SPME与GC-MS结合分析豆浆风味物质的组成
选取DVB/CAR/PDMS-50/30 μm 萃取头,采用优化后的顶空固相微萃取条件:5 mL豆浆样品中添加0.5 g NaCl,萃取温度40 ℃,萃取时间30 min,在GC进样口解析9 min,利用GC-MS分析豆浆中的风味物质组成,得到的总离子流色谱图如图7所示,风味物质相对含量见表2。

图7 豆浆挥发性成分的总离子流色谱图Fig.7 Total ion current chromatograms of the volatile compounds of soymilk

表2 HS-SPME与GC-MS相结合豆浆挥发性成分的结果Table 2 HS-SPME coupled with GC-MS analytical results of volatile components in soymilk
注:所占比例<0.1%的化合物未列出。
利用顶空固相微萃取结合气质联用技术检测豆浆中的风味物质,共检测出23种挥发性化合物,匹配度均在80%以上。其中醛类10种、醇类5种、酮类3种、呋喃2种,酯类1种、其他类2 种。与Yixun[22]和李景妍等人[8]的研究结果基本一致,但与杨蕊莲[23]的研究结果不同,可能是由于萃取的方式不同造成。豆浆中的风味物质以醛类为主占53.45%,其次为醇类占26.42%,最后为酮类占7.19%。检测出的23种风味物质峰面积之和占总峰面积的90.48%。表明此优化条件可以准确、快速地分析豆浆挥发性成分。
3 结论
本研究通过单因素研究,阶段性选择优化条件后,选择出适宜豆浆挥发性成分的顶空固相微萃取的条件为:DVB/CAR/PDMS-50/30 μm萃取头、NaCl质量浓度为0.1 g/mL、搅拌速度600 r/min、萃取温度40 ℃、萃取时间30 min、解析时间9 min。在此条件下共鉴定出23种挥发性成分,占峰面积总和的90.48%,说明固相微萃取-气相色谱-质谱可定性与定量分析豆浆的主要挥发性成分。
[1]田其英,王静. 豆浆的研究进展[J]. 食品研究与开发,2016,37(17):208-210.
[2]杨蕊莲. 豆浆工艺优化及预处理对其品质影响研究[D]. 重庆:西南大学,2016.
[3]Poliseli-Scopel F H,Gallardo-Chacón J J,Juan B,et al. Characterisation of volatile profile in soymilk treated by ultra high pressure homogenisation.[J]. Food Chemistry,2013,141(3):2541-2548.
[4]Poliseli-Scopel F H,Hernández-Herrero M,Guamis B,et al. Sterilization and aseptic packaging of soymilk treated by ultra high pressure homogenization[J]. Innovative Food Science & Emerging Technologies,2014,22(4):81-88.
[5]Liu J R,Chen M J,Lin C W. Characterization of polysaccharide and volatile compounds produced by kefir grains grown in soymilk.[J]. Journal of Food Science,2006,67(1):104-108.
[6]Shi X D,Guo S T. Research developments of soymilk flavor compounds[J]. Journal of Food Safety & Quality,2014.
[7]Lv Y C,Song H L,Li X,et al. Influence of blanching and grinding process with hot water on beany and non-beany flavor in soymilk.[J]. Journal of Food Science,2011,76(1):S20-S25.
[8]李景妍,郭顺堂,陈洋. 生浆法和熟浆法加工对豆浆香气及相应豆腐产品特征的差异[J]. 大豆科技,2012(2):36-39.
[9]Pérez-González M,Gallardo-Chacón J J,Valencia-Flores D. Optimization of a Headspace SPME GC-MS Methodology for the Analysis of Processed Almond Beverages[J]. Food Analytical Methods,2015,8(3):612-623.
[10]吕艳春,郭顺堂. 三种方法加工的豆乳的风味特点[J]. 大豆科学,2010,29(3):494-497.
[11]冉春霞. 顶空固相微萃取-气质联用技术分析全豆腐乳中的挥发性成分[J]. 中国调味品,2014(12).
[12]尹君梅,王翠竹,孙逍. GC-MS法分析热处理方式对豆乳风味成分影响[C]. 北京市大学生科学研究与创业行动计划成果展示与经验交流会,2013.
[13]孙灵湘. 豆浆风味模拟体系的构建及各组分对其风味组成的影响[D]. 无锡:江南大学,2015.
[14]Onuki S,Koziel J A,Jenks W S,et al. Optimization of extraction parameters for quantification of fermentation volatile by-products in industrial ethanol with solid-phase microextraction and gas chromatography[J]. Journal of the Institute of Brewing,2016,122(1):102-109.
[15]Achouri A,Boye J I,Zamani Y. Identification of volatile compounds in soymilk using solid-phase microextraction-gas chromatography[J]. Food Chemistry,2006,99(4):759-766.
[16]Pérez-González M,Gallardo-Chacón J J,Valencia-Flores D. Optimization of a Headspace SPME GC-MS Methodology for the Analysis of Processed Almond Beverages[J]. Food Analytical Methods,2015,8(3):612-623.
[17]张明霞,赵旭娜,杨天佑,等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学,2011,32(12):49-53.
[18]张明霞,赵旭娜,杨天佑,等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学,2011,32(12):49-53.
[19]韩素芳,丁明,刘亚群,等. 顶空固相微萃取-气相色谱-质谱测定百香果香气条件的优化[J]. 中国食品学报,2010,10(4):278-284.
[20]Sawoszczuk T,Syguacholewińska J,del HoyoMeléndez J M. Optimization of headspace solid phase microextraction for the analysis of microbial volatile organic compounds emitted by fungi:Application to historical objects.[J]. Journal of Chromatography A,2015,1409:30-45
[21]Weng L. Optimization of headspace solid-phase microextraction for the analysis of specific flavors in Pseudosciaena Crocea[J]. Journal of Chinese Institute of Food Science & Technology,2012.
[22]Xia Y,Zhong F,Chang Y,et al. An Aromatic Lexicon Development for Soymilks[J]. International Journal of Food Properties,2015,18(1):125-136.
[23]杨蕊莲,蒋和体. SDE-GC-MS结合保留指数分析不同预处理的豆浆风味[J]. 食品科学,2015,36(20):185-189.
