黑果枸杞花青素微胶囊的稳定性及靶向释放特性
2018-01-22希羽
,, ,,,希羽,,2
(1.青海大学农牧学院,青海西宁 810016;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016)
青海黑果枸杞(LyciumruthenicumMurr)为茄科枸杞属多年生灌木[1],主要生长在我国西北地区的沙漠地带,是一种特有的食药植物资源[2]。黑果枸杞是花青素含量最高的野生植物,有“花青素之王”的美称[3]。其不仅可以用作食品着色剂,还具有抗氧化、抗疲劳、预防癌症、抗心血管疾病等生物活性,成为近年来研究与开发的热点[4]。然而黑果枸杞花青素在水相体系中极其不稳定,成为现在相关液态产品开发的难题。
微胶囊技术(Microencapsulation)是微量物质包裹在聚合物薄膜中的技术,是一种储存固体、液体、气体的微型包装技术[5]。开始于20世纪30年代,现已非常成熟。传统的微胶囊制备方法从原理上大致可分为物理方法、化学方法和物理化学方法三类[6-10]。其中比较典型的是乳液扩散法[11]、液滴聚结法[12]、层自组装法[13]、复凝聚法[14-15]等。传统的微胶囊包埋壁材已经不能很好地满足生产的需要,随着研究者对新型包埋材料不断深入的研究,多糖及低聚糖被作为新的运输载体,广泛地运用到食品功能成分的包埋运输当中[16]。
青海省是青稞和黑枸杞种植大省,特色食品资源丰富,然而由于花青素极其不稳定,黑果枸杞相关产品大都以浆果或固态产品在市场上出现,相关液态产品及高端产品很少,不能很好地满足消费者的需求。同时,目前关于以改性天然大分子多糖为壁材在水相体系下通过自聚集反应来包埋花青素的报道很少,对黑果枸杞花青素微胶囊在水相体系下的稳定性的研究几乎没有。据此,本文以改性青稞β-葡聚糖酯为壁材,黑果枸杞花青素为芯材,制备黑果枸杞花青素微胶囊水溶液,研究了温度、循环冻融、光照和紫外光照对黑果枸杞花青素微胶囊在水相中稳定性的影响,并进一步对其在体外模拟胃肠液中的稳定性和靶向释放特性进行了研究,旨在对黑果枸杞花青素液态产品及相关高端产品的开发和应用提供参考依据,解决黑果枸杞花青素液态产品开发的局限性。
1 材料与方法
1.1材料与仪器
黑果枸杞花青素粉末(纯度≥20%) 青海康元药用资源开发有限公司;青稞β-葡聚糖(纯度≥70%) 杭州众芝康菇生物技术有限公司;2-辛烯基琥珀酸酐(质量分数≥95%) 北京百灵威科技有限公司;透析袋(MD44-14,Union carbide Co,Seadrift,Tx,美国) 截留重均分子质量为14000 g/mol;胃蛋白酶(Trypsin>250 NFU/mg)、胰蛋白酶(3000~3500 NFU/g) 江苏锐阳生物科技有限公司;结晶乙酸钠(AR,质量分数≥99%)、氢氧化钠(AR,质量分数≥96.0%) 天津市河东区红岩试剂厂;无水乙醇(AR,质量分数≥99.7%)、盐酸(36.0%~38.0%)及氯化钾(AR,质量分数≥99.5%) 天津市富宇精细化工有限公司。
STP FA1004电子天平 诸暨市超泽衡器设备有限公司;HH-6电热恒温水槽 上海比朗仪器有限公司;UV-2600紫外可见分光光度计 岛津企业管理有限公司;H/T16MM台式高速离心机 湖南赫西仪器装备有限公司;PHSJ-3F pH计 上海雷磁;CJJ78-1磁力加热搅拌器 金坛市晨阳电子仪器厂。
1.2实验方法
1.2.1 改性青稞β-葡聚糖酯的制备 参考刘嘉等改性方法,稍作修改[16]。准确称取0.7 g青稞β-葡聚糖,分散于100 mL蒸馏水中,在80 ℃水浴条件下搅拌1 h,使青稞β-葡聚糖全部溶解。将青稞β-葡聚糖水溶液置于4 ℃冰箱冷却,最后于离心机中在3000 r/min条件下离心10 min。弃去沉淀,收集青稞β-葡聚糖溶液备用。在100 mL青稞β-葡聚糖溶液中加入0.5 mL 2-辛烯基琥珀酸酐(2-OSA),在 55 ℃水浴条件下,加热反应5 h,并使用3%(w/v)的氢氧化钠溶液调整反应液的pH,使pH保持在8~10之间。加热反应完毕后,将反应液冷却至室温,持续搅拌1 h。最终在反应液中滴加2 mol/L盐酸溶液使pH保持在6.5左右,置于旋转蒸发仪中,60 ℃下浓缩,最后收集浓缩液并加入3倍体积的异丙醇,在60 ℃下醇沉,最后置于4 ℃冰箱中静置12 h。待醇沉完成后,离心(3000 r/min,10 min),收集沉淀物并加热使其充分溶解于蒸馏水中,然后移至透析袋中(截留分子质量为14000 g/mol),分别用自来水和蒸馏水各透析24 h。最后将透析后的溶液置于真空冷冻干燥机中干燥,制得改性青稞β-葡聚糖酯。
1.2.2 黑果枸杞花青素微胶囊的制备
1.2.2.1 包埋原理 经疏水化改性的青稞β-葡聚糖在其长链上引入了疏水的烷基和亲水的羧基,制备出的改性青稞β-葡聚糖酯具有两亲性。在水相体系中,两亲性青稞β-葡聚糖酯的疏水基团通过疏水相互作用积聚而形成数量众多的疏水微区,进一步包埋花青素,而亲水的多糖链则依靠氨键等作用力与水分子相互作用构成颗粒的外壳结构,在水相体系下发生自聚集反应形成纳米级水凝胶。
1.2.2.2 制备方法 将改性青稞β-葡聚糖酯(100 mg)溶解于40 mL蒸馏水中,并沸水浴2 min,使其全部溶解。待溶液冷却后补充至原体积(40 mL)。将20 mg黑果枸杞花青素加入改性青稞β-葡聚糖酯溶液中,将此溶液在磁力搅拌器输出功率为450 W时室温下搅拌2 h,制得改性青稞β-葡聚糖酯花青素微胶囊溶液。
1.2.3 黑果枸杞花青素微胶囊的热降解动力学研究 食品中绝大部分成分的降解反应的模型基本都符合零级和一级降解模型[17-18],根据相关模型拟合热降解曲线,计算反应级数、降解半衰期、反应常数k以及反应活化能Ea。
1.2.4 黑果枸杞花青素微胶囊稳定性的研究 分别配制pH3.5和pH6.5 体系条件下的黑果枸杞花青素微胶囊溶液和只含花青素的溶液,用来做热稳定性、冻融稳定性和光照稳定性实验。以只含花青素的溶液为空白对照,最后用pH试差法计算溶液中花青素的含量,计算花青素的保留率。
热稳定性实验:分别取等量的样品溶液装入具塞试管中,分别在40、60、80 ℃下恒温水浴连续加热2、4、6、7 h。
冻融稳定性实验:分别将样品溶液按照在-18 ℃下冷冻2 h,而后在25 ℃下解冻2 h为一次冻融循环,重复三次循环。
光照稳定性实验:在室内散射光下,分别将样品溶液置于三角瓶中常温储藏2、3、4、5、10 d;在紫外光实验中,分别将样品溶液置于平皿中,置于紫外光(25 kW)下照射1、2、3、4 h。
1.2.5 黑果枸杞花青素微胶囊的稳定性及靶向释放特性研究
1.2.5.1 模拟胃液(SGF)的配制 准确称取1.0 g NaCl,1.6 g胃蛋白酶,量取3.5 mL 37% HCl,并用浓盐酸调节pH1.2,用蒸馏水定容至500 mL[16]。
1.2.5.2 模拟肠液(SIF)的配制 准确称取3.4 g KH2PO4溶于250 mL蒸馏水中,振荡使之溶解。并加入0.2 mol/L NaOH 95 mL和200 mL蒸溜水,加胰酶5.0 g,混匀,用0.2 mol/L的NaOH调节pH为7.5±0.1,用蒸馏水定容至500 mL[16]。
1.2.5.3 黑果枸杞花青素微胶囊体外模拟胃肠中花青素稳定性实验 将花青素微胶囊溶液和模拟胃肠液按照1∶4的比例混合(共25 mL),对照样品为花青素未包埋溶液,同样按照1∶4的比例与模拟胃肠液混合(共25 mL)。然后再将此混合液体置于恒温振荡器中,并设置摇床转速为120 r/min以及温度为37 ℃。SGF分别在10、20、30、40、60、90 min处取出样品1 mL,并补充1 mL SGF溶液,测定其花青素的含量,计算保留率;SIF分别在10、30 min,1、2、4、6 h处取出样品1 mL,并补充1 mL SIF溶液,测定其花青素的含量,计算保留率。
1.2.5.4 黑果枸杞花青素微胶囊体外模拟胃肠靶向释放特性实验 配制100 mL的花青素微胶囊溶液,吸取5 mL加入到试管中,并按照SGF和SIF中盐离子比例添加相应的NaCl和KH2PO4。待混合均匀后,转移至透析袋中。将透析袋移至50 mL模拟胃肠液中,然后再将此混合液体在恒温振荡器中,并设置摇床转速为120 r/min以及温度为37 ℃。
SGF分别在15、30、45、60、90 min处各取出1 mL样品透析袋外液测定其中花青素含量,再补充加入1 mL SGF,测定其花青素的含量。
SIF分别在15、30 min,1、2、4 h处各取出1 mL样品透析袋外液测定其中花青素含量,再补充加入1 mL SIF,测定其花青素的含量。
根据下式计算在胃肠液中的释放率,对比研究包埋花青素及未包埋花青素在模拟胃肠环境中的释放率。
释放率(%)=(胃/肠液模拟液中释放的花青素量)/起初加入的花青素量×100
式(1)
1.2.6 花青素含量及保留率的测定
1.2.6.1 花青素含量的测定 采用pH示差法[19-20],以矢车菊素-3-葡萄糖苷作为花色苷标准品,测定波长为535 nm,测得的总花色苷含量以矢车菊素-3-葡萄糖苷含量表示。取样品待测液1 mL,加入到20 mL的比色管中,用pH4.5的NaAc-Hac缓冲溶液和pH1.0的KCl-HCl缓冲溶液分别定容至刻度,摇匀,在避光的条件下平衡90 min,转入光路长为1 cm的比色皿中,以缓冲溶液做空白对照,分别在535 nm和700 nm处测定其吸光度。
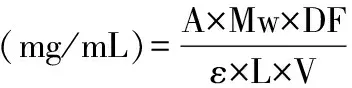
式(2)
式中,A=[(A535 nm-A700 nm)pH1.0-(A535 nm-A700 nm)pH4.5];Mw=449.2 g/mol(花色苷分子量);DF=待测液稀释倍数;ε=26 900 L/mol·cm(矢车菊素-3-葡萄糖苷的摩尔消光系数);V=取样液体积(mL);L=光路长度(cm)。
1.2.6.2 花青素保留率的测定 将微胶囊溶液于12000 r/min条件下高速离心60 min,使微球充分沉降,分别收集上清液与下部微胶囊沉淀,用乙醇(70%)溶液溶出微胶囊沉淀中的花青素,分别测上清液中花青素和沉淀中花青素的含量,计算花青素的总量并计算保留率。以花青素保留率为微胶囊化后花青素稳定性的评价指标,其中花青素保留率的计算公式为:
式(3)
式中:Y:花青素保留率(%);M:起始加入花青素的质量(g);M1:离心上清液中花青素的含量(g);M2:沉淀中花青素的含量(g)。
1.3数据处理
实验均重复3次,取其平均值,采用Excel和Origin软件进行数据分析和作图。
2 结果与分析
2.1黑果枸杞花青素微胶囊热降解动力学实验
2.1.1 反应级数(n)确定 为了排除因传热引起的误差,分别以40、60、80 ℃条件下花青素水浴后2 h的含量为起始值,以花青素含量保留率对数的负值-ln(ρ1/ρ0)(ρ0为开始加热时黑果枸杞花青素的含量,ρ1为经过时间t后黑果枸杞花青素的含量)对加热时间t作图,分别进行线性回归,得回归方程和决定系数,如图1、图2所示。

图1 pH3.5体系下包埋花青素(A)与未包埋花青素(B)在不同温度下加热时间与-ln(ρ1/ρ0)的关系Fig.1 Relationship between heating time and -ln(ρ1/ρ0)at different temperature about encapsulated anthocyanins(A)and non encapsulated anthocyanins(B)in the pH3.5 system

图2 pH6.5体系下包埋花青素(A)与未包埋花青素(B)在不同温度下加热时间与-ln(ρ1/ρ0)的关系Fig.2 Relationship between heating time and -ln(ρ1/ρ0)at different temperature about encapsulated anthocyanins(A) and non encapsulated anthocyanins(B)in the pH6.5 system
由图1、图2可知,-ln(ρ1/ρ0)和t成明显线性关系,包埋黑果枸杞花青素在pH3.5体系下40、60、80 ℃条件下决定系数R2分别为0.9545、0.9629、0.9888;未包埋黑果枸杞花青素在pH3.5体系下40、60、80 ℃条件下决定系数R2分别为0.9836、0.9531、0.975;包埋黑果枸杞花青素在pH6.5体系下40、60、80 ℃条件下决定系数R2分别为0.9665、0.9566、0.9737;未包埋黑果枸杞花青素在pH6.5体系下40、60、80 ℃条件下决定系数R2分别为0.9913、0.9745、0.9848。由公式lnρ1=-k×t+lnρ0可知其反应级数均为1,即黑果枸杞花青素的热降解符合一级反应模型。
2.1.2 黑果枸杞花青素热降解动力学参数的确定 由公式lnρ1=-k×t+lnρ0及图1、图2可知,花青素保留率对数的负值-ln(ρt/ρ0)对加热时间t作图所得直线的斜率即为该温度时的热降解反应常数k。根据不同温度时的k值,以lnk对 1/T作线性回归,由公式k=k0exp(-Ea/RT)可得,直线的斜率为-Ea/R,截距为lnk0,由直线的斜率和截距即可求出活化能Ea和方程常数k0,具体参数如表1和表2所示。
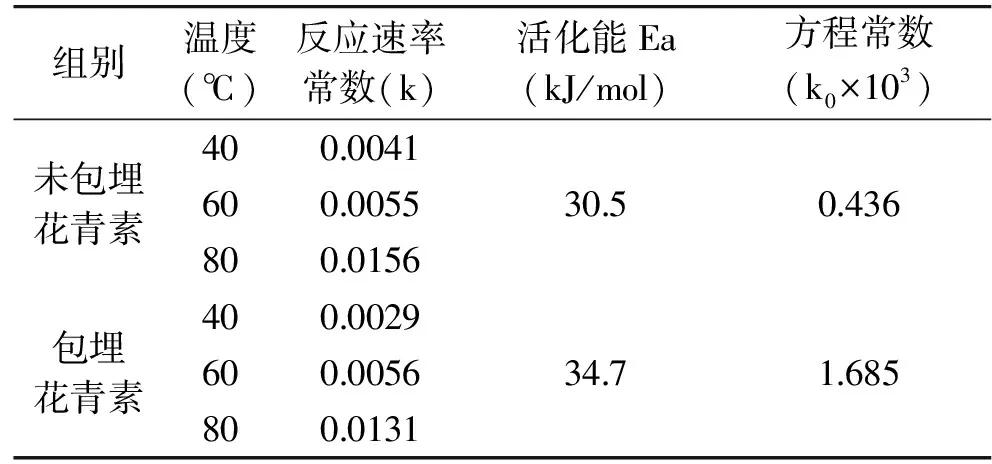
表1 pH3.5体系下未包埋花青素与包埋花青素的热降解动力学参数Table 1 Kinetic parameters of thermal degradation of encapsulated anthocyanins and non encapsulated anthocyanins in pH3.5 system

表2 pH6.5体系下未包埋花青素与包埋花青素的热降解动力学参数Table 2 Kinetic parameters of thermal degradation of encapsulated anthocyanins and non encapsulated anthocyanins in pH6.5 system
2.1.3 黑果枸杞花青素热处理过程中含量变化的预测模型 根据黑果枸杞花青素在加热过程中含量的变化,由公式lnρ1=-kt+lnρ0、k=k0exp(-Ea/RT)可得:lnρ1-lnρ0=-kt=-k0exp(-Ea/RT)×t 则:t=(lnρ0-lnρ1)/(k0×exp(-Ea/RT)),将活化能Ea=30.5 kJ/mol、反应常数k0=0.436×103、R=8.314 J/(mol·K)带入可得:
pH3.5体系未包埋花青素热降解的预测模型为:t=(lnρ0-lnρ1)/(436×exp(-3668.5/T));
pH3.5体系包埋花青素热降解的预测模型为:t=(lnρ0-lnρ1)/(1685×exp(-4173.6/T));
pH6.5体系未包埋花青素热降解的预测模型为:t=(lnρ0-lnρ1)/(27945×exp(-4077.4/T));
pH6.5体系包埋花青素热降解的预测模型为:t=(lnρ0-lnρ1)/(315×exp(-2670.1/T));
2.1.4 动力学模型的验证 应用动力学模型分别预测在80 ℃条件下两体系下未包埋花青素和包埋花青素的半衰期,分别为13.33、17.75 h;5.4、9.95 h。将定量的pH3.5体系未包埋黑果枸杞花青素溶液和包埋在以上温度条件下保存,在第13.33 h和第17.75 h 测定其花青素保留率,分别为52.29%、49.76%;pH6.5体系在第5.4 h和第9.95 h测定其花青素保留率,分别为53.2%、48.9%,接近初始值的一半,表明动力学降解方程和实际观测结果较好,即所得动力学模型有效。
2.2黑果枸杞花青素微胶囊稳定性实验
2.2.1 黑果枸杞花青素微胶囊耐热稳定性实验
2.2.1.1 40 ℃加热条件下黑果枸杞花青素耐热稳定性 40 ℃加热条件下,加热不同时间后,pH3.5和6.5两个体系下果枸杞花青素微胶囊溶液与未包埋的空白溶液中花青素的保留率见图3。
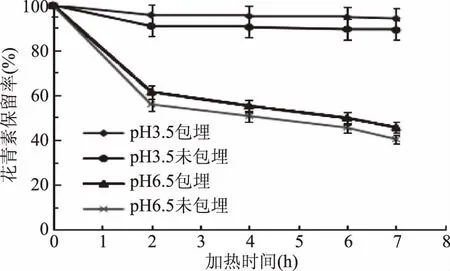
图3 温度对水相体系中黑果枸杞花青素保留率的影响Fig.3 Effect of temperature on anthocyanin retention rate of Lycium ruthenicum Murr in aqueous system
由图3可知,随着加热时间的延长,在pH3.5的体系下,黑果枸杞花青素的降解没有明显的变化,在加热7 h后,花青素微胶囊溶液和花青素空白(未包埋)溶液中花青素的保留率分别为94.1%、88.9%。这可能是因为在低温、低pH下花青素非常稳定的原因。在pH6.5的体系下,花青素的降解速度比较快,加热7 h后,花青素的保留率分别为45.6%、40.3%。但在pH3.5和6.5两体系下,花青素微胶囊溶液中花青素的保留率要高于空白溶液(未包埋)中花青素的保留率,但效果不明显(p>0.05)。较低温条件下花青素的降解速率比较缓慢可能是造成花青素微胶囊后对其的稳定性的保护效果不明显的原因。
2.2.1.2 60 ℃加热条件下黑果枸杞花青素耐热稳定性 60 ℃加热条件下,加热不同时间后,pH3.5和6.5两个体系下果枸杞花青素微胶囊溶液与未包埋的空白溶液中花青素的保留率见图4。
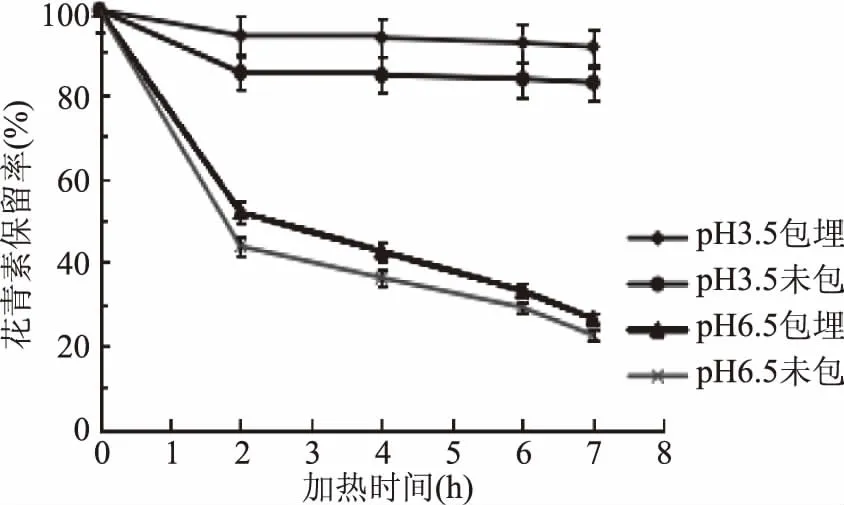
图4 温度对水相体系中黑果枸杞花青素保留率的影响Fig.4 Effect of temperature on anthocyanin retention rate of Lycium ruthenicum Murr in aqueous system
由图4可知,随着加热时间的延长,花青素的保留率逐渐降低。在pH3.5、6.5两个体系下,与花青素空白溶液(未包埋)相比,黑枸杞花青素微胶囊溶液经过60 ℃热降解花青素的保留率分别平均提高8.9%、8.1%。说明花青素微胶囊后能够一定程度的提高其的耐热稳定性。
2.2.1.3 80 ℃加热条件下黑果枸杞花青素耐热稳定性 80 ℃加热条件下,加热不同时间后,pH3.5和6.5两个体系下果枸杞花青素微胶囊溶液与未包埋空白溶液中花青素的保留率见图5。
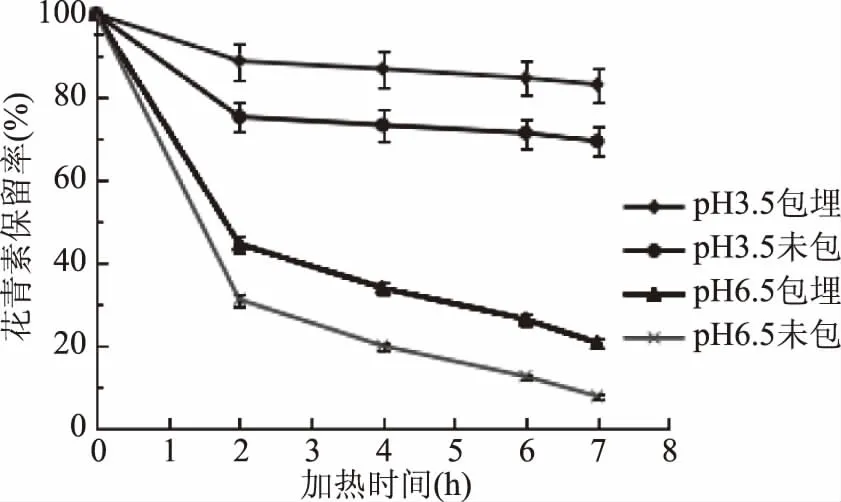
图5 温度对水相体系中黑果枸杞花青素保留率的影响Fig.5 Effect of temperature on anthocyanin retention rate of Lycium ruthenicum Murr in aqueous system
由图5可知,随着加热时间的延长,在pH3.5和pH6.5的体系下,黑果枸杞花青素微胶囊溶液中花青素的保留率明显高于空白(未包埋)溶液(p<0.05),在pH3.5体系下,加热7 h后,花青素微胶囊溶液和花青素空白(未包埋)溶液中花青素的保留率分别为82.7%、69.2%,保留率平均提高了13.5%。在pH6.5的体系下,花青素的降解速度比较快,加热7 h后,花青素微胶囊溶液和花青素空白(未包埋)溶液中花青素的保留率分别为20.4%、7.5%,保留率平均提高了12.9%,说明花青素微胶囊后能够提高其的耐热稳定性。
以上结果表明,通过对花青素微胶囊溶液和花青素空白对照溶液(未包埋)在不同温度下加热处理,随着温度的升高,花青素微胶囊后对花青素的保护作用越来越明显。并且在pH3.5体系下,黑果枸杞花青素微胶囊的热稳定性明显高于pH6.5体系下的,这是因为在水相体系下,花青素的稳定性随着pH的升高而降低。同时,在pH6.5体系下花青素微胶囊不易形成,结构疏松,导致对花青素的保护效果不佳。所以,以改性青稞葡聚糖酯为壁材荷载黑果枸杞花青素可以有效地提高其热稳定性。
2.2.2 黑果枸杞花青素微胶囊冻融稳定性实验 黑果枸杞花青素微胶囊冻融稳定性实验结果见图6。
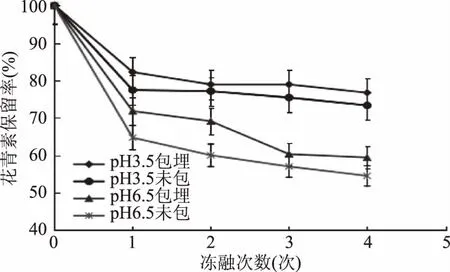
图6 循环冻融对水相体系中黑果枸杞花青素保留率的影响Fig.6 Effect of cyclic freezing and thawing on anthocyanin etention rate of Lycium ruthenicum Murr in aqueous system
由图6可知,在pH3.5体系下,黑果枸杞花青素微胶囊对花青素的冻融稳定性有一定的保护作用,但效果不显著(p>0.05)。这可能是因为黑果枸杞花青素自身的冻融稳定性较好,在加上在较低pH下黑果枸杞花青素相对比较稳定的原因。在pH6.5体系下,在前两次的冻融循环后,改性青稞β-葡聚糖酯对黑果枸杞花青素的包埋保护效果分别提高了9.9%、13.2%,在经过两次冻融循环后微胶囊可能被冻裂,被包埋的花青素溶到水相中,改性青稞β-葡聚糖酯起不到对花青素的保护作用,导致后两次冻融循环过程中花青素微胶囊溶液中和空白组(未包埋)中的花青素保留率大致相同。所以,改性青稞β-葡聚糖酯可以对黑果枸杞花青素的冻融稳定性起到一定的保护作用。由图5和图6还可以发现,花青素自身有较好的抗冻融能力,其冻融稳定性要高于耐热稳定性。
2.2.3 黑果枸杞花青素微胶囊的光照稳定性实验 在室温的条件下,pH为3.5和6.5两个体系下果枸杞花青素微胶囊溶液与未包埋空白溶液中花青素的保留率见图7。
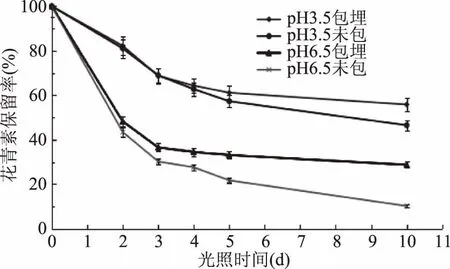
图7 光照对水相体系中花青素保留率的影响Fig.7 Effect of light on the retention rate of anthocyanin in aqueous system
由图7可知,随着光照时间的延长,花青素微胶囊对花青素的保护作用越明显(p<0.05)。在pH3.5 和pH6.5体系下,与未包埋花青素相比,在光照第5 d后,花青素微胶囊溶液中花青素的保留率分别提高了3.8%、11.4%,在光照第10 d后,花青素微胶囊溶液中花青素的保留率分别提高了9.3%、18.5%。以上结果表明,花青素微胶囊后可以有效的提高花青素的光稳定性。
2.2.4 黑果枸杞花青素微胶囊的紫外光照射稳定性实验 在室温的条件下,pH为3.5和pH6.5两个体系下黑果枸杞花青素微胶囊溶液与未包埋空白溶液中花青素在紫外光照射下的保留率见图8。

图8 紫外光照对水相体系中花青素保留率的影响Fig.8 Effect of UV irradiation on anthocyanin retention rate in aqueous system
由图8可知,随着紫外光照时间的延长,花青素微胶囊对花青素的保护作用越明显(p<0.05)。在 pH3.5和6.5体系下,与未包埋花青素相比,在紫外光照4 h后,花青素微胶囊溶液中花青素的保留率分别提高了11.6%、11.1%。以上结果表明,花青素微胶囊后可以有效地提高花青素的光稳定性。
2.2.5 黑果枸杞花青素微胶囊的稳定性及靶向释放特性实验
2.2.5.1 黑果枸杞花青素微胶囊在模拟胃液中花青素的稳定性 黑果枸杞花青素微胶囊在模拟胃液中花青素的稳定性见图9。

图9 黑果枸杞花青素微胶囊在模拟胃液中花青素的稳定性Fig.9 Stability of anthocyanin of Lycium ruthenicum Murr anthocyanin microcapsules in simulated gastric fluid
由图9可知,花青素在胃液中较稳定,降解速度缓慢,这是因为花青素在较低的pH下较稳定。但是,随着时间的延长,60 min时花青素微胶囊溶液和未包埋花青素溶液中花青素的保留率分别为80.4%、65.6%,保留率提高了14.8%。说明花青素微胶囊后对其在胃液中的稳定性起到了保护作用。
2.2.5.2 黑果枸杞花青素微胶囊在模拟肠液中花青素的稳定性 黑果枸杞花青素微胶囊在模拟肠液中花青素的稳定性见图10。
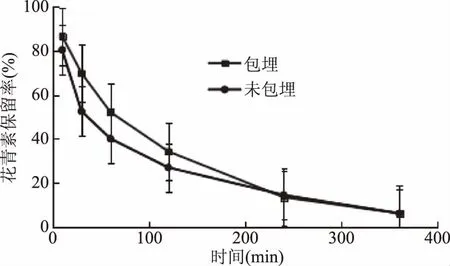
图10 黑果枸杞花青素微胶囊在模拟肠液中花青素的稳定性Fig.10 Stability of anthocyanin of Lycium ruthenicum Murr anthocyanin microcapsules in Simulated intestinal fluid
由图10可知,花青素在肠液中迅速降解,这是因为花青素在高pH的环境中不稳定,降解速度加快。在一定的时间范围内,随着时间的延长,改性青稞β-葡聚糖酯纳米颗粒对花青素的保护效果越发显著,30 min时花青素空白溶液中花青素的保留率为52.6%,而花青素微胶囊溶液中花青素的保留率为 69.9%,保留率提高了17.3%,差异显著(p<0.05)。250 min 后,二者之间没有显著的差异(p>0.05),这可能是因为微胶囊破裂,花青素溶解在肠液中,降解速率加快的原因[21]。所以,当花青素荷载到改性青稞β-葡聚糖酯纳米颗粒上后,其稳定性得到提高。花青素在小肠液中稳定性的提高,能够更好地保证其在人体内的吸收利用。
2.2.5.3 黑果枸杞花青素微胶囊在模拟胃液中花青素的释放率 黑果枸杞花青素微胶囊在模拟胃液中的花青素的释放特性见图11。
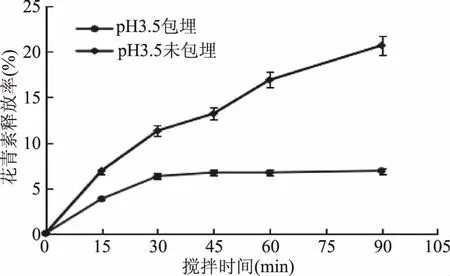
图11 黑果枸杞花青素微胶囊在模拟胃液中的花青素的释放特性Fig.11 Release characteristics of anthocyanin of Lycium ruthenicum Murr anthocyanin microcapsules in simulated gastric fluid
由图11可知,随着时间的延长,花青素在胃液中的释放率逐渐增加,在90 min时,花青素微胶囊在模拟胃液中花青素的释放率较低,仅为7.5%,而花青素未包埋溶液中花青素的释放率为20.7%,由此可知,在胃液中花青素微胶囊对花青素有显著的保护效果(p<0.05)。在胃液中,降低花青素的释放率,可以有效的降低其降解损失,这有利于人体对花青素的吸收利用。
2.2.5.4 黑果枸杞花青素微胶囊在模拟肠液中花青素的释放率 黑果枸杞花青素微胶囊在模拟肠液中的花青素的释放特性见图12。
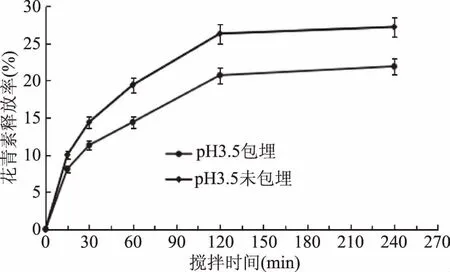
图12 黑果枸杞花青素微胶囊在模拟肠液中的花青素的释放特性Fig.12 Release characteristics of anthocyanin of Lycium ruthenicum Murr anthocyanin microcapsules in simulated intestinal fluid
由图12可知,随着时间的延长,花青素在肠液中的释放率逐渐增加,明显高于胃液中的释放率。在30 min后,二者之间有显著的差异(p<0.05),且随着时间的延长,花青素微胶囊对花青素的保护效果越发显著。240 min时花青素胶囊溶液和花青素未包埋溶液中花青素的释放率分别为21.9%、27.2%。所以,当花青素荷载到改性青稞β-葡聚糖酯纳米颗粒上以后,能够降低花青素的释放率,提高花青素的稳定性,花青素在小肠液中稳定性的提高,能够更好地保证其在人体内的吸收利用。
3 结论
以黑果枸杞花青素微胶囊在水相体系中花青素的保留率为指标,采用控制变量法研究了环境因素(温度、自然光照、紫外光照)对花青素稳定性的影响,确定了花青素的氧化降解规律;采用体外模拟胃肠液的方法对花青素微胶囊的稳定性和靶向释放特性进行了研究。结果表明:花青素微胶囊的热降解符合一级降解动力学模型;花青素在低温和较低pH条件下较稳定,并且花青素微胶囊后对其的氧化降解具有一定的保护作用。在稳定性实验中,花青素微胶囊在体外模拟胃液中较稳定,60 min后,花青素微胶囊溶液中花青素的保留率为80.4%。在体外模拟肠液中花青素不稳定,30 min 以后,花青素微胶囊溶液中花青素的保留率为69.9%,与未包埋花青素溶液相比,保留率分别提高了14.8%、17.3%;在靶向释放实验中,在体外模拟胃液中,90 min后,花青素微胶囊溶液和花青素未包埋溶液中花青素的释放率分别为7.5%,20.7%;在体外模拟肠液中花青素缓慢释放,240 min后,二者之间花青素的释放率分别为21.9%、27.2%;花青素微胶囊在胃肠液中稳定性的提高,能够更好地保证花青素在人体内的吸收利用。
[1]陈莎莎,索有瑞,白波,等. 青藏高原黑果枸杞花青素稳定性评价[J]. 天然产物研究与开发,2017,29(2):322-328.
[2]郑德龙,杨威,蔡世霞,等. 种植黑枸杞前景及发展趋势[J]. 农业与技术,2016,36(6):142.
[3]张元德. 黑果枸杞色素微胶囊的制备[D]. 新疆:塔里木大学,2010:1-53.
[4]李 雯,陈小玲,刘彩芬,等. 黑枸杞花青苷的研究进展[J]. 生物资源,2017,39(3):162-167.
[5]Neta N S,Teixeira J A,Rodrigues L R. Sugar ester surfactants:enzymatic synthesis and applications in food mdustiy[J]. Critical Reviews in Food Science and Nutrition,2015,55(5):595-610.
[6]韩爱芝,蒋卉. 应面实验优化黑果枸杞花色苷微胶囊制备工艺及其稳定性分析[J]. 食品科学,2016,37(10):82-87.
[7]钱明雪,潘利华. 蓝莓花青素微胶囊的包埋工艺[J]. 食品研究与开发,2013,34(24):166-169.
[8]Tang D W,Yu S H,Ho Y C,et al. Characterization of tea catechins-Ioaded nanoparticles prepared from chitosan and an edible polypeptide[J]. Food Hydrocolloids,2013,30(1):33-41.
[9]丁保淼,袁武华. 锐孔法制备原花青素微胶囊工艺研究[J]. 开发应用,2012,28(12):214-217.
[10]娄秋艳,孙汉巨. 黑米花青素微胶囊制备的工艺研究[J]. 食品安全质量检测学报,2015,6(6):166-168.
[11]Zhang Liguo,Ouyang Xiaowen,Ni Lijun,et al. Preparation and evaluation of microcapsule containing volatile oil of Herba Schizonepetae by emulsion solvent diffusion method[J]. 天津大学学报:英文版,2014,32(2):103-111.
[12]Yasushi Y,KiyomiI F,Yoshinari T,et al. Preparation of microcapsules with liquid droplet coalescence method followed by phase separation[J]. Journal of Encaps ulation and Adsorption Sciences,2013,3(3):93-97.[13]Xie Yuliang,Wang Mingjun,Yao Shanjing. Preparation and characterization of biocompatible microcapsules of sodium cellulose sulfate/chitosan by means of layer-by-layer self-assembly[J]. Langmuir,2009,25(16):8999-9005.
[14]Dong Die,Qi Zhengliang,Hua Yufei,et al. Microencapsulation of flaxseed oil by soya proteins-gum arabic complex coacervation[J]. International Journal of Food Science and Technology,2015,50(8):1785-1791.
[15]廖霞,杨小兰,李瑶,等. 槲皮素微胶囊的贮藏稳定性及抗氧化活性[J]. 食品科学,2017,38(1):60-66.
[16]刘 嘉. OS-燕麦β-葡聚糖酯自聚集体的构建及应用[D]. 重庆:西南大学,2015:1-16.
[17]樊金玲,朱文学,沈军卫,等. 高效液相色谱-电喷雾质谱法分析牡丹花中花色苷类化合物[J]. 食品科学,2007,31(8):367-371.
[18]高愿军,郝莉花,张鑫,等. 猕猴桃汁维生素C降解动力学的研究[J]. 农业工程学报,2006,22(5):157-160.
[19]Lee J,Durst R W,Wrolstad RE. Determination of total monomeric anthocyanin pigment content of fruit juices,beverages,natural col-orants,and wines by the pH differential method:collaborative study[J]. Journal of Aoac International,2005,88(5):1269-1278.
[20]闫亚美,冉林武,曹有龙. 黑果枸杞花色苷含量测定方法[J]. 食品工业,2012,33(6):145-147.
[21]何丽君. 叶黄素油微胶囊的制备及其质量研究[D]. 扬州:扬州大学,2014.
