凡纳滨对虾(Litopenaeus vannamei)亲虾繁殖期水体微生物多样性*
2018-01-22李贵阳莫照兰曹宝祥张玉玲
陈 琼 李贵阳, 罗 坤, 孔 杰,① 莫照兰,栾 生, 李 杰, 曹宝祥, 张玉玲
(1. 中国海洋大学海洋生命学院 青岛 266003; 2. 中国水产科学研究院黄海水产研究所 农业部海洋渔业资源可持续利用重点开放实验室 青岛 266071; 3.青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071)
凡纳滨对虾(Litopenaeus vannamei), 俗称南美白对虾, 具有生长迅速、个体大、营养要求较低、抗病性较强、对水环境变化适应强等特点。1988年我国引进凡纳滨对虾, 目前在全国各地广泛养殖(王兴强等, 2004)。随着对虾养殖业的深入发展, 养殖集约化日益加深, 大量的残饵和粪便导致养殖水体恶化, 各种病害频发, 严重制约了对虾养殖产业的可持续发展。养殖水体是水产动物赖以生存的环境, 水体中的微生物在养殖生态系统的物质循环和能量流动中发挥着巨大作用(郑天凌等, 1994)。细菌是水体中的主要微生物类群, 对于对虾而言, 养殖水体中气单胞菌(Aeromonas)和假单胞菌(Pseudomonadaceae)保持一定数量时, 有利于对虾生长; 而一些弧菌(Vibrio)、单胞菌、假单胞菌等大量存在时, 可导致对虾患病。有研究表明, 养殖水体中弧菌数量达到 105indi./mL以上时, 可能会引发弧菌病(朱根福等, 1999)。一些有益微生物, 如乳酸菌(lactic acid bacteria, LAB)和酵母菌(Yeast)等数量增多, 也可以改善养殖水环境质量,为高效、高产的对虾养殖奠定基础。因此, 了解对虾养殖水体的微生物组成, 对养殖水环境进行监控, 通过人为调控养殖水体微生物菌群结构来保持水体的微生态平衡, 可以为人们提供绿色健康的养殖模式。1986年, Kozasa首次将分离自土壤的 1株芽孢杆菌(Bacillus)用于水产养殖(Kozasa, 1986)。目前, 在水产养殖中已经认识的有益微生物有光合细菌(Photosynthetic Bacteria Abbr, PSB)、芽孢杆菌、酵母菌等, 这些有益微生物在调节养殖水体质量、促进养殖生物生长、提高养殖生物抗病性等方面发挥着重要作用。
由于大多数环境微生物在常规培养基上无法生长, 故传统的培养法只能分离和鉴定总微生物量的0.1%—10%(Torsvik et al, 1998)。基于进化中相对保守的核酸分子序列的分析技术逐渐用于研究环境微生物多样性(Pace et al, 1997)。例如, 通过变性梯度凝胶电泳(Denaturing Gradient Gel Electrophoresis,DGGE)、温度梯度凝胶电泳(Temperature Gradient Gel Electrophoresis, TGGE)等分析16S rRNA基因序列的点突变来反应环境样品的微生物多样性。如, 王亭芳等(2012)采用DGGE技术对凡纳滨对虾养殖水体中的微生物多样性进行研究; 高平平等(2003)采用 TGGE技术研究废水处理系统活性污泥细菌种群动态变化及多样性。但这些传统的分子生物学技术存在重复性较差、无法定量分析、信息不全等缺陷, 故对环境中绝大部分微生物的发掘仍不全面(祎李, 2013)。高通量测序技术(High-throughput sequencing, HTS), 又称为“下一代”测序(next generation sequencing, NGS)技术, 可以一次分别对几百万至上千万条 DNA进行测序(Shendure et al, 2008), 它的迅速发展弥补了传统分子生物学的不足, 能更加全面的反映样品的微生物多样性。高通量测序法具有测序成本低, 测序深度高, 更有利于低丰度群落物种鉴定的优点, 从而提高了微生物群落研究的完整性。
在凡纳滨对虾育苗时期, 对亲虾的管理至关重要, 亲虾养殖水体中致病微生物达到一定数量则会使虾患病, 从而降低生产。养殖水体微生物多样性的研究可以对水体质量进行评价, 为及时采取措施调控水体微生态平衡提供条件。为了深入了解凡纳滨对虾繁殖时期亲虾养殖水体的微生物群落结构, 本实验采用Illumina HiSeq2500测序平台, 对凡纳滨对虾亲虾养殖水体微生物 16S rRNA基因的两个高变区(V3-V4区)进行测序分析, 从而更全面地分析亲虾养殖水体中的微生物群落组成, 不仅可以为亲虾繁殖期的健康养殖提供理论支持, 还为我们寻找具有特殊功能的微生物菌种提供丰富的生物资源。
1 材料与方法
1.1 水样采集和预处理
水样采自于中国水产科学研究院黄海水产研究所水产遗传育种中心(山东省青岛市即墨鳌山卫)的凡纳滨对虾亲虾养殖池。养殖水泥池的面积为9m2, 池深1.2m, 水深约为0.6m。虾池每天上午换水一次, 换水量为总水量的 2/3, 对虾按时投喂经高锰酸钾消毒处理的鲜活沙蚕(Sipunculus nudus), 日投喂量为体重的30%。取样时水样温度为26°C, 盐度为35(W/V)。选取雄虾池(A7池, 42尾)、雌虾池(A8池, 37尾)进行水样采集。每池各选取水深为0.2m处的3个不同的采样点, 于2015年10月23日上午8时, 用采样器取每个取样点水 2L于灭菌的三角烧瓶中, 编号分别为A7(X1.1、X2.2、X3.2)、A8(C1.2、C2.2、C3.2)。所有样品迅速运回实验室并保存在4°C条件下, 及时用孔径为0.22μm的醋酸纤维素滤膜过滤收集水体中的微生物。将过滤好的滤膜保存在灭菌的50mL离心管中, 并保存在-20°C条件下, 用于微生物宏基因组DNA的提取。
1.2 水样微生物宏基因组DNA的提取
水样微生物宏基因组DNA的提取采用酚氯仿法和细菌基因组提取试剂盒(艾德莱,北京)。具体为: 剪碎滤膜, 放入 1.5mL无菌离心管中, 加 600μL无菌STE缓冲液(10mmol/L Tris-HCl, 100mmol/L NaCl,1mmol/L EDTA, pH8.0)混匀, 涡旋 1min。加 60μL 溶菌酶, 涡旋 10s, 置于 37°C 水浴锅水浴 30min, 每10min摇晃一次。加入 60μL 10%的 SDS, 混匀, 加6μL蛋白酶K, 涡旋10s, 65°C水浴20min, 每10min摇晃一次。1400g条件下离心15min, 吸取上清液于新的离心管中。加600μL 酚 ∶ 氯 仿 ∶ 异戊醇(25∶24∶1), 混匀后在 15294g转速下离心 10min。吸取上清液转入新的离心管, 加 600μL 酚 ∶ 氯 仿 ∶ 异戊醇(25∶24∶1), 混匀后在 15294g转速下离心 10min,重复此步骤两次。加入2倍体积无水乙醇, -20°C过夜。之后采用细菌基因组提取试剂盒的方法过柱处理。提取好的 DNA采用 Nanodrop 2000(Thermo Fisher, 美国)测定其浓度, 将合格样品(OD260/280=1.8—2.0, 浓度≥50ng/μL, 总量≥2μg)送至诺禾致源公司(北京)进行高通量测序。
1.3 PCR扩增及扩增产物的纯化
取适量 DNA于离心管中, 使用无菌水稀释样品至 1ng/μL, 以稀释后的基因组 DNA为模板, 选择加入Barcode 标签的341F(CCTACGGGNGGCWGCAG)和 805R(GACTACHVGGGTATCTAATCC)作为引物,利用高效高保真酶(New England Biolabs, NEB)扩增16S rRNA基因V3-V4区。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测; 根据 PCR产物浓度进行等量混样, 充分混匀后使用 2%的琼脂糖凝胶电泳检测混合的PCR产物, 利用胶回收试剂盒(QIAGEN)对目的条带进行回收。
1.4 文库构建和上机测序
使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒(Illumina)进行文库构建, 构建好的文库经过Qubit和Q-PCR定量, 使用HiSeq2500(诺禾致源公司, 北京)进行测序。
1.5 测序数据的处理与分析
1.5.1 高通量序列的处理 采用 Illumina HiSeq测序平台得到原始数据(raw data), 然后进行拼接和质控, 得到有效数据(clean data), 再进行嵌合体过滤,得到可用于后续分析的有效数据(effective tags)。然后,基于有效数据进行OTUs(operational taxonomic units)聚类。
1.5.2 统计分析 利用 Uparse软件对所有样品的全部effective tags进行聚类, 以97%的一致性将序列聚类成OTUs。根据OTUs聚类结果, 对每个OTU的代表序列做物种注释, 得到对应的物种信息, 根据物种注释结果, 选取每个样品在门、纲、目、科、属 5个分类级别上最大丰度排名前 10的物种, 生成物种相对丰度柱形累加图。分别统计了雌雄虾养殖水体的所有样品中均存在的 OTU, 找出其核心微生物菌群(core microbiome, 指两个或多个与某一特定环境相关的微生物集群中所共有的成员)(Turnbaugh et al,2007)。从物种分类信息和样品间差异两个层面进行聚类并绘制成热图(heatmap)。采用热图对核心微生物群在各分类水平上进行可视化展示。进一步对OTUs进行丰度分析、α-多样性(alpha diversity)和β-多样性计算等, 以得到样品内物种丰富度和均匀度信息等。α-多样性用于分析样品内的微生物群落多样性(Holmström et al,1999), 通过单样本的多样性分析可以反映样品内微生物群落的丰富度和多样性。使用Qiime软件(Version 1.7.0)计算 α-多样性指数, 包括Observed-species, Shannon, Simpson, Chao1, ACE,Goods-coverage指数。对不同样品在97%一致性阈值下的 α-多样性分析指数进行统计。β-多样性研究中,基于weighted unifrac距离和unweighted unifrac距离进行了主坐标分析(Principal Coordinates Analysis,PCoA)分析, 并选取贡献率最大的主坐标组合进行作图展示。LEfSe(LDA Effect Size)分析能够在组与组之间寻找具有统计学差异的 Biomarker(Segata et al,2011), 即组间差异显著的物种。利用LEfSe软件进行数据分析, 并采用 LDA值分布柱状图和进化分支图(系统发育分布)来展示LEfSe的统计结果。为进一步挖掘分组样品间的群落结构差异, 选用 T-test、Metastats、Anosim和MRPP等统计分析方法对分组样品的物种组成和群落结果进行差异显著性检验。同时, 结合环境因素进行CCA/RDA分析和多样性指数与环境因子的相关性分析, 得到显著影响组间群落变化的环境影响因子。
2 结果与分析
2.1 高通量测序数据
从雌雄虾池获取的6个水样(X1.1、X2.2、X3.2、C1.2、C2.2、C3.2))经过Illumina HiSeq2500平台测序后分别得到各自的下机数据Raw PE, 经过拼接和质控后得到 Clean Tags, 经过嵌合体过滤后得到 Effective Tags。6个水样经高通量测序后共得到230398条可用于分析的序列, 包含4603条频数为1且无法被聚类到OTUs的序列, 3条没有获得注释信息的序列和225792条可用于构建 OTUs并且获得注释信息的序列。以97%的一致性, 将每个样品所得的序列聚类成 OTU,其中雄虾池3个样品的平均OTU数目为396; 雌虾池3个样品的平均OTU数目为475。根据物种注释情况,统计每个样品注释到各分类水平上的序列数目, 在门、纲、目、科、属、种 6个水平上, 雄虾养殖水体序列数分别平均为 41583、41463、411494、40709、2496和 148条; 雌虾养殖水体序列数分别平均为33578、33512、32981、32295、7823和113条。
2.2 雌雄虾养殖水体细菌群落特征
2.2.1 物种相对丰度展示 对于雄虾养殖水体,优势门中变形菌门 (Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)的相对丰度分别为76.15%、21.28%和1.65%; 优势纲中α-变形菌纲(Alphaproteobacteria)、Saprospirae、γ-变形菌纲(Gammaproteobacteria)、Flavobacteriia和放线菌纲(Actinobacteria)的相对丰度分别为73.11%、19.89%、2.30%、1.29%和 1.42%; 优势目中红杆菌目(Rhodobacterales)、腐螺旋菌目(Saprospirales)、放线菌目(Actinomycetales)和黄杆菌目(Flavobacteriales)的相对丰度分别为71.24%、19.89%、1.42%和1.29%;优势科中红杆菌科(Rhodobacteraceae)和腐螺旋菌科(Saprospiraceae)的相对丰度分别为71.20%和19.89%;优势属Pseudoruegeria和Marivita的相对丰度分别为2.02%和 1.43%。对于雌虾养殖水体, 优势门变形菌门、拟杆菌门和放线菌门的相对丰度分别为66.01%、29.02%和3.82%; 优势纲中α-变形菌纲、Saprospirae、Flavobacteriia、γ-变形菌纲和放线菌纲的相对丰度分别为 58.93%、19.14%、9.14%、5.51%和 3.48%; 优势目中红杆菌目、腐螺旋菌目、黄杆菌目和放线菌目的相对丰度分别为53.87%、19.14%、9.14%和3.48%;优势科中红杆菌科、腐螺旋菌科、Cryomorphaceae的相对丰度分别为53.76%、19.11%和4.87%; 优势属Pseudoruegeria、Marivita、HTCC2207和 Sediminicola的相对丰度分别为8.41%、5.33%、2.03%和1.80%。图1是选取门(图1a)和属(图1b)水平最大丰度排名前10的物种生成的物种相对丰度柱形图, 从图中可知,雌雄虾养殖水体中丰度最高的 2个门均是变形菌门和拟杆菌门, 丰度最高的2个属均是Pseudoruegeria和 Marivita。
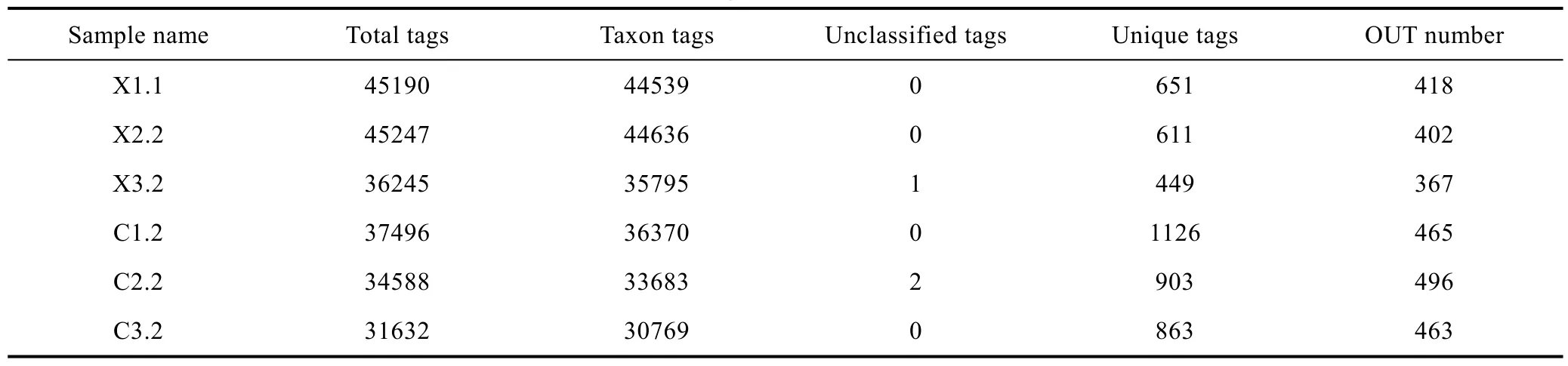
表1 Tags和OTUs数目统计表Tab. 1 Tags and OTUs number
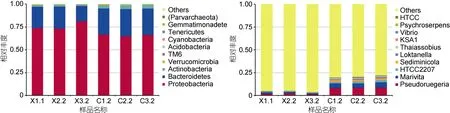
图1 样品在门水平(a)和属水平(b)物种相对丰度Fig. 1 Relative abundance of species in phylum (a) and genus (b) level注: Others表示图中这10个门(属)之外的其他所有门(属)的相对丰度之和。
2.2.2 核心微生物群落 核心微生物分析表明,雌雄虾养殖水体的核心OTU数目分别为475和396。图2是核心微生物群在属水平上的热图。从图中可以看出, 雌雄虾养殖水体的核心微生物群(属水平)明显不同。雄虾养殖水体的核心属主要包括Glaciecola、Octadecabacter、Methylobacterium、Psychroserpens、Olleya; 雌虾养殖水体的核心属主要包括Thalassomonas、Thalassobius、Marinicella、Fluviicola、Sediminicola、Marivita、Pseudoruegeria、HTCC2207、Pseudomonas、Vibrio、Synechococcus、Owenweeksia等, 其中 Vibrio、Pseudomonas和 Owenweeksia等属中包含了部分对虾病原菌或条件性致病菌种类。
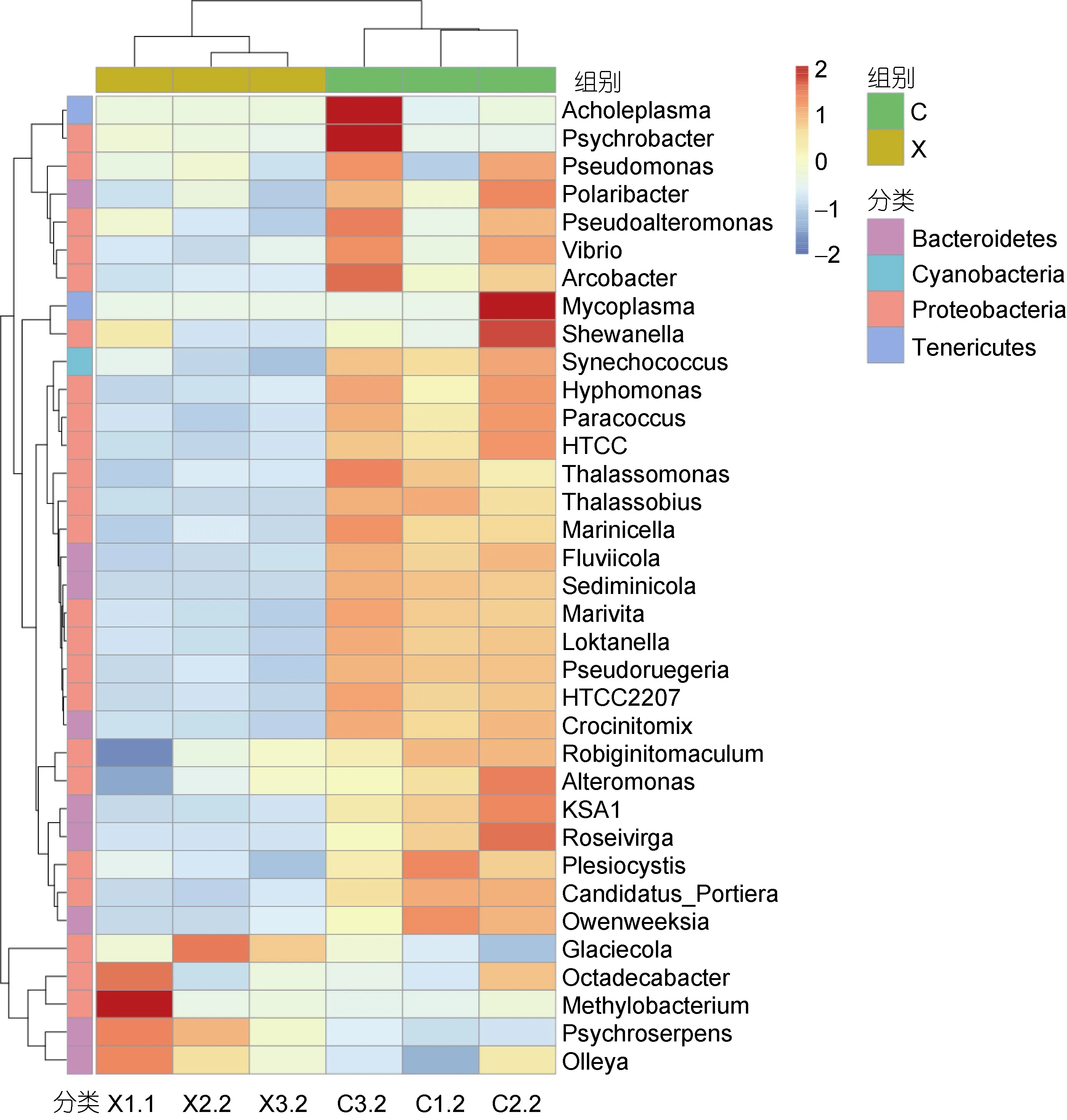
图2 核心微生物群在属水平上的热图Fig. 2 The heatmap of core microbiome in genus level注: 图中横向为物种注释信息, 纵向为样品信息, 左侧的聚类树为物种聚类树, 上方的聚类树为样品组间的聚类树, 中间热图对应的值为每一行物种相对丰度经过标准化处理后得到的Z值(即一个样品在某个分类上的Z值为样品在该分类上的相对丰度和所有样品在该分类的平均相对丰度的差除以所有样品在该分类上的标准差所得到的值)。
2.2.3 雌雄虾养殖水体细菌群落的 α-多样性 如表 2所示, 雌虾池 3个样品(C1.2、C2.2、C3.2)群落丰度指数ACE指数(471.484、495.638和444.435 )和Chao1指数(458.628、488和428.484)略高于雄虾池3个样品(X1.1、X2.2、X3.2)的 ACE 指数(486.375 、422.907 和 376.52 )和 Chao1 指数(447.939 、387.511和 353.13 )。雌虾池 3个样品(C1.2、C2.2、C3.2)的Shannon多样性指数和Simpson多样性指数也略高于雄虾池3个样品(X1.1、X2.2、X3.2)。比较雌雄虾养殖水体细菌群落的 α-多样性指数得知, 雌虾养殖水体细菌群落多样性和丰度均高于雄虾水体。对雌雄虾养殖水体细菌群落α-多样性指数进行T-test检验得知,Chao1、ACE和 Goods-coverage指数无显著差异(P>0.05); Observed-species、Shannon和 Simpson指数差异显著(P<0.05)。
2.2.4 细菌群落结构的相似性分析 基于 weighted unifrac和 unweighted unifrac主坐标分析时, 前两个主坐标的累计方差贡献率分别为98.42%和64.58%。其中, 在weighted unifrac主坐标分析中, 第一主坐标PC1和第二主坐标PC2分别占总变异来源的91.39%和7.03%。对雌雄虾养殖水体细菌群落β-多样性指数进行T-test检验得知, 基于weighted unifrac分析, β-多样性无显著差异(P>0.05); 基于unweighted unifrac分析, β-多样性差异显著(P<0.05)。从LDA值分布柱状图(图 4a)可以看出, Alphaproteobacteria、Proteobacteria、Rhodopbacterales、Rhodopbacteraceae、Actinomycetales、Actinobacteria、Rickettsiales、Pelagibacteraceae等是雌雄虾养殖水体中差异显著的物种。在雄虾养殖水体中, Alphaproteobacteria、Proteobacteria、Rhodopbacterales、Rhodopbacteraceae
的 LDA值均接近于 4.8; 而对于雌虾养殖水体而言,Flavobacteriales、Bacteroidetes、Flavobacteriia、Pseudoruegeria等LDA值均接近于4.8。由进化分支图(图 4b)知, Cryomorphaceae、Flavobacteriaceae、Flavobacteriales、Flavobacteriia在进化上属于同一个门 Bacteroidetes; Pelagibacteraceae、Rickettsiales、Rhodopbacterales、 Rhodopbacteraceae、Alphaproteobacteria、 Gammaproteobacteria、Alteromonadales在进化上属于同一个门Proteobacteria; 而Actinomycetales在进化上属于单独的一个门 Actinobacteria。Actinomycetales、Cryomorphaceae、Flavobacteriaceae、Flavobacteriales、Flavobacteriia、Rickettsiales、Alteromonadales、Pelagibacteraceae、Gammaproteobacteria是雌虾养殖水体中的重要微生物类群; 而 Rhodopbacterales、Rhodopbacteraceae、 Alphaproteobacteria、Proteobacteria是雄虾养殖水体的重要微生物类群。
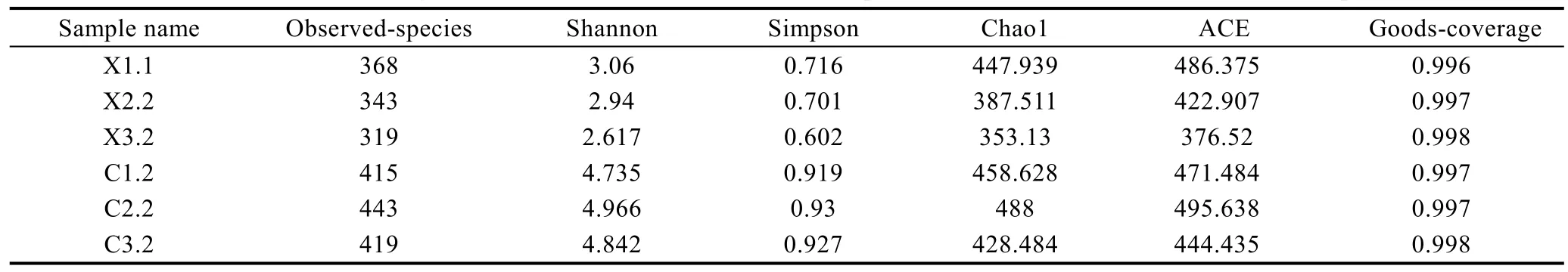
表2 雌雄虾养殖水体细菌群落α-多样性指数Tab. 2 α-diversity indices of bacterial communities in aquaculture water of male and female shrimp

图3 基于Weighted Unifrac距离(a)和Unweighted Unifrac距离(b)的主坐标分析Fig. 3 Principal Coordinates Analysis in weighted unifrac distance (a) and unweighted unifrac distance (b)注: 横坐标表示第一主成分, 百分比则表示第一主成分对样品差异的贡献值; 纵坐标表示第二主成分, 百分比表示第二主成分对样品差异的贡献值; 图中的每个点表示一个样品, 其中, 黑色方块代表雌虾水体样品, 红色圆圈代表雄虾水体样品, 同一个组的样品使用同一种颜色表示
3 讨论
高通量测序技术在宏基因组学(Metagenomics)的研究中具有重大意义, 宏基因组学又称为微生物环境基因组学、元基因组学, 是一门直接研究自然环境下微生物群落(包含了可培养的和不可培养的细菌、真菌和病毒等基因组的总和的学科)(Shade et al,2012)。宏基因组学研究的对象不是某特定的微生物或其细胞中的总 DNA, 而是特定环境中的总 DNA,不需要对微生物进行分离培养和纯化, 可以全面地对微生物进行分析, 对于我们认识和利用未培养微生物提供了一条新的途径。本研究提取了凡纳滨对虾养殖水体微生物宏基因组 DNA, 采用 Illumina HiSeq2500测序平台分析了凡纳滨对虾养殖水体菌群多样性。得到有效序列 31632—45190条, 可归纳为367—496个分类操作单元。基于测序数据, 评估了凡纳滨对虾雌雄养殖水体中细菌群落的特征, 比较了两个养殖池水体微生物多样性和群落结构的差异。雌雄虾养殖池水体细菌群落的α-多样性指数中Chao1、ACE和 Goods-coverage指数无显著差异; Observedspecies、Shannon和Simpson 指数差异显著。β-多样性指数中, 基于 weighted unifrac的 β-多样性无显著差异; 基于unweighted unifrac的β-多样性差异显著。雌雄虾养殖水体细菌群落组成有一定差异, 这可能与雌雄虾养殖池的虾数目和虾的大小有一定关系,雄虾数目多于雌虾, 但雌虾体重均高于雄虾。
雌雄虾养殖池水体的微生物物种相对丰度排列前10的分别均是变形菌门、拟杆菌门、放线菌门、疣微菌门(Verrucomicrobia)、 候选菌门(TM6)、酸杆菌门(Acidobacteria)、蓝细菌门(Cyanobacteria)、软壁菌门(Tenericutes)、芽单胞菌门(Gemmatimonadetes)和(Parvarchaeota)。变形菌门和拟杆菌门为各个样品的优势菌, 在雄虾养殖池水体中的平均相对丰度分别为 76.15%和 21.28%; 在雌虾养殖池水体中平均相对丰度分别为66.01%和29.02%。变形菌门是海洋环境和海洋沉积物中的主要类群(Whittaker, 1972)。雄虾养殖池水体中 α-变形菌纲占 73.11%, β-变形菌纲占0.23%; 雌虾养殖池水体中 α-变形菌纲占 58.93%, β-变形菌纲占0.46%。α-变形菌纲和β-变形菌纲对于多环芳烃(Polycyclic Aromatic Hydrocarbons, PAHs)具有降解作用, 可以利用PAHs进行生长(袁军, 2008)。拟杆菌门是海洋环境中的重要微生物类群, 是溶解性有机物的主要消费者(Cottrell et al, 2000)。在养殖环境中, 残留的饵料以及养殖动物的粪便在水体中未被及时分解, 便在养殖水体中沉积下来, 造成养殖池底部拟杆菌门细菌含量增加(Rosselló-Mora et al,1999)。拟杆菌门中的 Flavobacteriia纲是海水中高分子有机物的主要降解者, 雌虾养殖水体Flavobacteriia纲所占的比例(9.14%)大于雄虾养殖水体(1.29%), 这可能是因为雌虾养殖池中残留饵料较多而导致的。有机物降解菌群的大量存在可加快养殖水体中有机物的的降解, 从而减轻水产动物所面临的环境压力。疣微菌门在雌雄虾养殖水体中所占的比例分别为0.34%和0.10%。海洋环境中广泛分布着疣微菌门细菌, 其数量约占水体细菌总量的 2%, 该门类细菌大多属于不可培养的微生物, 其功能目前尚不明确(Freitas et al, 2012)。
本研究表明, 雌雄虾养殖水体的核心微生物(属水平)明显不同(图 2), 特别是雌虾养殖水体中包含了一些致病菌或条件性致病菌, 如弧菌、Pseudomonas和 Owenweeksia, 但这些属不是雄虾养殖水体的核心属。其中, 弧菌是海洋环境中常见细菌, 也是海水养殖对虾肠道的优势菌群(Gatesoupe, 1999; Oxley et al,2002)。研究表明, 弧菌对于养殖水体中有机物的降解具有重要意义, 同时也具有硝酸盐异化作用(赵晓伟等,2015)。但有些弧菌对水产动物甚至人类具有潜在致病性, 例如, 副溶血弧菌(Vibrio Parahaemolyticus)、哈维氏弧菌(Vibrio harveyi)、创伤弧菌(Vibrio vulnificus)、溶藻弧菌(Vibrio alginolyticus)、鳗弧菌(Vibrio anguillarum)等。有研究表明, 导致凡纳滨对虾养殖过程中“早期死亡综合征”(Early mortality syndrome, EMS)的病原可能是副溶血弧菌的特异变种(杨先乐等, 2005; Tran et al, 2013)。因此, 采取有效措施控制养殖环境中致病弧菌的数量对于水产动物的健康至关重要。
4 结论
本研究利用 HiSeq测序技术对凡纳滨对虾亲虾繁殖期养殖水体的微生物进行分析, 揭示了其养殖环境中微生物的多样性和丰度, 为凡纳滨对虾繁殖期亲虾养殖过程中的病害防治及新的微生物资源的开发提供基础数据。
王兴强, 马 甡, 董双林, 2004. 凡纳滨对虾生物学及养殖生态学研究进展. 海洋湖沼通报, (4): 94—100
王亭芳, 金凤杰, 马士禹等, 2012. DGGE 技术对南美白对虾养殖水体中微生物多样性的研究. 生物技术通报, (10):131—136
朱根福, 宣晓冬, 江富二, 1999. 杭州西湖水体中微生物生理群生态分布的初步研究. 生态学报, 19(3): 435—440
李 祎, 郑 伟, 郑天凌, 2013. 海洋微生物多样性及其分子生态学研究进展. 微生物学通报, 40(4): 655—668
杨先乐, 郑宗林, 2005. 南美白对虾病害流行的新动向及其思考. 淡水渔业, 35(3): 3—6
郑天凌, 王海黎, 洪华生, 1994. 微生物在碳的海洋生物地球化学循环中的作用. 生态学杂志, 13(4): 47—50
赵晓伟, 丁 君, 窦 妍等, 2015. 基于MiSeq 测序技术分析红鳍东方 鲀 养殖环境菌群多样性. 生态学杂志, 34(10):2965—2970
袁 军, 2008. 印度洋深海多环芳烃降解菌的多样性分析及降解菌新种的分类鉴定与降解机理初步研究. 厦门: 厦门大学博士学位论文, 1—2
高平平, 晁群芳, 张学礼等, 2003. TGGE分析焦化废水处理系统活性污泥细菌种群动态变化及多样性. 生态学报,23(10): 1963—1969
Cottrell M T, Kirchman D L, 2000. Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low- and high-molecularweight dissolved organic matter. Applied and Environmental Microbiology, 66(4): 1692—1697
Freitas S, Hatosy S, Fuhrman J A et al, 2012. Global distribution and diversity of marine Verrucomicrobia. The ISME Journal,6(8): 1499—1505
Holmström C, Kjelleberg S, 1999. Marine Pseudoalteromonas species are associated with higher organisms and produce biologically active extracellular agents. FEMS Microbiology Ecology, 30(4): 285—293
Kozasa M, 1986. Toyocerin (Bacillus toyoi) as growth promoter for animal feeding. Microbiologie Aliments Nutrition, 4(2):121—135
Oxley A P A, Shipton W, Owens L et al, 2002. Bacterial flora from the gut of the wild and cultured banana Prawn,Penaeus merguiensis. Journal of Applied Microbiology,93(2): 214—223
Pace N R, 1997. A molecular view of microbial diversity and the biosphere. Science, 276(5313): 734—740
Rosselló-Mora R, Thamdrup B, Schäfer H et al, 1999. The response of the microbial community of marine sediments to organic carbon input under anaerobic conditions. Systematic and Applied Microbiology, 22(2): 237—248
Segata N, Izard J, Waldron L et al, 2011. Metagenomic biomarker discovery and explanation. Genome Biology, 12(6): R60
Shade A, Handelsman J, 2012. Beyond the Venn diagram: the hunt for a core microbiome. Environmental Microbiology,14(1): 4—12
Shendure J, Ji H, 2008. Next-generation DNA sequencing. Nature Biotechnology, 26(10): 1135—1145
Tran L, Nunan L, Redman R M et al, 2013. EMS/AHPNS:infectious disease caused by bacteria. Global Aquaculture Advocate, 18—20
Torsvik V, Daae F L, Sandaa R A et al, 1998. Novel techniques for analysing microbial diversity in natural and perturbed environments. Journal of Biotechnology, 64(1): 53—62
Turnbaugh P J, Ley R E, Hamady M et al, 2007. The human microbiome project. Nature, 449(7164): 804—810
Whittaker R H, 1972. Evolution and measurement of species diversity. Taxon, 21(2—3): 213—251
