耐盐纤维素降解菌的筛选、鉴定及其配比优化的研究
2018-01-22王旭辉山其米克
王旭辉,叶 凯,徐 鑫,山其米克,王 卉,李 冠,邓 宇
(1.新疆大学生命科学与技术学院,乌鲁木齐 830046;2.新疆农业科学院生物质能源研究所,乌鲁木齐 830091;3.新疆农业科学院粮食作物研究所,乌鲁木齐 830091;4.农业部沼气科学研究所,成都 610041)
0 引 言
【研究意义】纤维素是一种含量丰富的可再生能源,在自然界中分布十分广泛。纤维素不易溶于水和一般溶剂,在环境中结构十分稳定,是很难被降解的污染物,并广泛存在于畜禽养殖粪便和农作物秸秆中[1-4]。新疆土壤盐碱化程度比较严重,面积达11×104km2,约占全国盐碱土地面积的三分之一。因此从当地自然环境中筛选和分离耐盐高效纤维素降解菌株,挖掘利用纤维素酶的酶解作用,解决当地环境污染和再生能源问题具有重要的研究意义。【前人研究进展】纤维素是由大分子多糖聚集而成,在其内部交错形成了无定形区和结晶区域[5]。纤维素酶主要包括外切葡聚糖酶、β-葡萄糖苷酶和内切型葡聚糖酶,秸秆纤维素的分解需要这三种纤维素酶协同完成[6]。虽然在前人的研究工作中,已有关于常规环境下纤维素降解菌的报道[7-9],但在盐碱环境下秸秆纤维素降解菌的研究却刚刚起步,在盐碱环境下高浓度盐碱离子不但会造成土壤渗透系数降低,而且对常规纤维素降解菌活性有强烈抑制作用,使其降解效率大大降低,因此筛选适应盐碱地区的高效耐盐纤维素降解菌十分必要;而且纤维素降解菌的产酶种类比较单一[10]。【本研究切入点】要降解天然纤维素,需要重视不同菌株之间的相互协同效应,构建高效纤维素降解复合菌系[11-12],研究从玉米秸秆堆肥的盐碱土壤分离筛选高效耐盐秸秆纤维素降解菌株,并对其降解效果及菌种配比展开响应面优化试验研究。【拟解决的关键问题】筛选出高效耐盐纤维素降解菌和玉米秸秆的最佳降解工艺,为新疆盐碱地区玉米秸秆的微生物降解提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 样品来源
在玛纳斯试验站采集玉米秸秆堆肥的盐碱土壤,放入无菌袋中于冰箱4℃冷藏[13]。
1.1.2 仪器和试剂
DNA提取试剂盒;dNTP;TaqDNA聚合酶;无水CaCl2、K2HPO4等分析纯。
超净工作台SW-CJ-2FD:上海博迅实业有限公司;SPX-160生化培养箱:江南仪器厂;恒温摇床ZWY-211B:上海智城分析仪器有限公司;高速冷冻离心机D-37520:Osterode Kendro Laboratory Products;立式压力蒸汽灭菌器LDZX-50FBS:上海申安医疗器械有限公司;PCR扩增仪C1000:Bio-Rad。
1.1.3 菌种筛选培养基
肉汁胨培养基(NA):牛肉膏 3 g,蛋白胨 5 g,酵母浸膏 2 g,葡萄糖 8 g,琼脂粉16 g,去离子水 1 L,pH=7.0。
赫奇逊氏无机盐培养基:NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO32.5 g,KH2PO41.0 g,CaCl20.1 g,加去离子水至 1 L,pH=7.2。
液体发酵培养基:在赫奇逊氏无机盐培养基中添加纤维素 20 g/L。
平板滤纸培养基:在赫奇逊氏无机盐培养基中添加琼脂粉 18 g/L,倒好平板后铺一张滤纸片在培养基表面。
种子培养基:马铃薯 200 g,切块煮沸 20 min,用细纱布过滤,添加葡萄糖 20 g,琼脂 18 g,加离子水至 1 L,120℃高压灭菌 30 min。
CMC-Na平板培养基:马铃薯 200 g,切块煮沸 20 min,用细纱布过滤,再加CMC-Na 10 g,琼脂 18 g,加去离子水至 1 L,pH=7.2。
1.2 方 法
1.2.1 纤维素降解菌的富集和初筛1.2.1.1 富集
采集玉米秸秆堆肥的土壤,天平称取20 g土壤放入经过高温高压灭菌的250 mL的三角瓶中,加入150 mL无菌去离子水,混合均匀,然后在30℃生化培养箱培养12 h。取10 mL上清液置于高温高压灭菌的250 mL的三角瓶中,加入150 mL的液体培养基,在30℃生化培养箱培养3 d,取上清液10 mL至液体培养基中,重复培养3次,富集得到含有纤维素降解菌的混合菌液。
1.2.1.2 初筛
取1 mL混合菌液加入高温灭菌的250 mL的三角瓶中,加入99 mL无菌去离子水,在恒温摇床中温度30℃、转速200 r/min条件下培养4 h后,取l mL菌悬液,用无菌去离子水进行浓度稀释,取10-2、10-3、10-4不同的稀释浓度,分别均匀涂布于平板滤纸培养基上,置于30℃生化培养箱再培养3 d,挑选出在平板滤纸培养基上生长良好,且对滤纸片有降解的菌落。
1.2.2 纤维素降解菌的复筛
上述分离得到的纤维素降解菌接种于CMC-Na平板培养基中,30℃生化培养箱培养3 d,将平板中有比较明显水解圈的产酶菌株接种至NA培养基中进行再纯化后再接种到种子斜面培养基上,在30 ℃生化培养箱培养3 d,然后置于4℃冰箱保藏。
CMC-Na水解圈试验:将复筛得到的高效产酶菌株接种于CMC-Na平板培养基,培养3 d,用0.1%的刚果红水溶液浸染30 min,再用1 mol/L的NaCl溶液脱色1 h,用游标卡尺对水解圈直径(D/cm)和菌落直径(d/cm)进行测定,以Dp值表示纤维素酶的水解能力:Dp=(D/d)2。
1.2.3 纤维素酶活力的测定1.2.3.1 粗酶液制备
将复筛得到的1 mL菌液加入灭菌的150 mL三角瓶,加入49 mL液体发酵培养基,于30℃恒温摇床中200 r/min培养3 d,收取培养液至50 mL离心管中,高速冷冻离心机4℃、4 000 r/min离心15 min,离心管的上清液为粗酶液。
1.2.3.2 CMC酶活测定
将10 g CMC加入1 000 mL灭菌去离子水,混匀,吸取1.5 mL混合液加入到25 mL试管中,再加入0.5 mL粗酶液,摇匀后立即放入30℃水浴锅中反应1 h。然后加入1.5 mL DNS终止酶解反应,沸水浴中反应10 min,自然冷却后加入离子水定容至20 mL。用紫外分光光度计测定其在540 nm波长下的吸光值[14]。
1.2.4 耐盐纤维素降解菌的筛选
利用添加1%、3%、5%、7%的NaCl浓度逐级筛选耐盐高效纤维素降解菌株。将筛选的高效纤维素降解菌在CMC-Na平板培养基上划线培养,30℃生化培养箱培养3 d,选取在不同盐浓度生长良好的单菌落,经划线纯化的菌种在30℃生化培养箱培养3 d,然后置于4℃冰箱保藏。耐盐纤维素降解菌多呈淡黄、淡粉、乳白色菌落,菌体多为杆状或球状,菌体在去离子水种放置1 d,在光学显微镜下观察无破壁与变形状态。
1.2.5 菌种鉴定
对筛选得到的4株高效耐盐纤维素降解菌进行革兰氏染色[15],对菌株的菌落结构和形态进行观察。根据《常见细菌系统鉴定手册》对4株高效耐盐纤维素降解菌进行生理生化初步鉴定[16]。
采用鼎国昌盛生物技术有限公司的细菌基因组DNA提取试剂盒进行秸秆纤维素降解菌总DNA的提取,采用细菌PCR的通用引物1 492R和27F进行16S rRNA片段的扩增,PCR 扩增反应体系(50 μL)包括: DNA模板2 μL,5 U/μLTaq酶0.25 μL,2.5 mmol/L dNTPs 混合溶液 4 μL,10 mmol/L引物各1 μL,10×PCR 缓冲溶液 5 μL,ddH2O 36.75 μL,PCR反应条件为:94℃预变性9 min,94℃变性50 s,52℃退火40 s,72℃延伸70 s,32个循环,最后在72℃继续延伸6 min,4℃冰箱保存。4株高效耐盐纤维素降解菌的PCR产物用琼脂糖凝胶电泳检测,回收后送到上海生工进行双向测序。将测序结果导入GenBank数据库中,通过数据库分析确定4株耐盐高效纤维素降解菌的种属。
1.2.6 单菌最优添加量以及菌种配比的响应面优化
1.2.6.1 单因素试验
将筛选得到4株耐盐高效纤维素降解菌进行活化,将菌液加入离心管中5 000 r/min离心5 min,弃除上清液,收集沉淀的菌体在无菌环境下常温干燥24 h制成固体微生物菌剂,将固体菌剂WH2、WH4、WH7和WH9常温条件下储存备用。以4株菌的接种量为单因素进行试验确定纤维素降解的最佳因素水平。准确称重2.00 g的玉米秸秆粉,按不溶性碳为2%的量配制赫奇逊氏无机盐培养基,将降解菌剂WH2、WH4、WH7和WH9分别接入上述培养基培养。WH2分别接种0.1、0.2、0.3、0.4和0.5 g时,另外三种降解菌初始添加量为0.1 g;WH4分别接种0.1、0.2、0.3、0.4和0.5 g时,WH2添加单因素筛选的最佳量,另外两种降解菌初始添加量为0.1 g;WH7和WH9按照以上方法接种。在30℃,200 r/min条件下振荡培养,在第7 d取出秸秆纤维素样品,将残余物置于80℃烘箱烘干并称重,采用改进的Van Soest洗涤法测定样品失重率[17-19]。玉米秸秆纤维素降解率公式如下:
W=(S-S1)/S×100%.
(1)
式中W代表秸秆降解百分比,S代表秸秆的原始干重,S1秸秆降解后的烘干量。
1.2.6.2 响应面优化
以BBK的中心组合试验设计方式为基础[20-22],结合单因素试验的结果设计四因素三水平的响应面分析法,分别选取纤维素降解菌株WH2、WH4、WH7和WH9的接种量作为自变量,以秸秆纤维素降解率作为响应值设计响应面试验,水平和因素取值。表1
表1 响应面法设计因素和水平
Table 1 Response surface methodology design factors and levels

编码水平Codinglevel因素 FactorA菌种WH2StrainsWH2(g)B菌种WH4StrainsWH4(g)C菌种WH7StrainsWH7(g)D菌种WH9StrainsWH9(g)-102010201003020302104030403
2 结果与分析
2.1 菌种的初筛和复筛
从玉米秸秆堆肥的盐碱土壤中分离纯化得到10株纤维素降解菌,分别标记为WH1~WH10,这些纤维素降解菌对玉米秸秆纤维素均具有一定的降解能力。然后以不接菌的赫奇逊氏培养基为对照组,以玉米秸秆粉为惟一碳源,对所筛选得到的WH1~WH10进行纤维素降解能力测定,通过纤维素降解率公式(1)计算得各菌株的降解效果。结果表明,经7 d培养后,不同降解菌的纤维素降解能力差异十分明显,降解率最低的只有4.9%,而降解率最高达到32.6%,其中共有4株纤维素降解菌的降解率大于20%,选取菌株WH2、WH4、WH7和WH9为高效纤维素降解菌。表2
2.2 纤维素降解能力测定
将筛选获得的10株纤维素降解菌进行CMC-Na水解和纤维素酶活试验。结果表明,WH4菌株的Dp=64.85,纤维素酶活为28.42 U/mL,均为最高值,结果表明,菌株WH4具有最强的纤维素水解能力和纤维素酶活。表3
表2 10株细菌对纤维素的降解能力
Table 2 The ability of degrading cellulose of 10 strains

菌株Strains降解率Degradationrate(%)菌株Strains降解率Degradationrate(%)WH197WH6111WH2253WH7272WH349WH8145WH4326WH9291WH5158WH10168
表3 10株纤维素降解菌在 CMC-Na 固体培养基上的降解能力
Table 3 Degradation of ten cellulose-degrading strains in CMC-Na medium

菌株Strains菌落直径Colonydiameterd(mm)水解圈直径HydrolyzedloopdiameterD(mm)水解能力Dp纤维素酶活Cellulaseactivity(U/mL)WH12474951848WH22314942001886WH32459604698WH43830664852842WH52812319301286WH619651170965WH74127745642025WH83213116761164WH93628261362568WH104219321121420
2.3 耐盐能力测定
利用在培养基中添加1%、3%、5%、7%的NaCl浓度逐级筛选耐盐高效纤维素降解菌株。研究表明,1%盐浓度下10株降解菌都能很好的生长;盐浓度达到3%,WH1和WH6不能正常生长;盐浓度达到5%,只有WH9能很好生长;盐浓度达到7%,所有菌株都不能正常生长;菌株WH9具有最佳的耐盐性,可以耐5%盐浓度。表4
2.4 菌种鉴定结果
分别采用生理生化实验与形态学观察相结合的方法对4株高效降解菌株WH2、WH4、WH7和WH9进行鉴定,研究表明,WH2和WH7有芽孢,为革兰氏阳性菌;WH4和WH9没有芽孢,为革兰氏阴性菌,其形态特征都为杆状。表5
研究表明,4株耐盐纤维素高效降解菌PCR产物在1 500 bp处均有明显条带,符合序列测定要求。将回收的PCR产物送到上海生工进行双向测序,得到WH2、WH4、WH7和WH9的16S rRNA的序列。通过BLAST进行同源性比较确定4株耐盐高效纤维素降解菌WH2、WH4、WH7和WH9分别是蜡样芽孢杆菌(Bacilluscereus)、荧光假单胞菌(Pseudomonasformosensis)、枯草芽孢杆菌(Bacillussubtilis)和松嫩假单胞菌(Pseudomonassongnenensis)。图1
表4 耐盐菌株在含盐平板上生长情况
Table 4 Growth of salt tolerant bacteria on salt medium
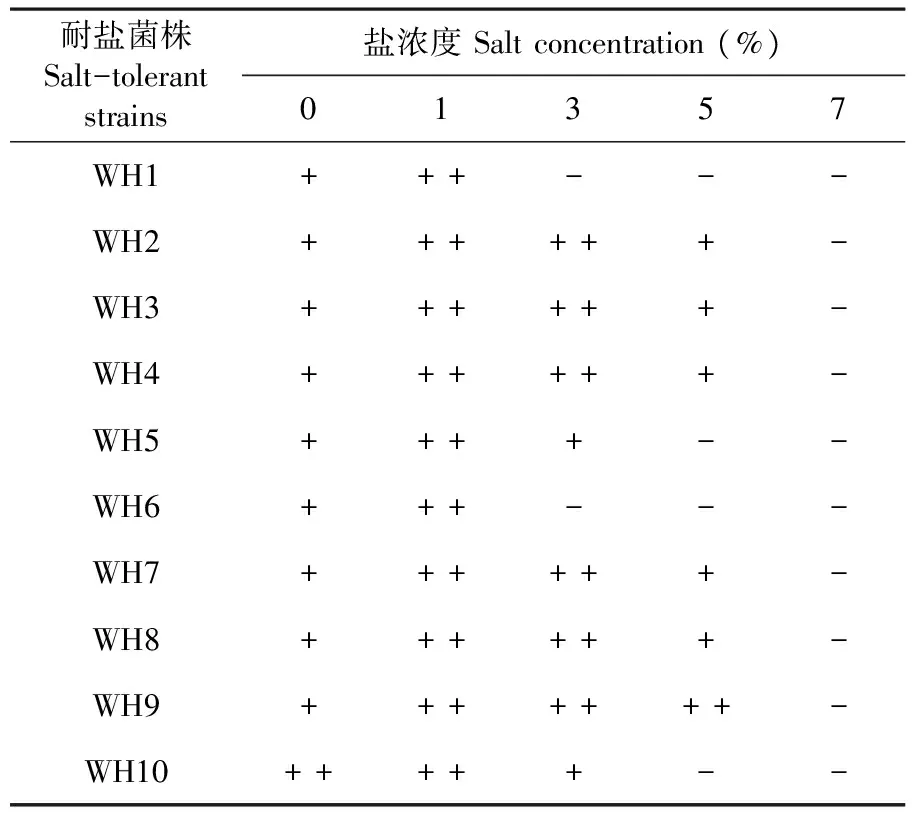
耐盐菌株Salt-tolerantstrains盐浓度Saltconcentration(%)01357WH1+++---WH2++++++-WH3++++++-WH4++++++-WH5++++--WH6+++---WH7++++++-WH8++++++-WH9+++++++-WH10+++++--
注:“ + ”代表菌株在含盐平板上正常生长,“ - ”代表菌株在含盐平板上生长受抑制或基本不生长
Note: "+" indicates that the strain grows normally on the salt-containing plate,and "-" means that the strain is inhibited from growing or does not grow substantially on the salt-containing plate
表5 四株耐盐纤维素降解菌的生理生化特征
Table 5 Physiological and biochemical characteristics of four salt tolerant cellulose-degrading strains

鉴定项目IdentificationprojectWH2WH4WH7WH9菌体形状Strainsshapes杆状杆状杆状杆状革兰氏染色Gramstaintest+-+-芽孢Sporestest+-+-明胶水解Gelatinhydrolysistest+-+-M-R试验M-Rtest+-+-吲哚试验Indoletest----V-P试验V-Ptest+-+-过氧化氢酶Catalasetest++-+淀粉水解Starchhydrolysistest++++葡萄糖Glucosetest----乳糖Lactosetest----
注: 符号‘-’代表阴性反应;‘+’代表阳性反应
Note: The symbol '-' represents the negative reaction; '+' represents the positive reaction

图1 四株高效降解菌琼脂糖凝胶电泳图
Fig.1 The electrophoresis of PCR product of four cellulose-degrading strains
2.5 单因素试验以及响应面对菌种配比的优化结果
2.5.1单因素试验结果
当赫奇逊氏无机盐培养基中秸秆纤维素添加量为2.0 g,对所分离到的4株耐盐高效纤维素降解菌进行纤维素降解率测定,各菌株的降解率显示,经过7 d的培养,不同菌株的降解率差异显著,WH4降解率最高,WH2降解率最低,菌种WH2、WH4、WH7和WH9的最佳添加量分别是0.3、0.2、0.3和0.2 g时有最高降解率,玉米秸秆纤维素的降解率分别达到了34.2%、45.4%、36.9%和39.8%。图2
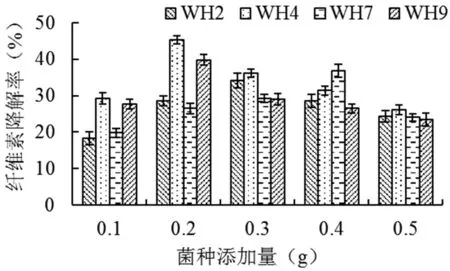
图2 4株降解菌单因素试验效果
Fig.2 Effect of Single Factor Test of four cellulose-degrading strains
2.5.2 响应面法试验设计及结果
利用BBK的中心组合原理设计响应面优化试验,以高效耐盐纤维素降解菌WH2、WH4、WH7和WH9添加量为自变量,以玉米秸秆纤维素降解率为响应值,设计四因素三水平的响应面分析试验。响应面法试验设计与试验结果表明,在29组实验预测数据中,降解率最低为51.32%,降解率最高为61.17%,再用Design-Expert 8.0.5.0软件对表6试验结果进行多元拟合的回归分析。表6
表6 响应面设计与试验结果
Table 6 Response surface design and results

试验编码TestcodeA:WH2(g)B:WH4(g)C:WH7(g)D:WH9(g)降解率Degradationrate(%)1-1-10051.3221-10052.093-110052.924110055.24500-1-151.516001-151.78700-1152.818001155.009-100-151.5010100-152.2211-100153.2412100155.49130-1-1051.301401-1051.82150-11052.6216011054.9017-10-1051.921810-1052.4819101053.7220101055.73210-10-151.0022010-151.52230-10152.4424010154.7225000061.0026000060.9427000060.8228000060.6129000061.17
2.5.3 响应面法优化
采用Design-Expert 8.0.5.0软件对所得数据进行多元回归拟合,其方差分析结果见表7。对响应值与各个因素进行多元拟合,该模型对应的回归方程:
为了检验方程的有效性,对纤维素降解率的数学模型进行方差分析,结果表明,纤维素降解率的显著性检验F=179.69,该模型效应极显著(P<0.000 1),表明方程高度显著。该模型的R2Adj为0.988 9,说明模型能反映98.89%响应值的变化,因而该模型拟合程度较高,能很好的说明纤维素降解率与WH2、WH4、WH7和WH9关系,因此可以用此模型对纤维素降解率进行预测与分析。表7各因素之间存在交互作用,其中一次项A、B、C、D、二次项A2、B2、C2、D2以及交互项BD、CD、BC都是极显著的。表7
表7 回归模型方差
Table 7 The variance analysis of regression model

方差来源Sourcesofvariance平方和Sumofsquares自由度Degreeoffreedom均方MeansquareFvaluePvalue模型Model3168514226317969<00001A63116315008<00001B88418847019<00001C1180111809369<00001D16571165713154<00001AB056105644700530AC049104938900686AD064106450800407BC081108164300238BD081108164300238CD090109071700181A284651846567208<00001B21234511234598011<00001C298031980377829<00001D21137411137490305<00001残差Residual17614013失拟项LackofFit1561001631301416纯误差PureError02040050总和CorTotal3186128
2.5.4 响应面及等高线
研究表明,回归模型方差分析中P值可知,交互项BD、CD、BC都是极显著。在图3中,交互项BD、CD、BC交互关系用等高线图和响应面曲面图表示,等高线图呈椭圆形,响应曲面图均为开口向下的凸形曲面,说明响应值(纤维素降解率)存在极高值,若曲线越陡峭,则表明该两因素交互作用对纤维降解率的影响越大,相应表现为响应值变化的大小。表7
对回归方程就行回归分析,预测纤维素降解的最佳条件:当纤维素添加量为2.0 g时,菌种WH2、WH4、WH7和WH9接种量分别为0.31、0.21、0.32和0.22 g,在此条件下纤维素降解率的理论值为61.17%,试验值为60.90%,试验值与理论值相差0.27%,证明了响应面优化法的有效性和可行性。图3
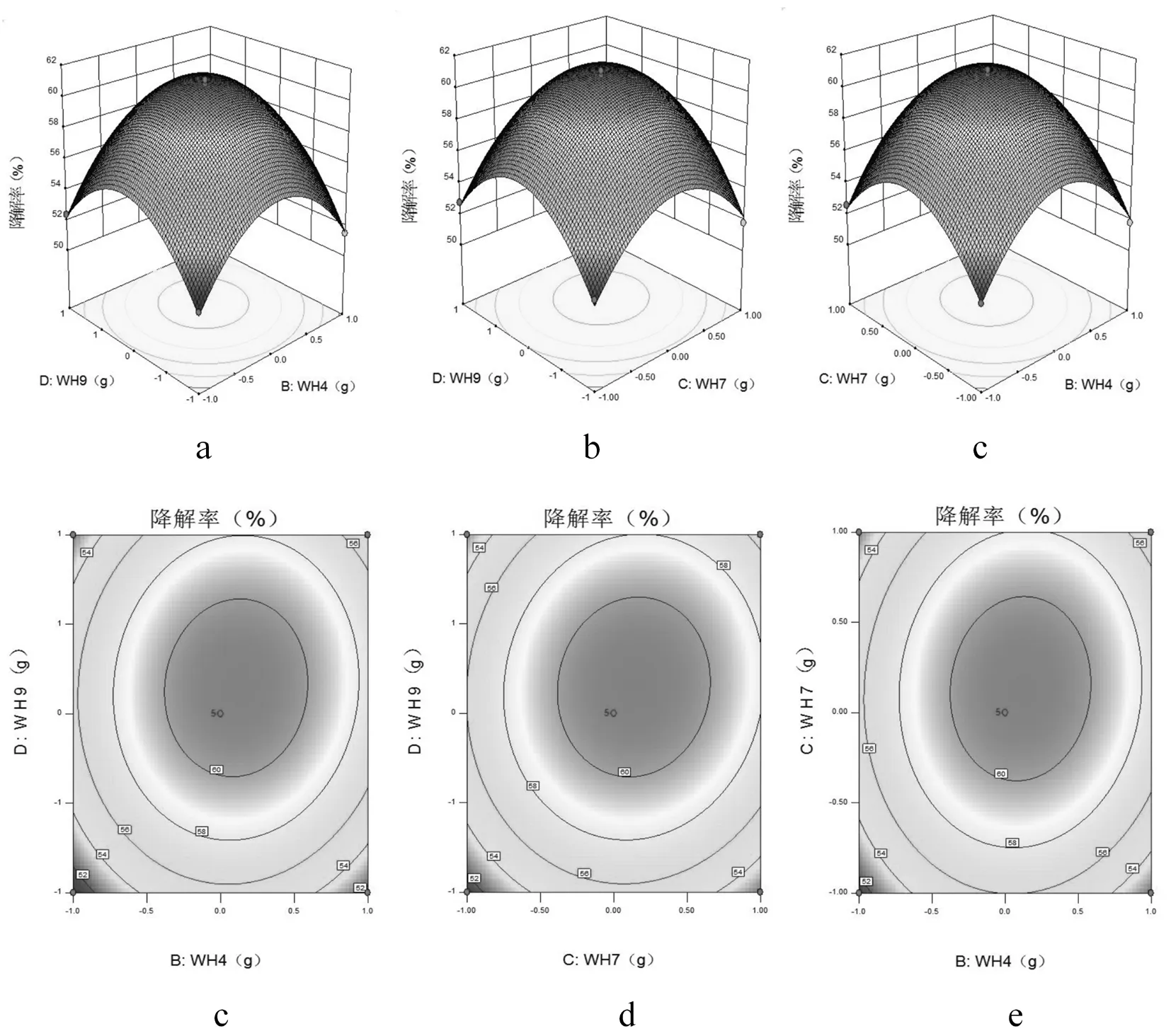
图3 四因素交互影响的响应面
Fig.3 Response surface and contour plots showing the interactive effects of four factors
3 讨 论
自然状态下的纤维素降解过程十分缓慢,一般通过筛选高效降解菌来提高纤维素的降解效率。刘晓梅等[23]从堆肥的土壤中筛选出一株高效的纤维素降解菌,通过该菌株的添加明显提高堆肥温度和纤维素降解速度。由于新疆三分之一土地为盐碱地,耐盐菌是该地区具有重要开发价值的微生物资源,耐盐纤维素降解菌在污染治理、废水处理、农业生产及再生能源利用等方面应用前景十分广阔。试验从盐碱环境下筛选分离出4株高效耐盐纤维素降解菌株,对其耐盐能力和纤维素降解率进行了测定,2株革兰氏阴性菌耐盐能力和降解效果普遍高于2株革兰氏阳性菌。
在秸秆纤维素的降解过程中,混合菌的降解效果往往优于单菌株。冯忻等[24]从土壤中筛选出5株高效的纤维素降解菌,5株高效菌种混合的CMC酶活为3.18 U/mL,显著高于单菌的酶活。试验在单因素试验的基础上,首次采用响应面法对高效耐盐纤维素降解菌种的配比进行优化,优化后的复合菌对纤维素的降解效率提升十分明显。响应面方法具有实验周期短、实验次数少和精度高等优点,可快速准确地确定多因素系统的最优条件。
4 结 论
采用连续富集筛选的方法,从玉米秸秆堆肥的盐碱土壤中得到4株耐盐高效纤维素降解菌株。经鉴定4株菌分别为蜡样芽孢杆菌(Bacilluscereus)、荧光假单胞菌(Pseudomonasformosensis)、枯草芽孢杆菌(Bacillussubtilis)和松嫩假单胞菌(Pseudomonassongnenensis)。
实验获得最佳工艺条件为:当纤维素添加量为2.0 g,菌种WH2、WH4、WH7和WH9接种量分别为0.31、0.21、0.32和0.22 g时,秸秆纤维素降解率达到最大值,在该条件下纤维素降解率预测值为61.17%,验证值为60.90%。
)
[1] Rodrigues, A. C., Boroski, M., Shimada, N. S., Garcia, J. C., Nozaki, J., & Hioka, N. (2008). Treatment of paper pulp and paper mill wastewater by coagulation-flocculation followed by heterogeneous photocatalysis.JournalofPhotochemistry&PhotobiologyAChemistry, 194(1):1-10.
[2] Georgakakis, D., & Krintas, T. (2000). Optimal use of the hosoya system in composting poultry manure.BioresourceTechnology, 72(3): 227-233.
[3] 陈子爱,邓小晨. 微生物处理利用秸杆的研究进展 [J].中国沼气,2006,24(3):31-35.
CHEN Zi-ai,DENG Xiao-chen. (2006). Progress in microbiologic utilization of crop straw [J].Chinabiogas,24(3):31-35. (in Chinese)
[4] 李平,王焰新,刘琨,等. 高效纤维素降解菌系的构建 [J].地球科学(中国地质大学学报),2009,(3):533-538.
LI Ping,WANG Yan-xin,LIU Kun,et al. (2009). Construction of A Microbial System or Efficient Degradation of Cellulose [J].Chinabiogas,(3):533-538. (in Chinese)
[5] Petersson, L., Kvien, I., & Oksman, K. (2007). Structure and thermal properties of poly(lactic acid)/cellulose whiskers nanocomposite materials.CompositesScience&Technology, 67(11-12): 2,535-2,544.
[6] 李燕红,赵辅昆. 纤维素的研究进展 [J].生命科学,2005,17(5):392-397.
LI Yan-hong,ZHAO Fu-kun. (2005). Research progress of cellulose [J].ChineseBulletinofLifeScience,17(5):392-397. (in Chinese)
[7] 李争明,张娟,邓中洋,等. 纤维素酶产生菌的筛选、鉴定及发酵产酶条件优化 [J].生物技术通报,2015,31(5):146-152.
LI Zheng-ming,ZHANG Juan,DENG Zhong-yang,et al. (2015). Screening,Identification and Optimization of Cellulase-producing Strains [J].BiotechnologyBulletin,31(5):146-152. (in Chinese)
[8] 陈兴,王文元,汪显国,等. 烟叶纤维素降解菌的筛选、鉴定及其产酶条件优化 [J].云南大学学报,2015,37(2):323-328.
CHEN Xing,WANG Wen-yuan,WANG Xian-guo,et al. (2015). Screening,identification of cellulose-decomposing strain from aging flue-cured tobacco leaves and optimization of its fermentation condition [J].JournalofYunnanUniversity,37(2):323-328. (in Chinese)
[9] 张丽萍,李亚冰,程辉彩,等. 一株兼性厌氧纤维素酶产生菌的筛选、鉴定及其酶学性质研究 [J].华北农学报,2010,25(6):139-143.
ZHANG Li-ping,LI Ya-bing,CHENG Hui-cai,et al. (2010). Screening and Identification of a Facultative Anaerobic Cellulase-producing Strain and Characterization of Cellulase [J].ActaAgriculturaeBoreali-Sinica,25(6):139-143. (in Chinese)
[10] 卢月霞,陈凯,李海江.一株纤维素降解细菌的筛选及产酶条件研究 [J].安徽农业科学,2007,35(12):3 631-3 644.
LU Yue-xia,CHEN Kai,LI Hai-jiang. (2007). Screening of Cellulose-degrading Bacteria and Study on its Cellulose producing Condition [J].JournalofAnhuiAgriculturalSciences,35(12):3,631-3,644. (in Chinese)
[11] Haruta, S., Cui, Z., Huang, Z., Li, M., Ishii, M., & Igarashi, Y. (2002). Construction of a s
Table microbial community with high cellulose-degradation ability.AppliedMicrobiology&Biotechnology, 59(4-5): 529-534.
[12] 吴俊妹,马安周,崔萌萌,等.降解纤维素产甲烷的四菌复合系 [J].环境科学,2014,35(1):327-333.
WU Jun-mei,MA An-zhou,CUI Meng-meng,et al. (2014). Screening of Cellulose-degrading Bacteria and Study on its Cellulose producing Condition [J].EnvironmentalScience,35(1):327-333. (in Chinese)
[13] 王旭辉,晁群芳,徐鑫,等. 高效石油降解菌的筛选、鉴定及其配比优化的研究 [J].工业安全与环保,2013,2(10):42-46.
WANG Xu-hui,CHAO Qun-fang,XU Xin,et al. (2013). Bioconversion of Cellulose to Methane by a Consortium Consisting of Four Microbial Strains [J].IndustrialSafetyandEnvironmentalProtection,2(10):42-46.(in Chinese)
[14] 孔雅丽,贾辉,王生荣,等.一株东祁连山耐低温纤维素降解菌株的分离、鉴定及产酶特性[J].工业微生物,2014,44 (1) :60-66.
KONG Ya-li,JIA Hui,WANG Sheng-rong,et al. (2014). Isolation,identification and characterization of a cold-adapted cellulose degrading strain from eastern Qilian mountains industrial microbiology [J].IndustrialMicrobiology,44 (1): 60-66(in Chinese)
[15] 王平宇,张树华.硅酸盐细菌的分离及生理生化特性的鉴定 [J].南昌航空工业学院学报,2001,15(2):78-81.
WANG Ping-yu,ZHANG Shu-hua.(2001). Study on the Isolation Sillicate Bacteria and Its Identification of Biochemical Characteristics [J].JournalofNanchangInstituteofAeronauticalTechnology,15 (2):78-81.(in Chinese)
[16] 东秀珠,蔡妙英.常见细菌鉴定手册 [K].北京:科学出版社,2001.
DONG Xiu-zhu,CAI Miao-ying. (2001).Commonbacterialidentificationmanual[K]. Beijing: Science Press.(in Chinese)
[17] 王玉万,徐文玉. 木质纤维素固体基质发酵物中半纤维素、纤维素和木素的定量分析程序 [J].微生物学通报,1987,14 (2):35-38.
WANG Yu-wan,XU Wen-yu. (1987). Quantitative Analysis of Hemicellulose,Cellulose and Lignin in Lignocellulose Solid Substrate Fermentation [J].MicrobiologyChina,14 (2):35-38. (in Chinese)
[18] 李华,孔新刚,王俊. 秸秆饲料中纤维素、半纤维素和木质素的定量分析研究 [J]. 新疆农业大学学报,2007,30 (3):65-68.
LI Hua,KONG Xin-gang,WANG Jun. (2007). Study on Quantitative Analysis of Hemicellulose and Cellulose and Lignin in Roughage of Cereal Straw [J].JournalofXinjiangAgriculturalUniversity,30(3): 65-68. (in Chinese)
[19] 薛惠琴,杭怡琼,陈谊.稻草秸秆中木质素、纤维素测定方法的研讨[J]. 上海畜牧兽医通讯,2001,(2):15.
XUE Hui-qin,HANG Yi-qiong,CHEN Yi. (2001). Study on Determination Method of Lignin and Cellulose in Straw [J].ShanghaiJournalofAnimalHusbandryandVeterinaryMedicine,(2):15. (in Chinese)
[20] Box, G. E. P., & Behnken, D. W. (1960). Some new three level designs for the study of quantitative variables.Technometrics, 2(4): 455-475.
[21] Annadurai, G., & Sheeja, R. Y. (1998). Use of box-behnken design of experiments for the adsorption of verofix red using biopolymer.BioprocessEngineering, 18(6): 463-466.
[22] 林标声,张彭湃,杨生玉,等. 响应面分析法优化丙酮酸发酵中维生素水平 [J].食品科技,2007,(4):36-39.
LIN Biao-sheng,ZHANG Peng-pai,YANG Sheng-yu,et al. (2007). Application of Response Surface method to optimization of vitamin in levels on the fermentation of pyruvic acid [J].FoodScienceandTechnology,(4):36-39.(in Chinese)
[23] 刘晓梅,邹亚杰,胡清秀,等. 菌渣纤维素降解菌的筛选与鉴定 [J].农业环境科学学报,2015,34(7):1 384-1 391.
LIU Xiao-mei,ZOU Ya-jie,HU Qing-xiu,et al. (2015). Screening and Identification of Cellulose-Degrading Bacteria from Spent Substrate of Edible Mushroom [J].JournalofAgro-EnvironmentSciencey,34(7): 1,384-1,391.(in Chinese)
[24] 冯忻,裴宇航,周晓飞,等. 纤维素降解菌的筛选与高效混合菌群的构建 [J].西北农林科技大学学报,2012,25 (4) :30-32.
FENG Xin,PEI Yu-hang,ZHOU Xiao-fei,et al. (2012). Screening of stalk cellulose-degrading microorganism and construction of microbial community with high capacity [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition) ,25(4):30-32. (in Chinese)
