锂离子电池正极材料铁掺杂V6O13的制备及电化学性能
2018-01-20邹正光万振东韩世昌
袁 琦,邹正光,万振东,韩世昌
(桂林理工大学 材料科学与工程学院 有色金属及材料加工新技术教育部重点实验室,广西 桂林 541004)
当今,人类社会的发展面临着传统化石能源日益枯竭以及燃烧化石能源带来了环境污染等问题;因此,人类迫切需要一种绿色可替代能源并且有效提高能源利用效率,从而维持经济和社会的可持续发展[1]。能量转换和存储技术可以有效利用能源、可持续开发能源和减少环境污染因此获得广泛关注和研究[2-3]。锂离子电池是目前发展迅速且备受关注的一种能量转换和存储装置。锂离子电池具有平均输出电压高、能量密度高、输出功率大、无记忆效应、使用寿命长、自放电小、放电平稳、对环境无污染[4]等优点,已经成为二次电池的首选。
锂离子电池的性能由正负极材料、电解液以及生产工艺等决定。其中,目前正极材料的容量远低于负极材料,因此锂离子电池性能主要由正极材料决定[5]。目前使用的正极材料主要有LiCoO2,LiNiO2,LiMnO2,LiFePO4[6-8]等体系,但这些正极材料的理论容量不高,所以这些正极材料组装的锂离子电池容量多在150mAh·g-1左右;因此,锂离子电池迫切需要一种高容量的正极材料。钒氧化合物具有非常高的嵌锂比容量[9],VO2,V2O5,V3O8和V6O13等都具有很好的嵌锂性能。其中,V6O13因具有极高的理论容量(420mAh·g-1)[10-12]而成为高比容量锂离子电池一种有发展潜力的正极材料。但V6O13晶格中导电电子数目有限,且随着锂离子的嵌入,其电导率迅速下降,使其在高锂状态下正极材料的活性利用率降低;另外,V6O13随着锂离子的嵌入和脱出,体积变化大,晶体结构不稳定导致循环性能迅速下降。因此,研究开发该正极材料的关键在于如何有效提高LixV6O13正极材料在高锂状态下的电导率和改善循环性能。Barker等[13]通过对V6O13中Li+脱嵌过程的研究表明,V6O13充放电过程中的电阻变化与Li+脱嵌过程中电极材料晶格体积变化相对应,由此知道V6O13充放电过程中晶体内部结构的变化影响电化学性能。同时,Thomas课题组[14-15]通过对V6O13中Li+嵌入过程的研究认为,Li+嵌入V6O13层间形成LixV6O13,其中Li+占据双八面体和单八面体之间的四方锥空位,因此提高LixV6O13化合物循环性能的关键在于降低从电解质与LixV6O13的界面到LixV6O13晶体双八面体和单八面体之间的内阻,同时保持Li+脱嵌过程中晶体结构的稳定性。Pereira-Ramos课题组[16-17]将Cr3+用于V6O13的掺杂,制备出Cr0.36V6O13.5化合物,Cr0.36V6O13.5组装的锂离子电池首次放电比容量达到370mAh·g-1,35次循环衰减小于15%。He等[18]通过水热反应法合成MnxV6-xO13(x=0.01, 0.02, 0.03, 0.04),当x=0.02时电化学性能最好,首次放电比容量为350.1mAh·g-1,且50次循环后放电比容量为282.7mAh·g-1。
本工作以草酸(C2H2O4·2H2O)、五氧化二钒(V2O5)和九水硝酸铁(Fe(NO3)3·9H2O)为原料,通过先制备草酸氧钒前驱体再水热法合成铁掺杂V6O13,通过XRD,SEM和XPS等表征手段和电化学测试,考察不同量铁掺杂对V6O13正极材料形貌和电化学性能的影响。
1 实验材料与方法
1.1 铁掺杂V6O13的合成
所有化学药品均为分析纯且未进行提纯。纯V6O13和铁掺杂V6O13的制备依照如下的步骤进行。通过磁力搅拌的方式将1.25g C2H2O4·2H2O和0.6g V2O5在20mL的去离子水中混合均匀。然后将溶液转移到80℃磁力搅拌器中水浴加热,持续搅拌直到形成蓝色草酸氧钒(VO)(C2O4)溶液。可能的反应过程如下:
V2O5+3H2C2O4→2[(VO)(C2O4)](blue)+CO2+3H2O
(1)
将溶液取出并自然冷却至室温,过滤。将适量(掺杂量为0.00,0.02,0.04,0.06g和0.08g,分别记为样品0.00,样品0.02,样品0.04,样品0.06,样品0.08)的九水硝酸铁(Fe(NO3)3·9H2O) 溶解在15mL去离子水中,待其完全溶解,加入已经制备好的草酸氧钒溶液(VOC2O4·5H2O)中。边搅拌边逐滴加入3mL过氧化氢溶液(H2O2,30%),形成红色溶液。将溶液转移到带聚四氟乙烯内衬的100mL不锈钢反应釜中,160℃下反应24h,然后自然冷却到室温。将上清液倒掉加入适量去离子水离心5min(4000r/min),重复两次,收集产物冷冻干燥24h。将干燥后的样品研磨后置于氮气保护下以3℃/min的升温速率在350℃下煅烧1h。
1.2 表征
利用S-4800型场发射扫描电子显微镜观察形貌;采用X射线衍射仪分析物相;使用ESCALAB 250Xi型X射线管电子能谱分析仪分析表面材料原子价态;采用INCA IE 350型能谱仪定量分析化学组成;使用CT-3008 5V10mA-164型电池测试系统测试电池性能;采用CHI860D电化学工作站测试电极反应的性质和过程。
1.3 电化学性能
将活性材料、乙炔黑、聚偏氟乙烯(PVDF)按7∶2∶1的配比进行称量,然后加入适量N-甲基吡咯烷酮,适量研磨后均匀涂覆在铝箔上,先在空气气氛下60℃干燥1h再90℃真空干燥12h。取出,将带有活性材料的铝箔压成直径16mm正极片,在手套箱中组装成纽扣电池(CR2025)并在室温下进行循环性能测试和循环伏安测试等。
2 结果与分析
图1为水热法制备的纯V6O13以及不同铁掺杂V6O13的XRD图谱。可以看出样品0.00,0.02,0.04,0.06,0.08峰形与单斜晶系V6O13标准卡片(JCPDF NO.71-2235)[19]基本一致(图1(a)),说明掺杂后样品的物相是V6O13。与纯相V6O13相比,掺杂样品均出现了不同程度向低角度偏移,掺杂量越大偏移越大(图1(b))。这是因为Fe3+的离子半径为0.0645nm,大于V4+(0.058nm)和V5+(0.054nm)的离子半径,掺杂造成晶格膨胀,使V6O13层间距增大,衍射峰向低角度偏移。与纯相V6O13相比,铁掺杂V6O13的衍射峰比较尖锐,这说明铁掺杂V6O13的结晶度比较好。
表1是通过X射线能量色散谱(EDS)分析得到的样品0.02,0.04,0.06,0.08中铁钒含量的质量比和摩尔比。可以看出,随着铁掺杂量的增加,样品中铁钒含量的质量比和摩尔比也随之相应增大。

图1 样品0.00,0.02,0.04,0.06,0.08的XRD图谱(a)和32°到36°的局部放大XRD图谱(b)Fig.1 XRD patterns (a) and enlarged peaks (b) at 2θ ranging from 32° to 36° of sample 0.00, 0.02, 0.04, 0.06 and 0.08

表1 样品0.02,0.04,0.06,0.08中铁钒含量的质量比和摩尔比Table 1 Mass ratio and mole ratio of aluminum to vanadiumin of sample 0.02,0.04,0.06,0.08
图2(a)是样品0.02的X射线光电子能谱图(XPS)。可以看出样品0.02中存在V,O,C,Fe等元素,其中C是由草酸与五氧化二钒反应生成草酸氧钒溶液的过程引入。图2(b)是样品0.02的V 2p窄谱X射线光电子能谱图,解析组分可以得出,铁掺杂V 2p3/2对应+5和+4价钒离子的峰位为514.83eV和516.16eV,含量分别为37.21%和62.79%,这与V6O13中V+5∶V+4=1∶2基本一致。另外,V 2p3/2通常对应+5和+4价钒离子的峰位为514.9eV和516.3eV[20-21]与实验结果有一定偏差,产生偏差的原因可能是铁的掺入使得钒氧间的相互作用减弱[22]。图2(c)为样品0.02的Fe 2p窄谱X射线光电子能谱图,掺杂铁离子Fe 2p3/2的峰位为710.36eV,这说明掺杂的铁离子为Fe3+[23]。
图3是样品0.00,0.02,0.04,0.06,0.08的场发射扫描电镜图(SEM)。可以看出,样品形貌均为由纳米片堆垛而成的单元,未掺杂样品的堆垛单元排列无序,有团聚现象;掺杂样品的堆垛单元排列有序,纳米片之间大空隙。纳米片厚度随着掺杂量的增加逐渐减小。样品0.02的纳米片最大(厚度600~900nm),堆垛纳米片之间的空隙最大,这可能是因为0.02样品的有序堆垛纳米片在表面应力的作用下发生卷曲因而产生大空隙,空隙大有利于存储更多的锂离子并且有利于锂离子的嵌入/脱出。
图4为样品0.00,0.02,0.04,0.06,0.08组装的纽扣电池的放电性能,放电倍率为0.1C,放电电压为1.5~4.0V。可以看出,样品0.00,0.02,0.04,0.06,0.08的首次放电比容量分别为241,433,324,310,350mAh·g-1,掺杂样品的首次放电比容量均高于纯V6O13。样品0.00,0.02,0.04,0.06,0.08的100次循环后的容量保存率分别为32.0%,47.1%,34.8%,47.4%,36.9%,掺杂样品的容量保存率均好于纯V6O13。其中,样品0.02的首次放电比容量最高(433mAh·g-1),容量保存率高(47.1%),电化学性能最好。容量保存率高说明锂离子嵌入/脱出过程对晶体结构破坏小而过多的掺杂在充放电过程中容易导致V6O13晶体结构破坏造成循环性能下降。

图2 样品0.02的X射线光电子能谱图(a)、V 2p窄谱X射线光电子能谱图(b)和Fe 2p窄谱X射线光电子能谱图(c)Fig.2 XPS spectra of sample 0.02(a), narrow-scan spectra in the V 2p region(b) and narrow-scan spectra in the Fe 2p region(c)

图3 样品的扫描电镜图 (a)样品0.00;(b)样品0.02;(c)样品0.04;(d)样品0.06;(e)样品0.08;(1)未放大的图片;(2)局部放大图Fig.3 SEM images of samples (a)sample 0.00;(b)sample 0.02;(c)sample 0.04;(d)sample 0.06; (e)sample 0.08;(1)low-power image;(2)partial enlarged image
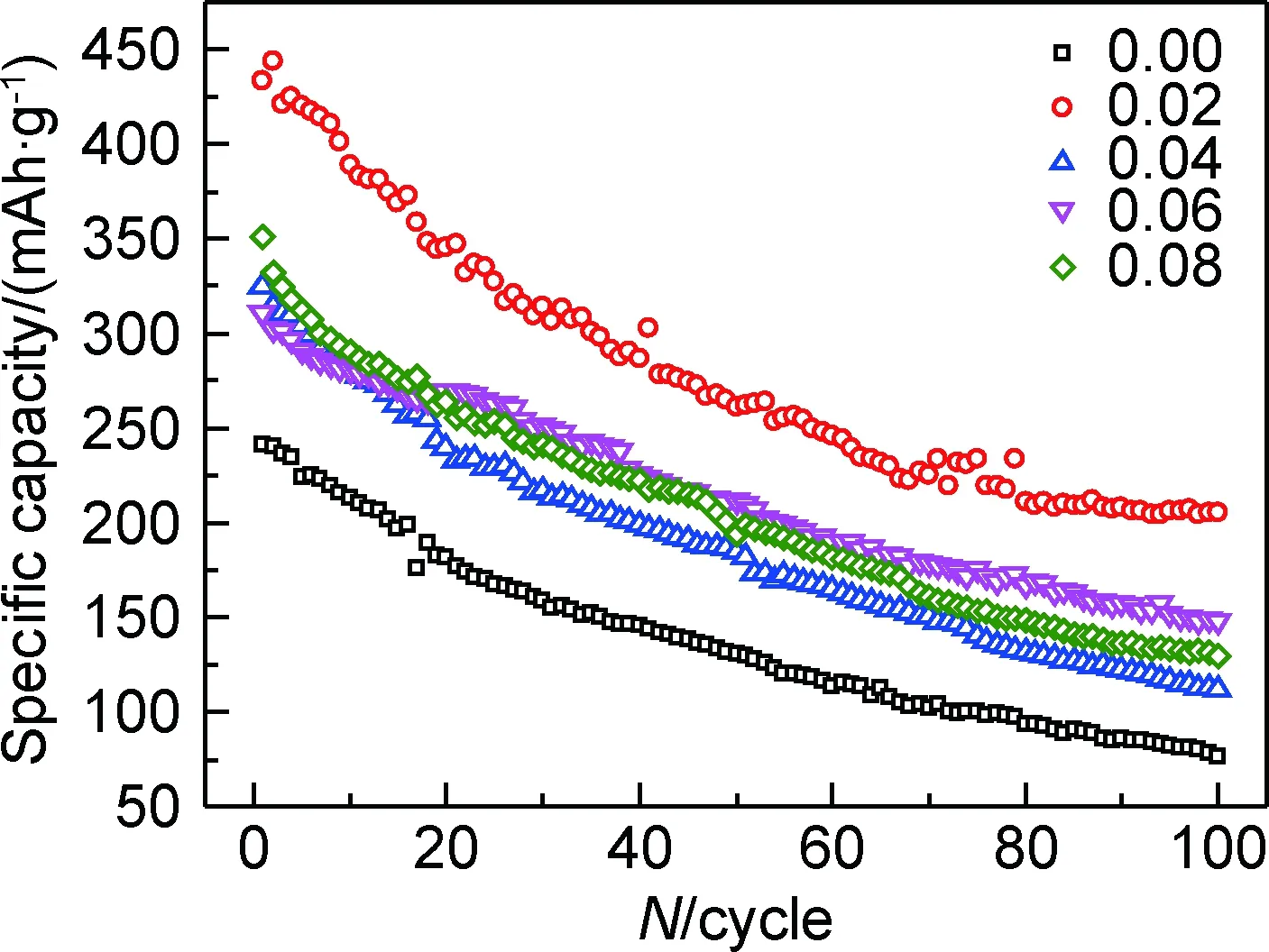
图4 电流密度为42mA·g-1,充放电电压为1.5~4.0V时样品0.00,0.02,0.04,0.06,0.08的放电性能Fig.4 Cyclic performance of sample 0.00,0.02,0.04,0.06 and 0.08, at the current density of 42mA·g-1 and charge discharge voltage of 1.5-4.0V
图5分别是样品0.00(a),0.02(b),0.04(c),0.06(d),0.08(e)的首次、50次和100次循环时的充放电曲线,电流密度为42mA·g-1,电压范围是1.5~4.0V。可以看出,所有掺杂样品的充放电曲线与纯V6O13的充放电曲线相似,都有着3个明显的充放电平台,大约在2.0,2.3, 2.7V,平台表示化学和结构变化对应锂离子嵌入V6O13过程发生的一系列相变[24-25],这说明在充放电过程中,铁掺杂V6O13保持了V6O13的晶体结构。这与循环伏安曲线的结果是一致的[26]。同时,注意到随着充放电次数的增加,充放电平台逐渐缩小,这是因为在循环过程中,锂离子嵌入/脱出导致铁掺杂V6O13的晶体结构坍塌破坏因而能容纳的锂离子数量减少。其中,样品0.02的充放电平台最大,故所能容纳的锂离子数量最多,电化学性能最好,这与电池充放电曲线图的结果是一致的。

图5 样品0.00(a),0.02(b),0.04(c),0.06(d),0.08(e)的首次、50次和100次循环时的充放电曲线Fig.5 Initial,fiftieth and hundredth charge-discharge curves of sample 0.00 (a), 0.02 (b), 0.04 (c), 0.06 (d) and 0.08(e)

图6 样品0.00(a),0.02(b),0.04(c),0.06(d),0.08(e)的第3次循环后循环伏安曲线图Fig.6 Cyclic voltammetry curves of sample 0.00 (a), 0.02 (b), 0.04 (c), 0.06 (d) and 0.08(e) after three cycles
图6是样品0.00(a),0.02(b),0.04(c),0.06(d),0.08(e)第3次循环后的循环伏安曲线图,扫描电压为1.5~3.5V,扫描速率为0.1mV/s。纯V6O13循环伏安曲线图上存在2.35,2.68,2.84,3.31V 4个氧化峰,2.04,2.44,2.71V 3个还原峰。氧化还原峰表明发生相变,相变过程表示为:V6O13→ Li3.6V6O13→ Li7V6O13→ Li2V6O13→ V6O13。掺杂不同数量铁后,其氧化峰和还原峰的位置均出现不同的改变,说明铁的掺入改变了钒氧化物中钒离子的费米能级。其中,0.02样品的还原峰最小(1.92V),氧化峰最大(2.94V),说明0.02样品的可逆性稍差,这也是0.02样品在充放电循环初期放电比容量下降较快的原因。与其他的样品相比,0.08样品的循环伏安曲线图峰位平缓且峰的数量少,说明掺杂量高时,能级改变过大影响材料结构导致循环性能变差。
图7为样品0.00,0.02,0.04,0.06,0.08经过3次循环后的交流阻抗图。经过拟合,纯V6O13(0.00)经过3次循环后的电荷移动电阻为151.6Ω,而样品0.02,0.04,0.06,0.08经过3次循环后的电荷移动电阻分别为461,436.3,565,639Ω。铁掺杂V6O13的电荷移动电阻均大于纯V6O13,并且随着掺杂量的增加,电荷移动电阻逐渐增大,这可能是随着掺杂量的增加V6O13层间距增大,同时Fe3+取代部分锂的位置,从而阻碍锂离子的插入[27]。
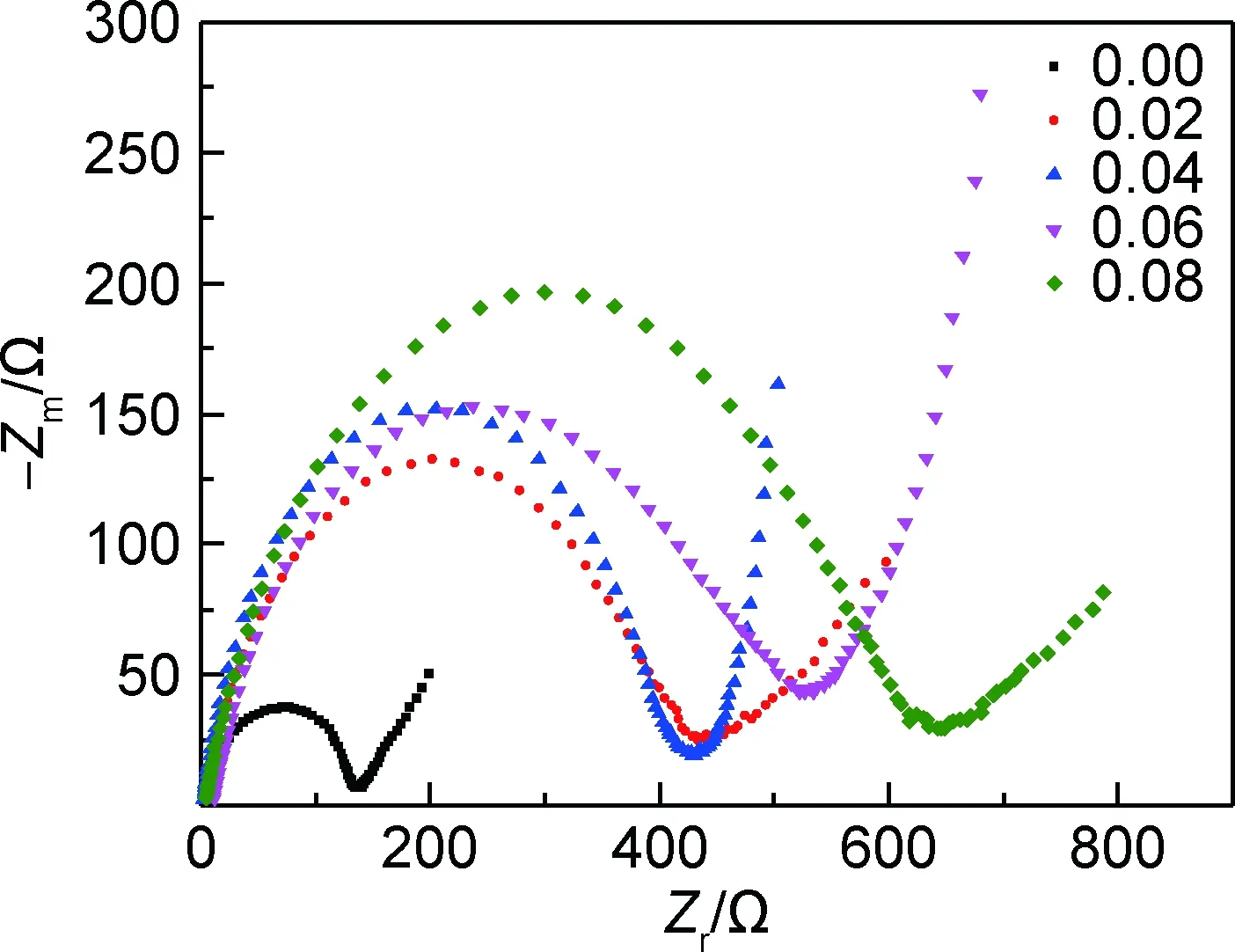
图7 样品0.00,0.02,0.04,0.06,0.08的3次循环后交流阻抗图Fig.7 Electrochemical impedance spectroscopy of sample 0.00,0.02,0.04,0.06 and 0.08 after three cycles
3 结论
(1)通过水热法制备铁掺杂V6O13,得到样品形貌均为由纳米片堆垛而成的单元,但未掺杂样品的堆垛单元无序且团聚严重,掺杂样品的堆垛单元有序且纳米片之间的空隙大。纳米片随着掺杂量的增加逐渐减小。其中,样品0.02的纳米片最大(厚度600~900nm),堆垛纳米片之间的空隙最大。
(2)电化学性能测试表明,铁掺杂V6O13样品的电化学性能好于纯V6O13。其中,0.02样品的电化学性能最好,首次放电比容量为433mAh·g-1,100次循环后的容量保存率为47.1%。
(3)有序堆垛及空隙有利于存储更多的锂离子并且有利于锂离子的嵌入/脱出。适量铁的掺入有利于保持V6O13的晶体结构。
[1] 张晓清,赵智敏. 基于清洁发展机制的能源可持续发展影响分析[J]. 煤炭技术,2010,29(9):9-10.
ZHANG X Q, ZHAO Z M. Analysis of influence of energy for sustainable development based on clean development mechanism [J]. Coal Technology, 2010, 29(9): 9-10.
[2] 万婷,穆道斌,薛欢,等. 锂离子电池锡基负极材料的研究进展[J]. 材料导报,2010,24(9):117-120.
WAN T, MU D B, XUE H, et al. Research progress in tin-based negative electrode materials for Li-ion batteries [J]. Materials Review, 2010, 24(9): 117-120.
[3] 杜萍,高俊奎. 锂离子电池Si基负极研究进展[J]. 电源技术,2010,4(34):409-412.
DU P, GAO J K. Research progress of Si based anode material for Li-ion battery [J]. Chinese Journal of Power Sources, 2010, 4(34): 409-412.
[4] 吴宇平,戴晓兵,马军旗,等. 锂离子电池:应用与实践[M]. 北京:化学工业出版社,2004.
WU Y P, DAI X B, MA J Q, et al. Lithium-ion batteries: application and practice [M]. Beijing: Chemical Industry Press, 2004.
[5] TARASCON J M, ARMAND M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359-367.
[6] ATIL A, PATIL V, SHIN W V, et al. Issue and challenges facing rechargeable thin film lithium batteries[J]. Materials Research Bulletin, 2008, 43(8): 1913-1942.
[7] LIU H K, WANG G X, GUO Z, et al. Nanomaterials for lithium-ion rechargeable batteries[J]. Journal of Nanoscience and Nanotechnology, 2006, 6(1): 1-15.
[8] MANTHIRAM A, MURUGAN A V, SARKAR A, et al. Nanostructured electrode materials for electrochemical energy storage and conversion [J]. Energy & Environmental Science, 2008, 1(6): 621-638.
[9] SAIDI Y M, KOKSBANG R, SAIDI S E, et al. Rocking-chair batteries based on LiMnO4and V6O13[J]. Journal of Power Sources, 1997, 68(2): 726-729.
[10] PERS N, LING Y, DEWULF D, et al. V6O13films by control of the oxidation state from aqueous precursor to crystalline phase [J]. Dalton Transactions, 2013, 42(4): 959-968.
[11] XIA Y Y, FUJIEDA T, TATSUMI K, et al. Thermal and electrochemical stability of cathode materials in solid polymer electrolyte [J]. Journal of Power Sources, 2001, 92(1): 234-243.
[12] BARKER J, KOKSBANG R. The interfacial impedance variation of V6O13composite electrodes during lithium insertion and extraction [J]. Electrochimica Acta, 1995, 40(6): 673-679.
[13] BARKER J, SAIDI E S, SAUDI M Y. An investigation into the discharge capacity loss for composite insertion electrodes based on LixV6O13[J]. Electrochimica Acta, 1995, 40(8): 949-952.
[14] BJÖRK H, LIDIN S, GUSTAFSSON T, et al. Superlattice formation in the lithiated vanadium oxide phases Li0.67V6O13and LiV6O13[J]. Acta Crystallographica Section B, 2001, 57(6): 759-765.
[15] HÖWING J, GUSTAFSSON T, THOMAS O J. Low-temperature structure of V6O13[J]. Acta Crystallographica Section B, 2003, 59(6): 747-752.
[16] SOUDAN P, PEREIRA-RAMOS P J, FARCY J, et al. Sol-gel chromium-vanadium mixed oxides as lithium insertion compounds [J]. Solid State Ionics, 2000, 135(1): 291-295.
[17] LEGER C, BACH S, PEREIRA-RAMOS P J. The sol-gel chromium-modified V6O13as a cathode material for lithium batteries [J]. Journal of Solid State Electrochemistry, 2007, 11(1): 71-76.
[18] HE J Y, LONG F, ZOU Z G. Hydrothermal synthesis and electrochemical performance of Mn-doped V6O13as cathode material for lithium-ion battery [J]. Ionics, 2015, 21(4): 995-1001.
[19] ZHAN S Y, WANG C Z, NIKOLOWSKI K, et al. Electrochemical properties of Cr doped V2O5between 3.8 V and 2.0 V [J]. Solid State Ionics, 2009, 180(20): 1198-1203.
[20] SHI Q W, HUANG W X, ZHANG Y X, et al. Giant phase transition properties at terahertz range in VO2films deposited by sol-gel method [J]. Applied Materials & Interfaces, 2011, 3 (9): 3523-3527.
[21] NETHRAVATHI C, RAJAMATHI R C, RAJAMATHI M, et al. N-doped graphene-VO2(B) nanosheet-built 3D flower hybrid for lithium ion battery [J]. Applied Materials & Interfaces, 2013, 5(7): 2708-2714.
[22] WU X F, WU Z M, JI C H, et al. THz transmittance and electrical properties tuning across IMT in vanadium dioxide films by Al doping [J]. Applied Materials & Interfaces, 2016, 8(18):11842-11850.
[23] WANG Y X, LIANG W Z, HUANG W, et al. Structural and optical properties of the Fe-doped BaTiO3thin films grown on LaAlO3by polymer-assisted deposition technique [J]. Journal of Materials Science: Materials in Electronics, 2016, 27(6): 6382-6388.
[24] HOWING J, GUSTAFSSON T, THOMAS J O. Li3+δV6O13: a short-range-ordered lithium insertion mechanism [J]. Acta Crystallographica Section B, 2004, 60(4): 382-387.
[25] BJORK H, LIDIN S, GUSTAFSSON T, et al. Superlattice formation in the lithiated vanadium oxide phases Li0.67V6O13and LiV6O13[J]. Acta Crystallographica Section B, 2001, 57(6): 7591765.
[26] BERGSTROEM O, GUSTAFSSON T, THOMAS J O. Lithium insertion into V6O13studied by deformation electron density refinement of single-crystal X-ray data [J]. Solid State Ionics, 1998, 110(3): 179-186.
[27] 陈学记. 纳米VOx的溶剂热制备及电化学性能的研究[D]. 合肥:合肥工业大学,2008.
CHEN X J. Slovothermal synthesis and electrchemical properties of nano vanadium oxides [D]. Hefei: Hefei University of Technology, 2008.
