龙爪稷多酚超声辅助双水相提取工艺及其抗氧化活性研究
2018-01-19王双辉WANGShuanghui钟嫒嫒金晨钟
王双辉WANG Shuang-hui 张 丽 钟嫒嫒 - 金晨钟 -
(1. 湖南人文科技学院农药无害化应用重点实验室,湖南 娄底 417000;2. 湖南省农田杂草防控技术与应用协同创新中心,湖南 娄底 417000;3. 湖南人文科技学院农业与生物技术学院,湖南 娄底 417000)
龙爪稷起源于非洲,广泛分布于东半球热带及亚热带地区,在中国长江以南及安徽、西藏、河南、广西、陕西、湖南等省均有分布[1];在印度,其产量仅次于小麦、高粱、玉米、珍珠粟和水稻,是一种非常重要的谷物[2]。研究表明,龙爪稷具有抗癌[3]、抗氧化与抗衰老[4]、抗高血脂与保护心脏[5]、预防肥胖[6]和预防糖尿病[7]等保健功能;龙爪稷含有丰富的多酚、矿物质、膳食纤维和含硫氨基酸[8],其中多酚含量远高于糙米、小麦、燕麦、玉米4种谷物[9]。
有机溶剂提取法、超临界萃取法、超声波和微波辅助浸提法等是植物多酚的主要提取方法[10]。但这些方法得到的多酚提取物纯度不高,黏性大,后续处理难度较大,不利于多酚的分离与纯化。超声波辅助浸提法可提高目标物从固相转移到液相的传质速率,从而缩短提取时间,提高收率。双水相萃取技术是根据组分在两个不相容的水相间的分配差异实现目标成分的分离,是一种新型的植物活性成分分离技术[11]。基于乙醇等水溶性低级醇与无机盐形成的新型双水相体系与传统聚合物-无机盐体系相比,后续处理更容易、成本更低,且表现出良好的分离性能[12],已广泛用于植物活性成分的提取[13]。超声波辅助低级醇-无机盐双水相体系提取技术已应用于茶多酚[14-15]、路边青总多酚[16]、神秘果种子多酚[17]、石榴皮多酚[18]等多酚类物质的提取。但国内外还没有利用该法提取龙爪稷多酚的报道。本研究拟以湖南新化的龙爪稷种子为原料,采用超声波辅助乙醇-硫酸铵双水相体系提取多酚,研究影响多酚得率的因素,利用响应面试验优化提取工艺,并研究龙爪稷多酚的抗氧化活性,为龙爪稷多酚的研究和大规模生产提供理论依据。
1 材料与方法
1.1 材料与仪器
龙爪稷种子:湖南省隆庆农业开发有限公司,使用前晾干粉碎,过60目泰勒标准筛;
没食子酸:分析纯,上海阿拉丁生化科技有限公司;
其他试剂均为国产分析纯;
超声波清洗器:KQ-300DE型,昆山超声仪器有限公司;
冷冻离心机:L530型,湖南湘仪实验仪器有限公司;
可见光分光光度计:7230G型,上海舜宇恒平科学仪器有限公司。
1.2 方法
1.2.1 多酚标准曲线的建立 以没食子酸为标准品,配制浓度为0,5,10,20,30,40,50,100 μg/mL的没食子酸工作液,采用福林酚比色法[18]测定样品在765 nm处的吸光度。以吸光度为Y值,没食子酸浓度为X值绘制标准曲线。
1.2.2 超声波辅助双水相提取龙爪稷多酚及得率计算 将一定量的无水乙醇、硫酸铵、水加入到100 mL的带塞锥形瓶中,预热到一定温度,加入粉碎后的龙爪稷粉末样品1.000 0 g,待形成双水相体系后,于超声波清洗器中,在一定温度条件下以200 W的功率超声处理一定时间,3 000 r/min离心5 min,小心吸取上清液于50 mL的容量瓶中即得龙爪稷多酚初提液,定容到50 mL形成母液。按1.2.1的方法测定母液中多酚在765 nm 下的吸光度,利用标准曲线计算多酚的质量浓度(ρ),按式(1)计算得率。
(1)
式中:
R——多酚得率,mg/100 g;
ρ——多酚的质量浓度,μg/mL;
V——母液体积,mL;
m——样品质量,g。
1.2.3 单因素试验设计
(1) 乙醇体积分数对龙爪稷多酚得率的影响:固定硫酸铵质量浓度0.25 g/mL,超声温度40 ℃,超声时间20 min,液料比50∶1 (mL/g),分别设置乙醇体积分数为25%,30%,35%,40%,45%,50%,55%,按1.2.2的方法提取多酚,试验重复3次,得率取平均值。
(2) 硫酸铵浓度对龙爪稷多酚得率的影响:固定乙醇体积分数40%,超声温度40 ℃,超声时间20 min,液料比50∶1 (mL/g),分别设置硫酸铵质量浓度为0.15,0.20,0.25,0.30,0.35,0.40 g/mL,按1.2.2的方法提取多酚,试验重复3次,得率取平均值。
(3) 超声温度对龙爪稷多酚得率的影响:固定乙醇体积分数40%,硫酸铵质量浓度0.25 g/mL,超声时间20 min,液料比50∶1 (mL/g),分别设置超声温度为30,35,40,45,50,55 ℃,按1.2.2的方法提取多酚,试验重复3次,得率取平均值。
(4) 超声时间对龙爪稷多酚得率的影响:固定乙醇体积分数40%,硫酸铵质量浓度0.25 g/mL,超声温度40 ℃,液料比50∶1 (mL/g),分别设置超声时间为10,20,30,40,50,60 min,按1.2.2的方法提取多酚,试验重复3次,得率取平均值。
(5) 液料比对龙爪稷多酚得率的影响:固定乙醇体积分数40%,硫酸铵质量浓度0.25 g/mL,超声温度40 ℃,超声时间20 min,分别设置液料比为30∶1,40∶1,50∶1,60∶1,70∶1,80∶1,90∶1 (mL/g),按1.2.2的方法提取多酚,试验重复3次,得率取平均值。
1.2.4 响应面试验优化超声辅助双水相提取工艺 采用Box-Behnken设计原理,根据单因素试验的结果设计响应面试验,以龙爪稷多酚得率为响应值,以乙醇体积分数、硫酸铵浓度、超声温度、超声时间、液料比5个因素为试验因子,建立响应面优化方案,进行二次多项回归方程拟合及其优化分析。
1.2.5 龙爪稷多酚体外抗氧化活性的测定 总还原能力、体外清除DPPH自由基能力、羟自由基清除率按照王艳等[19]的方法测定,并用同浓度的VC作对照。
1.3 数据处理
数据采用mean±SD (n=3)表示,采用SPSS 19.0的单向方差分析进行差异比较(P<0.05)(LSD法),以小写字母标注显著性差异。
2 结果与分析
2.1 标准曲线
以没食子酸浓度(μg/mL)为横坐标,吸光度为纵坐标绘制标准曲线,由此可得回归方程为:Y=0.008 3X-0.035 1,R2=0.999 5,说明线性关系较好,可用于多酚浓度的计算。
2.2 单因素试验结果与分析
2.2.1 乙醇体积分数对龙爪稷多酚得率的影响 由图1可知,当乙醇体积分数在25~40%时,随着乙醇浓度的增大,龙爪稷多酚的得率增大;当乙醇体积分数为40%时,多酚得率达到最大;随后,随着乙醇体积分数的增大,多酚得率不断减少,可能是过高的乙醇浓度导致大分子沉淀,间接导致多酚沉淀[20]。因此,选择乙醇体积分数为40%作为响应面优化的中值。
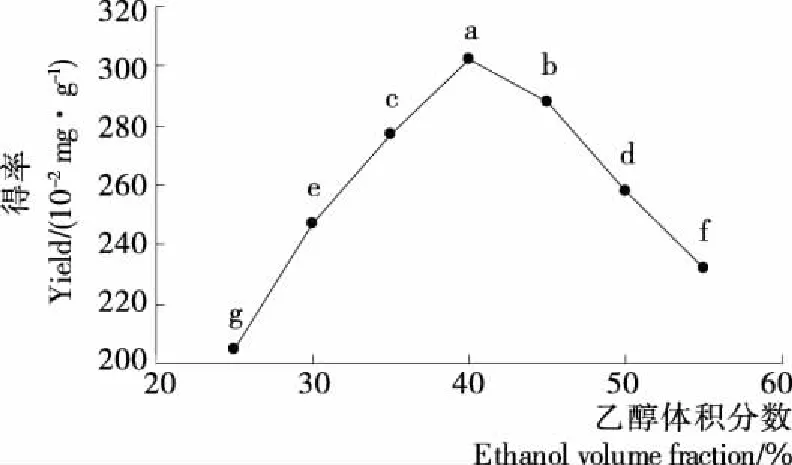
不同小写字母表示差异显著(P<0.05)
2.2.2 硫酸铵浓度对龙爪稷多酚得率的影响 由图2可知,随着硫酸铵浓度的增加,龙爪稷多酚的得率增大,当硫酸铵质量浓度超过0.30 g/mL时,多酚得率稍有下降,但差异不显著。这是由于双水相体系实际是乙醇和硫酸铵争夺水分子的过程,随着硫酸铵浓度的增加,上相中水分子减少,乙醇在上相中的浓度增大,多酚在上相中的溶解度增大[21];随着硫酸铵的继续增加,硫酸铵在下相中已达到饱和,其含量的增加仅增加了未溶解的固体硫酸铵,对双水相体系的影响不大,故随着硫酸铵浓度的继续增加,多酚得率变化不显著。因此,选择硫酸铵浓度为0.30 g/mL作为响应面优化的中值。
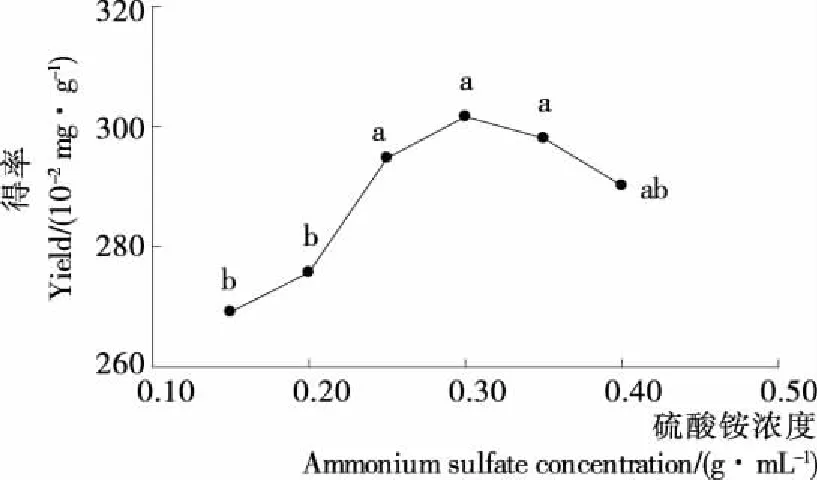
不同小写字母表示差异显著(P<0.05)
2.2.3 超声温度对龙爪稷多酚得率的影响 由图3可知,温度<40 ℃时,多酚得率随着温度的增大而增大;当温度为40 ℃时,得率最大;当温度>40 ℃时,多酚得率下降。这是由于随着温度增加,分子运动加剧,传质速率增大,多酚得率增大;但当温度继续增大时,多酚的氧化加剧,得率下降[22]。因此,选择超声温度为40 ℃作为响应面优化的中值。
2.2.4 超声时间对多酚龙爪稷得率的影响 由图4可知,随着超声时间的延长,龙爪稷多酚得率增大;但当超声时间>30 min时,多酚得率随着时间的延长而减少,这是由于当超声时间达到30 min时,多酚溶解已接近饱和,而由于多酚化学性质不稳定,如降解、氧化等原因使多酚得率下降[23]。因此,选择超声时间为30 min作为响应面优化的中值。
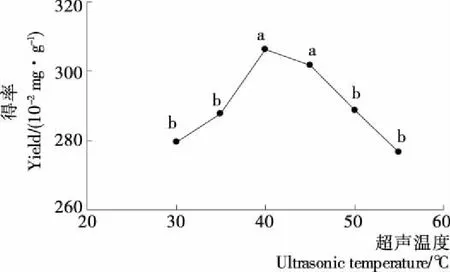
不同小写字母表示差异显著(P<0.05)
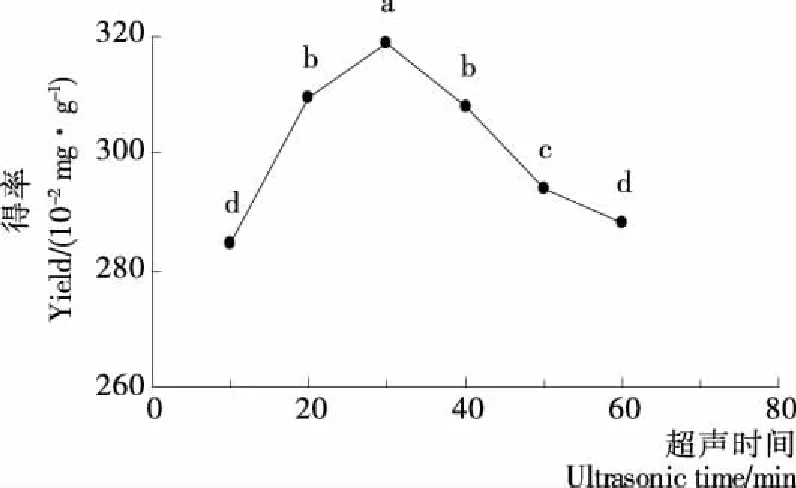
不同小写字母表示差异显著(P<0.05)
2.2.5 液料比对龙爪稷多酚得率的影响 当液料比为30∶1~60∶1 (mL/g)时,多酚得率随着液料比的增大而增大;在60∶1 (mL/g)时达到顶峰;继续增大液料比,多酚得率无显著性差异(图5)。这是由于在提取过程中,随着液料比的增大,传质推动力增大,传质速率增大,得率增大;当液料比>60∶1 (mL/g)时,龙爪稷多酚溶解已达到饱和,多酚已经充分提取出来[18],考虑到提取成本和提取液中多酚的含量,选择液料比为60∶1 (mL/g)作为响应面优化的中值。

不同小写字母表示差异显著(P<0.05)
2.3 响应面法优化试验结果与分析
2.3.1 Box-Behnken试验设计与结果 在单因素试验的基础上,确定乙醇体积分数、硫酸铵浓度、超声温度、超声时间、液料比为因变量并确定其水平,结果见表1。采用Box-Behnken设计原理,以龙爪稷多酚得率为响应值 (Y)进行响应面试验,结果见表2。
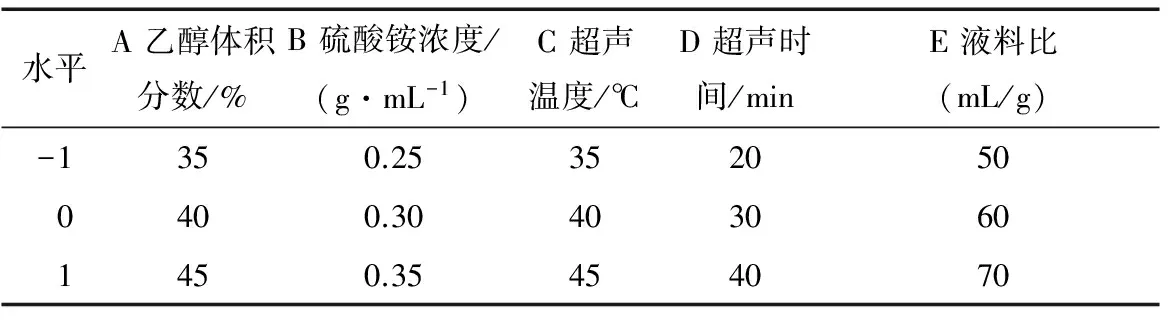
表1 试验因素水平和编码

表2 Box-Behnken试验设计及结果
2.3.2 方差分析 对表2的数据进行二次多元回归拟合,得到二次多元回归方程:
Y=317.77+4.46A+0.55B+19.67C-4.07D+2.15E-7.13AB+4.82AC+6.26AD-2.73AE+5.06BC+6.89BD+3.33BE+1.64CD-1.62CE+0.0063DE-14.58A2-18.92B2-27.87C2-15.13D2-14.34E2。
(2)
由表3可知,该模型极显著(P<0.000 1),失拟项不显著(P>0.05),模型相关系数R2=0.956 9,变异系数CV=1.89%,信噪比19.462>4,说明该模型拟合度较好,可用于分析和预测龙爪稷多酚得率。由方差分析可知,对龙爪稷多酚得率影响极显著(P<0.01)的因素有A、C、D、A2、B2、C2、D2、E2,影响显著(P<0.05)的因素为AB、AD、BD。由F值可以看出提取条件对龙爪稷多酚得率的影响大小依次为:超声温度>乙醇体积分数>超声时间>液料比>硫酸铵浓度。

表3 方差分析†
† ** 表示差异极显著(P<0.01),* 表示差异显著(P<0.05)。

图6 响应面图和交互作用等高线
2.3.3 各因素交互作用分析及提取工艺优化 为了更直观更深入地了解各因素的交互作用,选择方差分析交互作用显著的AB、AD、BD作等高线与响应面图,结果见图6。由图6(a)可知,硫酸铵浓度为0.3 g/mL时,多酚得率随着乙醇体积分数的增大先升高后降低;在乙醇体积分数为41%达到最大,最佳工艺条件为硫酸铵浓度约为0.3 g/mL,乙醇体积分数39%~41%。由图6(b)表明,随着超声时间的延长,多酚得率先缓慢增加,后迅速降低,说明过长的超声时间对多酚得率影响显著。由图6(c)可知,多酚得率随着硫酸铵浓度先增加后降低,在0.3 g/mL达到最大值;最佳工艺条件为:超声时间29~31 min,硫酸铵浓度0.29~0.31 g/mL。各等高线图呈现椭圆形,说明AB、AD、BD的交互作用显著,与表2 的P值分析结果一致。
利用Design Expert 8.0.6软件分析优化后的模型得出最佳的提取工艺条件为:乙醇体积分数40.95%、硫酸铵浓度0.3 g/mL、超声温度41.84 ℃、超声时间29.29 min、液料比60.37∶1 (mL/g),在此条件下多酚得率的预测值为322.00 mg/100 g。为了方便操作,将最佳工艺条件修正为:乙醇体积分数41%、硫酸铵浓度0.3 g/mL、超声温度42 ℃、超声时间29 min、液料比60∶1 (mL/g)。在修正的最佳工艺下重复3次验证实验,龙爪稷多酚的得率为(319.15±2.31) mg/100 g,与预测值相差不大,说明模型拟合度较好,预测准确。
2.4 龙爪稷多酚体外抗氧化活性结果分析
2.4.1 总还原力的测定 由图7可知,当浓度在100~700 μg/mL 时,多酚与VC的总还原力随着浓度的增加而增强,且VC的总还原力大于同浓度的龙爪稷多酚;当质量浓度为700 μg/mL时,龙爪稷多酚的总还原力为同浓度VC的91.84%,说明龙爪稷多酚有较强的总还原力。
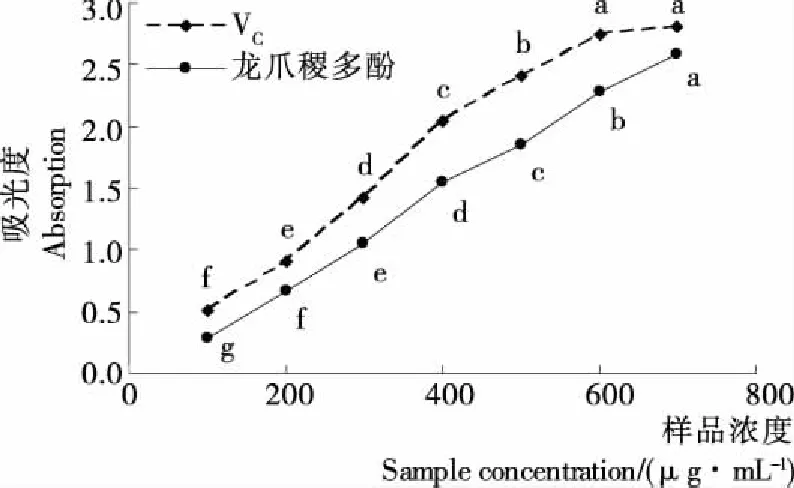
2.4.2 对DPPH自由基的清除能力 由图8可知,浓度低于500 μg/mL时,龙爪稷多酚和VC对DPPH自由基的清除率都随浓度的增加而增强;当龙爪稷多酚浓度为600~700 μg/mL时,清除率无显著变化,说明龙爪稷多酚在600 μg/mL时已接近饱和,而VC在500 μg/mL时已接近饱和;当浓度为700 μg/mL 时龙爪稷多酚清除率为91.74%,为同浓度VC的96.79%。
不同小写字母表示差异显著(P<0.05)
不同小写字母表示差异显著(P<0.05)
不同小写字母表示差异显著(P<0.05)
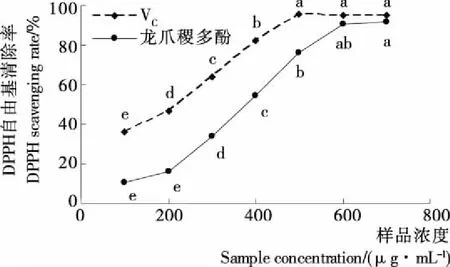
清除率无显著增强,即浓度为600 μg/mL时龙爪稷多酚的羟基自由基的清除能力已接近饱和;而VC在浓度为500 μg/mL 时已达到饱和,且其对羟基自由基的清除能力强于同浓度的多酚;当多酚浓度为700 μg/mL时,龙爪稷多酚对羟基自由基的清除率为55.58%,为同浓度VC的89.03%,说明龙爪稷多酚有较强的羟基自由基清除能力。
3 结论
(1) 通过响应面优化得到的回归方程能预测超声辅助双水相提取龙爪稷多酚的得率。结果表明,优化后的提取工艺为:乙醇体积分数41%、硫酸铵浓度0.3 g/mL、超声温度42 ℃、超声时间29 min、液料比60∶1 (mL/g),在此条件下,龙爪稷多酚得率为319.15 mg/100 g。龙爪稷中多酚含量较高,可以作为一种谷物膳食补充剂来补充多酚。
(2) 龙爪稷多酚有较强的体外抗氧化活性,700 μg/mL的龙爪稷多酚的总还原力、对DPPH自由基的清除率和对羟基自由基的清除率分别为同浓度VC的91.84%,96.79%,89.03%;证实了龙爪稷的抗氧化活性,具有作为抗氧化剂在食品和医药领域进一步发展应用的潜力。
[1] 池福敏, 幸塔, 辜雪冬, 等. 西藏察隅龙爪稷营养成分、重金属含量与农药残留分析[J]. 食品与发酵工业, 2015, 41(5): 187-191.
[2] GULL A, NAYIK G A, PRASAD K. Technological, processing and nutritional approach of finger millet (Eleusinecoracana): A mini review[J]. Journal of Food of Processing & Technology, 2016, 6(7): doi: 10.4172/2157~7110.1000593.
[3] SINGH N, MEENU G, SEKHAR A. Evaluation of antimicro-bial and anti-cancer properties of finger millet (Eleusinecora-cana) and Pearl millet (Pennisetumglaucum) extracts[J]. The Pharma Innovation Journal, 2015, 3(11): 82-86.
[4] HEGDE P S, RAJASEKARAN N S, CHANDRA T S. Effects of the antioxidant properties of millet species on oxidative stress and glycemic status in alloxan-induced rats[J]. Nutrition Research, 2005, 25(12): 1 109-1 120.
[5] VASANT R A, PATEL N D, KARN S S, et al. Physiological role of a multigrain diet in metabolic regulations of lipid and antioxidant profiles in hypercholesteremicrats: Multigrain diet in hyperlipemia[J]. Journal of Pharmacopuncture, 2014, 17(2): 34-40.
[6] MURTAZA N, BABOOTA R K, JAGTAP S, et al. Finger millet bran supplementation alleviates obesity-induced oxidativestress, inflammation and gut microbial derangements in high-fat diet-fed mice[J]. British Journal of Nutrition, 2014, 112(9): 1 447-1 458.
[7] KIM J S, HYUN T K, KIM M J. The inhibitory effects of ethanol extracts from sorghum, foxtail millet and proso millet onα-glucosidase and a-amylase activities[J]. Food Chemistry, 2011, 124(4): 1 647-1 651.
[8] SHOBANA S, KRISHNASWAMY K, SUDHA V, et al. Finger millet (Ragi,EleusinecoracanaL.): A review of its nutritional properties, processing, and plausible health benefits[J]. Advances in Food & Nutrition Research, 2013, 69(1): 31-39.
[9] 王双辉, 陈致印, 谢晶. 穇子营养成分及功能利用研究进展[J]. 食品工业科技, 2017, 38(13): 329-334.
[10] 齐娜等. 新疆红肉苹果多酚的超声波辅助提取工艺优化[J]. 食品与机械, 2016, 32(9): 177-182.
[11] KARAKATSANIS A, LIAKOPOULOUKYRIAKIDES M. Comparison of PEG/fractionated dextran and PEG/industrial grade dextran aqueous two-phase systems for the enzymic hydrolysis of starch[J]. Journal of Food Engineering, 2007, 80(4): 1 213-1 217.
[12] 徐春明, 李婷, 王英英, 等. 微波辅助双水相提取苦荞麦粉中黄酮类化合物[J]. 食品科学技术学报, 2014, 32(6): 36-41.
[13] 刘磊磊, 李秀娜, 赵帅. 双水相萃取在中药活性成分提取分离中的应用进展[J]. 中草药, 2015, 46(5): 766-773.
[14] 陈钢, 李栋林, 史建鑫, 等. 响应面试验优化超声耦合双水相体系提取茶多酚工艺[J]. 食品科学, 2016, 37(6): 95-100.
[15] LI Da-gang, YUAN Fu-fang, CHEN Ru-pan, et al. The extraction of polyphenols from tea leaves based on mechanochemical methodology and aqueous two-phase system[J]. Advanced Materials Research, 2013, 834-836: 508-514.
[16] 欧阳玉祝, 张辞海, 薛慧. 超声协同双水相体系提取路边青总多酚工艺[J]. 食品科学, 2011, 32(16): 89-92.
[17] 马艺丹, 刘红, 廖小伟. 神秘果种子多酚超声双水相复合提取工艺及其抗氧化活性[J]. 食品与机械, 2015, 31(6): 173-178.
[18] 张艳霞, 朱彩平, 邓红. 超声辅助双水相提取石榴皮多酚[J]. 食品与发酵工业, 2016, 42 (12): 150-156.
[19] 王艳, 胡一鸿, 陈秋志. 玉竹糖蛋白分离纯化及其体外抗氧化能力[J]. 食品科学, 2015, 36(2): 52-56.
[20] 程旺开, 汤强, 许月明, 等. 超声波辅助乙醇提取黄秋葵果渣多酚的工艺优化[J]. 食品与机械, 2016, 32(4): 192-196.
[21] 马永强, 荆丽荣, 刘晓飞. 双水相超声波法辅助提取甜玉米芯多酚及抑菌性研究[J]. 食品科学, 2013, 34(24): 61-64.
[22] 陶阿丽, 余大群. 响应面曲线法优化超声辅助茶多酚提取工艺研究[J]. 长江大学学报: 自然科学版, 2014, 11(23): 60-64.
[23] ROSTAMI H, GHARIBZAHEDI S M T. Microwave-assisted extraction of jujube polysaccharide: Optimization, purification and functional characterization[J]. Carbohydrate Polymers, 2016, 143: 100-101.
