中国药典2015年版四部特性检查法主要增修订内容解析
2018-01-19秦绍刚
许 倩,郑 正,蒋 菲,秦绍刚
(合肥市食品药品检验中心,安徽 合肥 230088)
药典是从本草学、药物学以及处方集的编著发展而来的,其历史源远流长。中国人民共和国成立以后,党和政府高度重视医药事业,建国伊始即着手启动药品标准体系建设[1]。1950年成立了第一届药典委员会,并于1953年颁布了第一版《中国药典》。此后陆续部颁了10版药典。各版药典均客观地反映了我国不同历史时期医药产业和临床用药的水平,对于提升我国药品质量控制水平发挥着不可替代的重要作用。
现行药典是《中国药典》2015年版,于2015年12月1日起正式实施启用。现行的药典较往常作了很大的改变,主要的改变集中在四部。2015年版药典四部内容包括凡例、通则和药用辅料,整合和代替了之前药典的附录,使的药典变得更加简洁和规范。其中通则是药典标准的根基,涵盖了所有的通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的一般要求,本文简要介绍新版药典四部中关于特性检查法部分的增、修订情况[2]。
1 增修订情况
现行药典四部汇总了2010年版药典一、二、三部附录中一样的内容,项目汇总后共删减121项重复项目,在力争简洁的同时,也呈现出实验室检验方法发展和日益完善的方向。其中部分特性检查法具体变化总结见表1。
2 具体内容
2.1 溶液的颜色检查法修订
中国药典2010年版中存在各部附录文字内容描述、使用词汇不统一的问题。新版药典编纂过程中,为统一和规范文字的表述,对内容做出了一定的修改。例如重新定义了溶液颜色中几乎无色的概念,即指供试品溶液的颜色不深于相应色调0.5号标准比色液。2015年版药典新增了绿黄色色调及标准储备液的配制,新增0.5号及标准比色液的配制。
2.2 澄清度检查法修订
15年版澄清度检查法新增一种方法-浊度仪法,该法基本同欧洲药典第三法,即采用散射光式浊度仪,适用于低,中浊度无色供试品溶液的浊度测定。
2.3 可见异物检查法修订
2015年版中国药典在可见异物检查法通则中几处较为重要的修订。
2.3.1 检查方法的选择原则
15年版药典新增适用范围,即混悬型、乳状液型注射液和滴眼液不能使用光散射法。
2.3.2 样品前处理方式
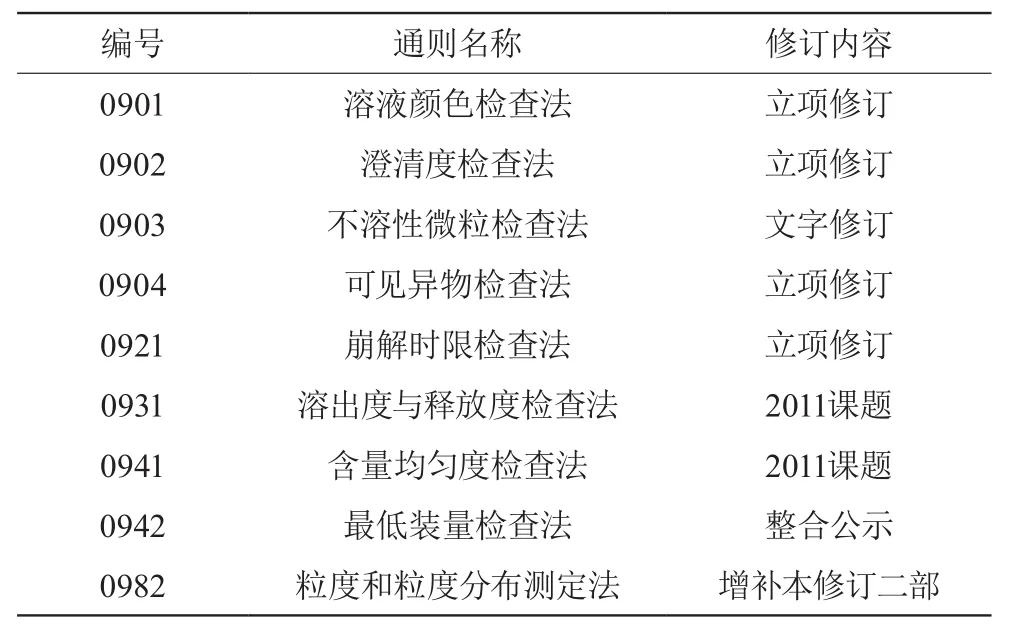
表1 增修订情况
15年版药典四部对溶液型,乳状液及混悬型制剂和注射用无菌制剂的前处理方式作了明确规定,即乳状液及混悬型制剂有大量气泡产生影响观察时,需静置足够时间至气泡消失后检查;注射用无菌制剂中经真空处理的样品,必要时应当用适当的方法破其真空,低温冷藏的品种,应先将其放至室温,再进行溶解和检查。
2.3.3 注射用无菌制剂结果判定的修订
新版药典对明显可见异物判定新增不得检出烟雾状微粒沉积物、无法计数的微粒群或摇不散的沉淀,以及在规定时间内较难计数的蛋白质絮状物;对微细可见异物判定新增不得检出半透明的小于约1 mm的细小蛋白质絮状物或蛋白质颗粒。
2.4 溶出度与释放度测定法修订
新版药典将二部中溶出度测定法和释放度测定法整合为一个测定法。10年版药典测定溶出度方法为篮法,浆法和小杯法,新版药典新增浆碟法和转筒法。实验过程中如需要使用沉降装置时,可将胶囊剂先装入规定的沉降装置内;品种项下未规定使用沉降装置时,如胶囊剂浮于液面,新版药典新增可用一小段耐腐蚀的细金属丝轻绕与胶囊外壳。
2.5 含量均匀度检查法修订
新版药典对含量均匀度的适用范围作了调整,25 mg以下规格需做含量均匀度,25 mg规格及以上规格不需做含量均匀度。与2010年版比较,排除了25 mg的规格。结果判定也作了调整,A+2.2 S≤L,则供试品的含量均匀度符合规定,新版药典要求更加严格。
3 讨 论
中国药典2015年版四部通则中收录的特性检查方法合并了10年版药典一、二、三部的内容,不仅吸收了近几年药品检测过程中总结的新理念、新方法,更提高了技术标准,检测方法日趋规范完善,先进检测技术应用不断扩大,药用辅料标准显著提升,文字表述和实验操作更加规范,对于保障药品安全和质量把控有着明显的提升。随着药品检测实践的不断加深,药典理论的不断完善,药典内容的不断丰富,我国药品质量控制水平必将进一步提高,中国药典的影响力必将不断增强。
4 结 语
综上所述,在进行相关实验前,检验人员应根据2015年版《中国药典》(四部)通则中对特性检查法部分新修订的实验方法和内容,更改以往的实验习惯,应用新的检查和测定方法,以符合其要求。
[1]钱 琛,陈 佳,陈桂良.《中国药典》2015年版通则理化检验方法的修订与浅析[J].中国医药工业杂志,2014,45(12):1195-1198.
[2]唐黎明.陈桂良.《中华人民共和国药典(2015年版)》(四部)通则中有关生物测定部分的增、修订情况介绍[J].专家论坛,2016,37(7):9-10.
