鼻咽癌筛查中三种EB病毒抗体检测的应用价值分析
2018-01-19李延忠
付 丽,李延忠
(1.山东电力中心医院耳鼻喉科,山东 济南 250000;2.山东大学齐鲁医院,山东 济南 250000)
鼻咽癌(carcinoma of nasopharynx,NPC)为临床常见恶性肿瘤,来源于上皮细胞,其发病位置主要有鼻咽腔侧壁与鼻咽腔顶部。本病属于全球性恶性肿瘤,但在北美、东南亚等地高发,同样也是我国江苏、广西、广东、湖南、香港及福建等沿海地区高发肿瘤[1]。本病作为头颈部恶性肿瘤转移率与侵袭性最高,早期无典型症状,确诊后多为晚期,有较差的预后,目前治疗以放射为主,辅助化疗,一般不手术,而晚期鼻咽癌患者存活率仅14%[2],疗效差,因此临床提出预防与治疗鼻咽癌的关键在于筛查与早期诊断鼻咽癌高发地区人群,可提升NPC患者存活率。当前临床已经明确NPC发生发展密切关联于EB病毒((Epstein Barr,EBV),其属于疱疹病毒科,为临床认识较早的关联于肿瘤的病毒,外国学者首次于1966年发现其密切关联于NPC。研究称EBV完整病毒可导致机体鼻咽黏膜上皮细胞癌变,而在鼻咽癌细胞中不仅EB病毒基因组存在,而且还包括多类EB病毒特异性抗原[3]。近年来分子生物学技术逐渐发展,临床基于分子水平角度不断探讨研究鼻咽癌与EBV间存在的关联,且提出检测NPC患者血清EBV抗体水平可有效筛查与诊断NPC。以往临床多采用IE与间接免疫荧光法(IIF)检测EA与VCAIgA抗体,步骤繁琐,主观因素影响较大,缺乏标准化与自动化,难以开展质量控制,因此临床逐渐采用ELISA定量方法检测EBV相关抗体。现详述检测Rta/IgG抗体、EA/IgA抗体及VCA/IgA抗体对筛查NPC的临床价值。
1 资料与方法
1.1 一般资料
选取2013年1月~2017年1月齐鲁医院门诊收治的鼻咽癌患者14例,均经鼻咽活检病理检查确诊,尚未接受治疗,设为鼻咽癌组,其中男性12例,女性2例,年龄为24~75岁,平均年龄为(43.8±8.5)岁。选取同期于我院门诊就诊的非鼻咽癌但表现出鼻咽部症状的患者320例,设为非鼻咽癌组,有鼻咽部症状的其他鼻咽部疾病如鼻炎、鼻窦炎、慢性咽炎、中耳炎、耳鸣、鼻出血等,排除头颈部其他恶性肿瘤。其中男性214例,女性106例,年龄为18~78岁,平均年龄为(41.6±7.6)岁。选取同期于我院体检的健康人500例设为健康组,其中男性342例,女性158例,年龄为18~72岁,平均年龄为(40.6±6.9)岁。
1.2 检测方法
于清晨空腹状态下采集3组研究对象静脉血4~5 mL,常规放置30 min,血液凝固后开展离心处理,3000 r/min为离心速度,持续10 min,在-20℃冰箱中保存上层血液后待检。应用酶联免疫吸附剂试剂盒(来自北京同昕生物技术有限公司),应用酶联免疫吸附试验(EILSA)检测Rta/IgG抗体,应用EILSA试剂盒(来自德国欧蒙医学实验诊断股份公司)检测EA/IgA抗体及VCA/IgA抗体,严格按照试剂规定要求开展操作,阳性判定标准:S/CO值在1.0及其以上代表Rta/IgG阳性,S/CO值在1.1及其以上代表EA/IgA及VCA/IgA阳性。同时检测EBV DNA:将乙二胺四乙酸(EDTA)抗凝血血浆分离出来,采用北京天根生化科技有限公司生产的DNA提取试剂盒。EBV DNA检测方法为荧光定量聚合酶链反应法(PCR),将病毒拷贝数计算出来,用湖南圣湘生物科技有限公司生产的检测试剂盒,阳性标准为EBV DNA计数在50 copy/mL以上,低于该检测值则判定为阴性。
1.3 统计学方法
统计学处理软件为SPSS 20.0,资料表示用n(%),卡方检验处理组间阳性率比较,若P<0.05提示比较有显著性差异。
2 结 果
2.1 3组研究对象血清EB病毒Rta/IgG抗体、EA/IgA抗体及VCA/IgA抗体阳性率比较
鼻咽癌组Rta/IgG、EA/IgA及VCA/IgA抗体检测阳性率均明显高于非鼻咽癌组与健康组;非鼻咽癌组VCA/IgA抗体检测阳性率明显高于健康组;鼻咽癌组内VCA/IgA抗体检测阳性率明显高于EA/IgA与Rta/IgG抗体;非鼻咽癌组EA/IgA检测阳性率明显低于Rta/IgG、VCA/IgA;健康组EA/IgA检测阳性率低于Rta/IgG与VCA/IgA,比较均有显著性差异(P<0.05)。见表1。
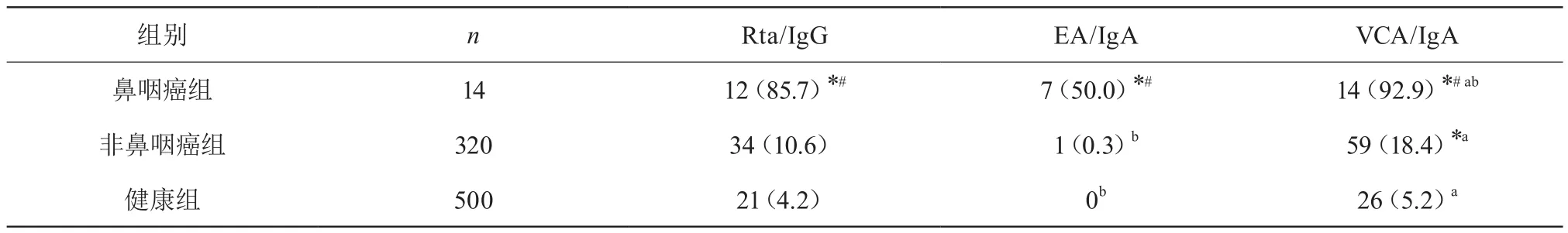
表1 3组研究对象血清EB病毒EBNAI/IgA抗体、EA/IgA抗体及VCA/IgA抗体阳性率比较 [n(%)]
2.2 3种EB病毒抗体筛查检测鼻咽癌的临床价值比较
VCA/IgA抗体检测灵敏度明显高于EA/IgA、Rta/IgG,Rta/IgG也高于EA/IgA;EA/IgA抗体特异度与阳性预测值明显高于Rta/IgG、VCA/IgA,比较均有显著性差异(P<0.05),见表2。

表2 3种EB病毒抗体筛查检测鼻咽癌的临床价值比较(n,%)
3 讨 论
NPC为我国发生率较高的恶性肿瘤之一,据统计全球NPC案例中我国占比高达80%,且男性患者数量比女性高2~3倍[4]。当前临床尚未明确NPC发生机制,多认为关联于遗传因素、病毒因素及环境因素。遗传因素主要为异常的白蛋白抗原基因,世界卫生组织证实人类肿瘤中70%~80%关联于环境因素[5],而体外实验结果表明香烟烟雾提取物可加快EBV复制,吸烟会增加鼻咽癌发生风险,且在健康男性中参与激活EBV环节。病毒因素主要为EBV,临床大量研究结果证实机体早期感染EBV或长期反复感染会致使鼻咽部上皮永生化并加快其恶化进程。EBV病毒属于嗜B细胞,为疱疹病毒之一,为多种疾病诱发因素,累及多个脏器、系统如消化道、血液及呼吸等,研究称EBV裂解感染状态关联于乳腺癌、食管癌及胃癌发生发展。
人类自然感染中EB十分普遍,水平传播,可在被感染宿主体内终身潜伏,EB病毒可通过口口方式进行转播,所以在人类群体中隐性感染者以及携带有EB病毒的无症状者是最为主要的传染源[6]。儿童期多为原发性感染时期,主要为隐性感染,咽部上皮细胞为常见感染部位,上皮B淋巴细胞被EBV侵袭后沿着淋巴系统携带病毒进入血液循环中,且将病毒性抗原释放出来,T淋巴细胞将抗原分子识别出后将其标志EBV-淋巴细胞破坏,但与此同时咽部上皮又会出现新感染EBV-B淋巴细胞,宿主被反复感染后EBV携带状态得以维持。有学者提出B淋巴细胞主要介导EBV的原发性感染及病毒持续状态[7]。细胞被EBV感染后若释放病毒为产病毒性感染,反之为非产病毒性感染,后者有两种形式,即潜伏性感染与恶性转化,潜伏性感染主要经过如下过程:细胞内有整个病毒基因组潜伏,经由DNA多聚酶保留复制于早s期;基因组表达形式并非整体,而是基因有限部分;基因组激活关键在于表达BRLF1与BLIF1基因[8]。当前临床提出NPC患者感染EBV的主要机制为受体学说,即EB病毒经由受体pIgR或CR2介导进入细胞[9]。在EB病毒抗体阳性与正常鼻咽上皮细胞鼻咽活检组织中均无EB病毒,而在鼻咽原位癌中有单克隆病毒基因组出现,由此推测恶性细胞克隆扩展前EB病毒感染已经发生。
鼻咽癌治疗效果取决于早期的检测,而EBV血清学的筛查能够有效明确鼻咽癌的高危人群[10]。罗耀凌等人临床研究中,疾病对照组的病毒Rta-IgG与EAIgA以及DNA的阳性率和健康对照组的之间数据比较无显著差异,这一结果表明了鼻咽癌在确诊之前患者的血清中便存在高滴度各类型EBV抗体、抗原,因此对EBV相关抗原抗体进行检测对于鼻咽癌患者血清学诊断具有重大意义[11]。以往临床检测EBV抗体的金标准为IIF,但需使用荧光显微镜,使用受限。而后曾毅于1982年用IE法检测VCA-IgA,临床逐渐将其作为常规方法,但其操作仍然比较繁琐,且主观影响因素较多;而ELISA操作简易,客观性高,重复性好,因此被临床广泛使用。在EBV抗体中VCA为病毒结构蛋白,合成于增殖周期,有较强的免疫抗原性。研究称绝大多数NPC患者血清为VCA IgA阳性[12],因此国内将其作为筛查与诊断NPC的常规手段,可提升NPC早期诊断率。本组结果表明VAC-IgA检测NPC的灵敏度为92.9%,特异性为89.6%,准确度为90.1%。该抗体灵敏度较高可能导致部分假阳性,加大临床工作量,而阳性患者中90%一生中可能无NPC患病风险,因此确诊或排除阳性患者还需开展大量工作,防止受检者承受巨大心理与精神压力,经常复查也会增加其经济负担[13]。但尽管VCA有上述弊端,临床还是将其作为筛查NPC的经典指标。
裂解复制期EBV会表达EA,有局限型与弥漫型两种,其发生代表体内开始EBV复制[14-15]。本组EAIgA抗体检测灵敏度为50.0%,特异性为99.9%,准确度为97.1%,,由此可知其灵敏度低,在其他肿瘤与正常人体内几乎不会被检出,NPC患者抗体滴度低于1.5时也难以显示阳性,因此部分患者可能漏诊,这是其最大弊端。因此临床在诊断NPC或筛查高危人群时多联合EA与VCA,两种均为阳性多数可确诊。RTA蛋白为EBV从潜伏期向裂解期转变的关键调控因子,可相继表达系列裂解早期基因,最终将EBV裂解干扰诱发。研究称在不同人群中Rta/IgG均有所表达,但程度不一,如鼻咽癌组阳性率为81.3%,肝癌组为10.5%,胃癌组为10.5%,肺癌组为10.5%,乳腺癌组为20.7%,宫颈癌组为15.8%[16],由此可知鼻咽癌组最高,因此在筛查NPC患者中使用Rta/IgG抗体检测效果较好,可对鼻咽癌癌变发生最早时刻予以捕捉,有较高的特异性,为临床筛查鼻咽癌的首选方式。本组结果表明Rta/IgG检测NPC的灵敏度为85.7%,特异性为93.3%,准确度为92.7%。当前临床认为Rta/IgG表达无关于NPC临床分期[17],但尚未明确其表达与NPC发生发展、转移及浸润关系,需临床深入探讨[18]。
综上所述,Rta准确度、灵敏度及特异度均较高,VCA灵敏度、特异度较高,EA特异度高但灵敏度较低,相比而言VCA、Rta筛查NCP临床价值较高,可结合实际选择联合检测法,避免漏诊。
[1]李仕伟,林艳丽,瞿 卫,等.探讨EB病毒抗体对鼻咽癌筛查和疗效的临床价值[J].标记免疫分析与临床,2016,23(1):113-114.
[2]张晓琍,周建林,曹颖平,等.鼻咽癌筛查中三种EB病毒抗体检测的应用[J].中华检验医学杂志,2015,38(2):111-114.
[3]邱厚匡,姚亚超,李 磊,等.EB病毒抗体及其DNA联合检测在鼻咽癌筛查和早期诊断中的价值[J].检验医学与临床,2015,8(10):1339-1341,1344.
[4]潘继钊,黄海深,朱苑霞,等.探讨三种EB病毒抗体检测在鼻咽癌筛查中的临床价值[J].中国医药科学,2016,6(19):225-228.
[5]李晓华,蒙以良,赵丽娟,等.壮族鼻咽癌患者EB病毒抗体与年龄的关系[J].中国老年学杂志,2014,17(10):2680-2682.
[6]吴尚文.血清EB病毒抗体检测在鼻咽癌临床诊断中的应用[J].河南外科学杂志,2013,19(2):93-94.
[7]邓卓霞,翁敬锦,司勇锋,等.广西鼻咽癌高发区人群初筛后2年随访结果分析[J].广西医学,2016,38(4):517-520.
[8]郑凤娇,傅泳航,陈文思,等.EB病毒重组抗原Rta蛋白的表达及用于鼻咽癌筛查ELISA方法的建立[J].解放军预防医学杂志,2016,34(4):464-467.
[9]陈裕锋.鼻咽癌高危人群中鼻咽拭子EB病毒DNA定量检测及其在鼻咽癌筛查中的应用[D].广西医科大学,2015.
[10]Ji Ming-fang,Yu Yuan-long,Cheng Wei-ming,Zong Yongsheng,Ng Park Sze-park,Chua Daniel Tsin-tien,Ng Munhon.Detection of Stage I nasopharyngeal carcinoma by serologic screening and clinical examination.[J].Chinese Journal of Cancer,2011,30(2):.
[11]罗耀凌,陈 浩,彭颂国,等.联合检测EB病毒不同抗体及EB病毒DNA在鼻咽癌血清学诊断中的价值[J].中华医学杂志,2013,93(44):3516-3519.
[12]王盼盼,季明芳,吴标华,等.鼻咽癌高发区人群患鼻咽癌风险率的动态观察[J].中华肿瘤防治杂志,2014,21(15):1144-1147.
[13]陈善昌,吴家恩,陈 栋,等.17175例体检人群中EB病毒抗体阳性结果分析[J].中国基层医药,2016,23(11):1653-1655.
[14]邓卓霞,王勇利,杜海军,等.广西地区三类人群EB病毒潜伏膜蛋白2特异性细胞免疫状态的研究[J].中华实验和临床病毒学杂志,2016,30(2):194-198.
[15]杜 云,俞 霞,季明芳,等.EB病毒血清抗体水平与鼻咽癌临床分期相关性研究进展[J].中国肿瘤临床,2016,43(19):869-872.
[16]连仕锋,季明芳,吴标华,等.EB病毒血清学筛查鼻咽癌高、中危人群的随访研究[J].中华预防医学杂志,2015,49(1):26-30.
[17]王盼盼.鼻咽癌血清学筛查研究进展[J].肿瘤研究与临床,2013,25(8):572-574.
[18]Ho Ching-Yin,Chan Kee-Tak,Chu Pen-Yuan.Comparison of narrow-band imaging and conventional nasopharyngoscopy for the screening of unaffected members of families with nasopharyngeal carcinoma.[J].European Archives of Oto-Rhino-Laryngology,2013.
