脑电监测α变异百分率与重型急性脑梗死发病90天预后的相关性研究
2018-01-19刘锦仪雷伟健欧阳婵余炳坚
刘锦仪 雷伟健 欧阳婵 余炳坚
2010年全球疾病负担研究(GBD 2010)报告显示,脑梗死已经日渐成为影响人类健康的全球性疾病,在伤残调整寿命年中排第3主要疾病[1]。目前,重型急性脑梗死的发病率及病死率仍居高不下。在美国,颅内压升高或意识恶化的重症脑梗死病人死亡率为50%~70%[2]。重型急性脑梗死的防治,重点是能在早期较为准确地勾勒不同患者临床预后发展的动态变化,从而为早期干预提供参考。因此,如何在早期较准确地对重型急性脑梗死临床预后在整体水平上进行动态评估,为早期干预提供时机,为干预手段提供参考,是重型急性脑梗死救治面临的重要挑战。本研究目的为通过持续监测重型急性脑梗死患者皮层脑电定量参数α变异百分率的动态变化,评价其在重型急性脑梗死发病90天的临床预后预测方面的临床应用价值,为重型急性脑梗死的全程管理提供一个全新的并有较好应用前景的检测预判方法,对日后重型急性脑梗死的监测、治疗及干预手段提供科学理论依据,从而减少重型急性脑梗死的致残率及死亡率。
1 资料与方法
1.1 研究对象
1.1.1 一般资料 本研究的研究对象是2016年1月至2017年3月在我院神经重症监护室住院的重型急性脑梗死患者。符合纳入标准,并剔除排除标准的入选研究对象共31例。男性21例,女性10例。平均年龄73.06岁,其中累及左侧大脑半球14例,累及右侧大脑半球17例。入组患者在入院时进行的美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分基线为 18.90±4.56分。
1.1.2 纳入标准 ①CT/MRI证实的颈内动脉系统脑血栓形成患者;②发病24 h内入院;③NIHSS≥16分[14];④年龄≥18岁;⑤患者或监护人签署入组知情同意书。
1.1.3 排除标准 ①双侧大脑半球均受累的颈内动脉系统脑血栓形成患者;②连续EEG提示爆发抑制脑电图者[4];③治疗过程中使用异丙酚≥20 mg/kg·min,或使用吗啡、咪达唑仑等≥2 mg/h者[4];④放弃治疗出院者。
1.2 仪器设备与工作参数
采用Nicolet公司,系列号为KAN8158030的Nicolet monitor进行连续脑电数据采集。采用国际脑电图学会联盟标准电极安装法(图1),10-20系统,32通道放大器,4电极蒙太奇记录背景脑电(F3、F4、P3、P4),F3、F4代表双侧额叶:P3、P4代表双侧顶叶;Cz放置参考电极,即中央电极;接地电极置于额极中点位置。使用Ten20导电膏将盘状电极固定在相应位置。时间基准为30 mm/s,灵敏度10.0 uv/mm,高切70 HZ。低切0.3 HZ,阻抗10 kQ。阻抗自动检测,当阻抗大于10 kQ时机器自动报警提示(图2)。

图1 10-20系统电极放置示意图

图2 Nicolet monitor检测电阻工作界面
1.3 研究方法
1.3.1 前瞻性 本研究为前瞻性研究。入组对象常规行定量连续脑电监护及临床治疗、护理及康复。终点事件为发病后90 d的临床疗效。由神经重症监护病房医师进行临床资料的收集,包括入选病人一般资料,神经功能评分,脑电功能监测等,但均不知晓患者预后结果;另有神经内科门诊医师于发病90天通过门诊随诊或家访进行终点预后评定,但该医师不知晓每例患者住院期间的一般临床资料、各项神经功能评分,和脑电监测结果。根据我国现行的脑卒中患者临床神经功能缺损评分标准(clinical nerve function defect score standard,CNFD)[3]观察临床疗效:基本痊愈、显著进步、进步、无变化、恶化、死亡。根据不同的临床疗效分为预后良好组(基本痊愈、显著进步、进步)与预后不良组(无变化、恶化、死亡)。
1.3.2 资料收集 一般资料:年龄,性别,受累部位,既往病史等。
神经功能评估:入院时及发病90 d均进行美国国立卫生研究院卒中量表(NIHSS)、格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)、脑卒中患者临床神经功能缺损评分标准(CNFD)评分。
临床疗效评定:
基本痊愈:功能缺损评分减少91%~100%,病残程度为0级;显著进步:功能缺损评分减少46%~90%,病残程度为1~3级;进步:功能缺损评分减少18%~45%;无变化:功能缺损评分减少或增多17%以内;恶化:功能缺损评分增多18%以上;死亡。
定量化脑电图参数:连续脑电监护仪(Nicoletmonitor型号KAN8158030)监测定量化脑电参数α变异百分率。α变异百分率数据来源为连续监测状态下记录每4小时的数值。取每24 h内观察得到的各时段α变异百分率计算入院24 h、48 h、72 h平均α变异百分率。若患者离开ICU外出检查,返回后重新记录连续4 h的α变异百分率。
1.4 统计分析
本研究数据采用SPSS 19.0统计软件,假设检验统一使用双侧检验,以P<0.05作为有显著性统计学意义,所有计量资料均以x±s形式,并予t检验进行差异比较。采用Spearman相关分析α变异百分率与临床疗效的相关性,ROC曲线分析不同数值α变异百分率对预后的预测价值。
2 结 果
2.1 入组病人一般情况
符合纳入标准,并剔除排除标准的入选研究对象共31例。其中男性21例(67.74%),女性10例(32.26%)。平均年龄73.06岁(73.06±15.26),累及左侧大脑半球14例(45.16%),累及右侧大脑半球17例(54.84%)。起病90天后随访,预后良好者19例(61.29%),预后不良者12例(38.71%),其中,基本痊愈0例,显著进步4例,进步15例,无变化4例,恶化2例,死亡6例。入院时NIHSS评分(18.90±4.56),GCS评分为(10.06±2.94),CNFD评分(34.94±4.96)。合并糖尿病者8例(25.81%),高血压者26例(83.87%),高血脂者29例(93.55%),心脏病者12例(38.71%),心房颤动者4例(12.90%),既往缺血性脑卒中者6例(19.35%),见表1。

表1 入组病人一般情况
2.2 α变异百分率与受累的大脑半球相关
入院后24 h、48 h、72 h观察中,病变侧大脑半球的α变异百分率较非病变侧大脑半球α变异百分率低。同时,入院后72h内,随着时间的延长,α变异百分率逐渐减少(表2)。
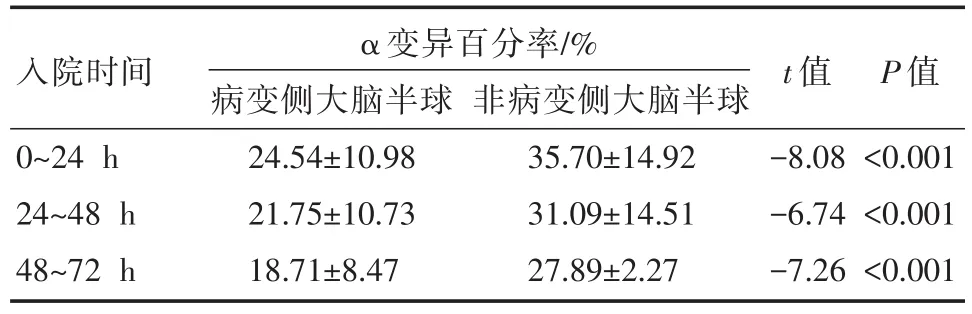
表2 入院72h内两侧大脑半球α变异百分率的差异比较
2.3 预后良好与预后不良组间的统计分析
2.3.1 将年龄、入院时NIHSS评分、GCS评分、CNFD评分 入院0~24h、24~48h、48~72h的平均α变异百分率(病变侧)等计量资料进行Shapiro-Wilks正态性检验,并在预后良好及预后不良组间进行两样本t检验。结果提示,入院时NIHSS评分、GCS评分、CNFD评分,入院0~24h,24~48h,48~72h平均α变异百分率在两组间均具有统计学差异(P<0.05)。预后良好组GCS评分、α变异百分率(病变侧)均值较预后不良组明显增高;NIHSS评分、CNFD评分明显减少。年龄两组间对比无统计学差异(表3)。

表3 预后良好组与预后不良组间各计量资料的统计分析
2.3.2 经Spearman相关分析 得出入院72h内病变侧α变异百分率、入院时GCS分值与临床疗效呈正相关,α变异百分率、入院时GCS分值越大,重型急性脑梗死发病90天临床预后越好。相反,入院时NIHSS、CNFD与临床疗效呈负相关,即入院时NIHSS、CNFD分值越大,重型急性脑梗死发病90d临床预后越差(表4)。
2.4 病变侧α变异百分率预测发病90d临床预后的价值
上述对重症急性脑梗死90d预后的分析中得出,发病早期α变异百分率(病变侧)与良好预后呈正相关。进行ROC曲线分析计算发病早期不同数值的α变异百分率(0~24h,24~48h,48~72h)预测发病90d临床预后的灵敏度及特异性中发现,入院0~24h,24~48h,48~72h病变侧α变异百分率均对良好预后具有辨别预测能力。0~24h病变侧α变异百分率曲线下面积:0.789,95%CI:0.633~0.946,P=0.007;24~48h 病变侧α变异百分率曲线下面积:0.768,95%CI:0.603~ 0.932,P=0.013;48~72h病变侧α变异百分率曲线下面积:0.833,95%CI:0.693~0.973,P=0.002(表 5,图 3)。发病早期(入院0~24h,24~48h,48~72h)病变侧α变异百分率各数值预测良好预后的灵敏度及特异性中可见(表6~8),兼顾预测预后的灵敏度及特异性,当病变侧α变异百分率≥20%时,其预测良好预后的灵敏度及特异性均较高。灵敏度分别为68.4%,63.25,63.2%,特异性分别为66.7%,75.0%,91.7%。

表4 α变异百分率、入院时GCS、NIHSS、CNFD与临床疗效的关系
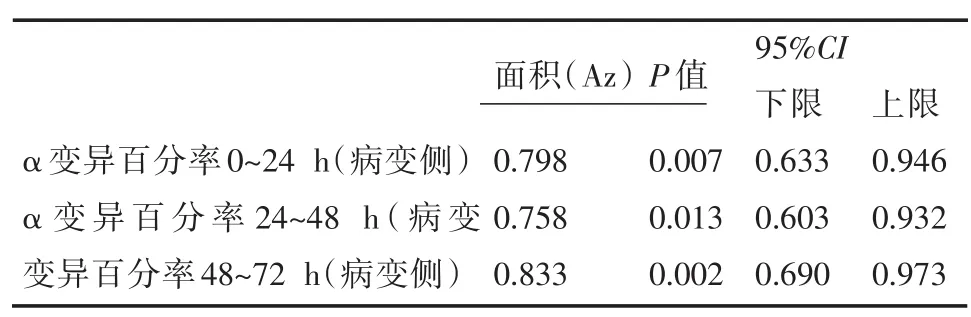
表5 α变异百分率的ROC曲线下的面积

图3 各时间段α变异百分率预测良好预后的ROC曲线

表6 0~24 h病变侧α变异百分率预测临床良好预后的灵敏度及特异性

表7 24~48 h病变侧α变异百分率预测临床良好预后的灵敏度及特异性
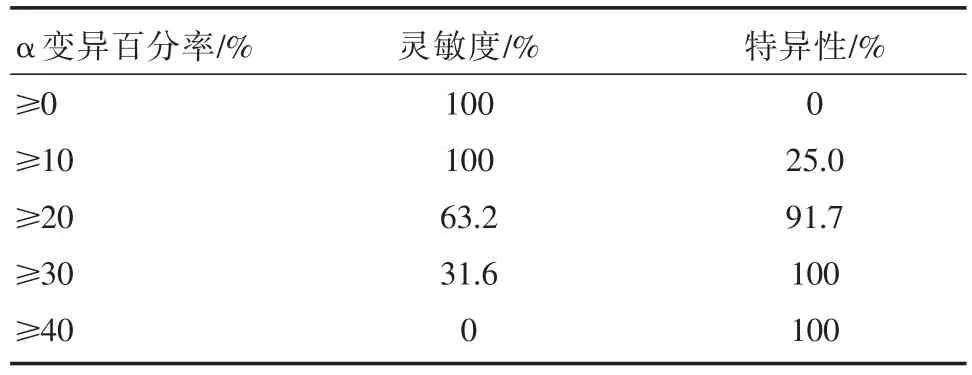
表8 48~72 h病变侧α变异百分率预测临床良好预后的灵敏度及特异性
3 讨论
3.1 α变异百分率的临床应用
脑电图(electroencephalogram,EEG)监测技术用于ICU已有半个世纪。脑电图监测在临床上可用于以下方面:①监测癫痫及癫痫持续状态;②监测脑血流;③监测脑缺血;④监测脑功能;⑤监测镇静药物作用;⑥监测降颅压药物作用[5-10]。
α波是脑电图中重要的一种波形,大多数正常成年人在闭眼放松时产生,睁开眼睛后明显减弱或消失,其频率在8~13 Hz;后头部有明显优势。α百分比(PA),定义为由总功率(1~20 Hz)分化出来的特定于8~13 Hz频率的功率,下降的变异趋势意味脑血流量下降。α变异百分率(percent alpha variability,PAV)反映患者脑血流量及蛛网膜下腔出血的预后。目前临床上主要用于脑卒中患者脑血流量监测及蛛网膜下腔出血患者血管痉挛导致的迟发效应。Vespa[11]发现在蛛网膜下腔出血的患者中,当脑血流量(CBF)充足时α波变异明显;当血管痉挛引起CBF降低时,α波变异突然降低;当血管痉挛消除后,α波变异又恢复正常。而在Sheorajpanday RV等[12]的研究中发现,相对α波比率,相对α-β波比率,相对δ-θ波比率,δ/α率,和δ-θ/α-β率与MRI呈现的梗塞体积呈良好相关,可能与腔隙性脑干梗塞CBF神经机能联系失能结果有关。
3.2 急性脑梗死发病90 d预后的相关因素分析
缺血性脑卒中又称脑梗死(cerebral infarct),为多种原因导致的脑内血管供血障碍,从而导致脑组织缺血、缺氧性坏死,出现相应神经功能缺失。根据美国国立卫生研究院卒中量表(NIHSS)评分,将NIHSS≤8分定义为轻度脑梗死,8<NIHSS<16分定义为中度脑梗死,NIHSS≥16分定义为重度脑梗死[14]。
GCS广泛应用于中枢神经系统损伤和意识障碍状态的评定。但GCS评分不包括瞳孔大小、对光反应、眼球运动和其他脑干反应。CNFD在临床脑卒中患者神经功能缺损的评价中得到了较为广泛的应用。陶子荣[15]曾于2009年对CNFD进行量表的质量研究,初步证实CNFD具有良好的信度和效度。因此,在本研究中,我们采用了NIHSS量表,GCS量表,CNFD量表等对神经系统功能进行综合评分,以更全面地评估患者的预后。
影响脑梗死预后因素很多,诸如年龄、性别、就诊时间,病变部位及面积大小、生活方式、既往基础疾病、及时合理治疗,并发症的干预及早期康复治疗等等。本研究中根据Spearman相关分析得到入院时NIHSS分值、GCS分值、CNFD分值、入院后 0~24 h、24~48 h、48~72 h α变异百分率(病变侧)与预后有关;入院时NIHSS分值、CNFD分值与良好预后呈负相关。GCS分值、入院后72 h内α变异百分率(病变侧)与良好预后呈正相关。
NIHSS评分直接反映患者发病时神经功能缺损程度,评分越高,预后越差。大量研究证明,神经功能缺损的严重程度与脑梗死急性期预后相关。2017美国心脏协会的一份报告提示,传统危险因素,如年龄、高血压、糖尿病、心脏病、周围血管病、卒中病史、血脂异常和吸烟仍是心脑血管病重要危险因素,但脑卒中严重程度(NIHSS评分)是决定死亡最主要的危险因素[16]。宋田等[17]对76例急性脑梗死患者进行前瞻性研究,结果表明基线NIHSS评分为急性脑梗死短期预后的独立预测因素,基线NIHSS评分高者预后相对较差。本研究中纳入的病例,入院时NIHSS分值均大于16分,与重型急性脑梗死90 d的不良预后明显相关,与上述研究结论一致。
α波变异百分率(PAV)可判断脑血流量(CBF),临床上主要用于脑卒中患者脑血流量检测及蛛网膜下腔出血患者血管痉挛导致的迟发效应。本研究中发现,α变异百分率在入院早期(0~72 h),随着时间的延长,α变异百分率逐渐下降,且在病变半球监测的α变异率低于非病变半球。病变半球与非病变半球α变异百分率分别为(0~24 h):24.54%±10.98%对35.70%±14.92%;(24~48 h):21.75%±10.73%对 31.09%±14.51%;(48~72h):18.71%±8.47%对27.89%±2.27%。这可能与缺血性脑卒中的病理改变有关。发病24 h后,脑组织大量神经细胞脱失,胶质细胞坏变,中性粒细胞、淋巴细胞及巨噬细胞浸润,脑组织明显水肿。另外,在缺血性脑卒中发病后,有可能出现血管痉挛致脑血流量减少,进一步加重脑缺血症状。因此,病变侧大脑半球的α变异百分对病情的分析更有参考意义。
采用α变异的百分率预测预后已有相当研究发表,Vespa PM等[13]通过分析89名中重度颅脑外伤患者3天内的α变异百分率,显示其预测预后的指标好于传统的临床预后判断指标。当α变异百分率≤10%(0.1)时与不良预后或死亡高度相关(阳性预测值为86%)[13]。在本研究中,我们发现,α变异百分率与脑梗死预后相关。预后良好与预后不良组对比中,入院早期各时段α变异百分率的差异均有统计学意义,且在Spearman分析中,α变异百分率与脑梗死90天的良好预后呈正相关。而在ROC曲线分析入院早期(0~72 h)α变异百分率对重型急性脑梗死发病90天的临床良好预后的预测中发现,当α变异百分率≥20%时,预测灵敏度为63.2%~68.4%,特异性为66.7%~91.7%,较其他数值兼顾了较高的灵敏度和特异性,所以,我们认为,发病早期病变侧α变异百分率≥20%时,其预测良好预后的临床价值优于其他数值。但在本研究中,发病早期的α变异百分率≥20%预测良好预后的灵敏度偏低,不如Vespa PM等的研究价值,可能与入组病例数较少有关,日后将扩大样本量进一步验证。
3.3 定量连续脑电监测的注意要点
在目前用于脑部监护的主要技术中,连续脑电监护是一项经济、安全、方便、可及时监测脑功能紊乱的监护技术。相对α变异百分率为定量化的脑电参数,使得患者监护团队能够容易掌握,但在定量化脑电监测过程中,如何减少干扰,避免混杂因素影响脑电信号,识别人工假象,是本研究客观性的重要环节。脑电图机的干扰包括外界干扰及机内干扰。外界干扰的主要表现为接地不良,输入短路,皮肤、电极接触电阻过大以及周围环境干扰,如电磁波干扰,病人躁动不安或有颅骨损伤、头皮水肿、安置颅内引流管等,均对脑电波造成干扰。机内干扰多为元件老化,差分放大管不对称,电源滤波电路故障等。因此,在本研究中,我们通过①对参与本研究的科研人员通过专业训练,系统学习脑电图知识,对爆发抑制脑电图等异常脑电图有充分的认识;②正确放置电极,电极安放位置选择国际10~20系统中的(F3、F4、P3、P4),每日定时检查电极固定的情况,必要时予以电极的更换;③尽量减少电磁干扰,保证电源的稳定,并合理设计地线,保证整机的接地良好,电极盒各插头与导线插头接触良好;④充分清洁皮肤,采用Ten20导电电极膏减少电极阻,所有导联电极阻抗均控制在10 kQ以内;5)避免电极盒、导线及患者直接碰触金属床架及仪器外壳。
本研究由于样本数所限,对定量脑电监测α变异百分率与重型急性脑梗死90 d临床预后相关性研究有待我们在今后的工作中扩充样本数来进一步修正。在日后的研究中,拟纳入更多的定量脑电监测的参数,如频谱熵,振幅整合脑电图,波段功率等,更综合地分析重症脑卒中的脑电功能变化与临床预后的关系。
本研究初步得出,α变异百分率与重型急性脑梗死90天临床良好预后呈正相关。发病早期α变异百分率≥20%时,提示临床的良好预后,灵敏度及特异性均较高。因此临床上有望通过连续脑电监测α变异百分率这一定量化脑电参数,来预测重型急性脑梗死发病90 d的病情转归。
[1] Murray CJ,Lopez AD.Measuring the global burden of disease[J].N Engl JMed,2013,369(5):448-457.
[2] 李刚,鲍欢,郝俊杰,等.急性缺血性卒中患者的早期诊疗指南-美国心脏协会/美国卒中协会为医疗保健专业人员制定的指南(第八部分)[J].中国卒中杂志,2013,8(12):984-987.
[3] 全国第四届脑血管病学术会议通过.脑卒中患者临床神经功能缺损程度评分标准[J].中华神经科杂志,1996,29(6):381-383.
[4] Matthew O.Hebb,David L.et al.Impaired percent alpha variability on continuous electroencephalography is associated with thalamic injury and predicts poor long-term outcome after human traumatic brain injury[J].J Neurotrauma,2007,24(4):579-590.
[5] Cha KM,Choi BM,Noh GJ,Shin HC.Novel methods for measuring depth of anesthesia by quantifying dominant information flow in multichannel EEGs [J].Comput Intell Neurosci,2017,2017:3521261.
[6] Yang PF,Shang MC,Lin Q,et al.Three-dimensional intracranial EEG monitoring in presurgical assessment of MRI-negative frontal lobe epilepsy [J].Medicine (Baltimore).2016,95(50):e5192.
[7] Zayachkivsky A,Lehmkuhle MJ,Ekstrand JJ,Dudek FE.Ischemic injury suppresses hypoxia-induced electrographic seizures and the background EEG in a rat model of perinatal hypoxic-ischemic encephalopathy[J].J Neurophysiol,2015,114(5):2753-2763.
[8] Hordacre B,Rogasch NC,Goldsworthy MR.Commentary:Utility of EEG measures of brain function in patients with acute stroke[J].Front Hum Neurosci,2016,10:621.
[9] Crouzet C,Wilson RH,Bazrafkan A,et al.Cerebral blood flow is decoupled from blood pressure and linked to EEG bursting after resuscitation from cardiac arrest[J].Biomed Opt Express.2016,7(11):4660-4673.
[10] Del Río R,Ochoa C,Alarcon A,et al.Amplitude integrated electroencephalogram as a prognostic tool in neonates with hypoxic-ischemic encephalopathy:a systematic review [J].PLoSOne,2016,11(11):e0165744.
[11] Vespa PM,Nuwer MR,Juhász C,et al.Early detection of vasospasmafter acute Subarachnoid hemorrhageusingcontinuous EEGICUmonitoring[J].Electroencephalogr Clin Neurophysiol,1997,103(6):607-155.
[12] Sheorajpanday RV,Nagels G,Weeren AJ,et al.Additional value of quantitative EEG in acute anterior circulation syndrome of presumed ischemic origin [J].Clin Neurophysiol,2010,121(10):1719-1725.
[13] Vespa PM,Boscardin WJ,Hovda DA,et al.Early and persistent impaired percent alpha variabilty on continuous electroencephalography monitoring as predictive of poor outcome after traumatic brain injury[J].Neurosurg,2002,97(1):84-92.
[14] Muchada M,Rubiera M,Rodriguez-Luna D,et al.Baseline National Institutes of Health stroke scale-adjusted time window for intravenous tissue-type plasminogen activator in acute ischemic stroke[J].Stroke,2014,45(4):1059-1063.
[15]陶子荣.我国脑卒中患者临床神经功能缺损评分标准信度、效度及敏感度的评价[J].第二军医大学学报,2009,30(3):283-285.
[16] Benjamin EJ,Blaha MJ,Chiuve SE,et al.chiuve heart disease and stroke statistics—2017 update a report from the American Heart Association [J].Circulation,2017,135(10):146-603.
[17] Sugiura Y,Yamagami H,Sakai N,et al.Predictors of symptomatic intracranial hemorrhage after endovascular therapy in acute ischemic stroke with large vessel occlusion[J].J Stroke Cerebrovasc Dis,2017,26(4):766-771.
