依达拉奉对蛛网膜下腔出血大鼠海马区神经细胞p-ERK1/2蛋白及自噬的影响
2018-01-19付程凯李建民赵宏涛刘俊杰赵雅宁李雪梅梁文吉
付程凯, 李建民, 赵宏涛, 刘俊杰, 赵雅宁, 李雪梅, 梁文吉
(华北理工大学1临床医学院实验中心; 2附属医院神经外科; 3护理与康复学院社区护理教研室, 河北 唐山 063000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是临床上常见的神经外科疾病,具有极高的伤残率和致死率。尽管目前在SAH诊断、临床手术治疗和影像放射等方面取得了进展,SAH患者死亡率有所下降,但存活者预后情况仍不容乐观[1]。传统研究认为SAH后的脑血管痉挛(CVS)是引起迟发性脑出血(DCI)和不良预后的主要原因。对SAH如何预防、控制已进行大量的研究,但结果并不理想,并未有效改善患者预后。而目前研究发现,减少早期脑部神经细胞的损伤和死亡是改善患者预后的关键[2]。Edaravone是一种强效的氧自由基清除剂,广泛用于SAH患者的治疗中。临床研究显示SAH患者Edaravone治疗组预后头痛症状和脑膜刺激征的改善明显优于对照组,且无不良反应,对SAH患者有明显脑保护作用[3]。也有动物实验证实Edaravone可抑制SAH大鼠海马区神经细胞凋亡,减轻其早期脑损伤[4-5]。但Edaravone在SAH的治疗中具体的神经保护机制尚不明确。有文献报道自噬在SAH后的神经损伤与保护中起重要的作用[6],自噬是真核细胞在生理或病理因子作用下通过自噬体和溶酶体融合的途径对受损的细胞器和蛋白质进行识别、降解的一种现象,是除凋亡、坏死以外的第三种细胞死亡方式[7]。目前研究认为自噬是一把双刃剑,适度的自噬具有神经保护作用,而过度激活的自噬可能加速神经细胞的死亡。关于Edaravone是否可以调控SAH后自噬的表达,目前未见报道。自噬的激活及调控机制复杂,涉及PIK3、MAPK、ERK1/2、JNK和P38等多条信号通路[8]。本研究拟选择ERK1/2信号通路,观察Edaravone对SAH后神经细胞自噬的影响,并探讨其可能的分子途径。
1 材料与方法
1.1实验动物清洁健康雄性SD大鼠40只,体质量350~450 g[北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003]。动物房温度 24~26℃,相对湿度40%~60%,饲养期间大鼠自由进食水,保证充足的饲料和饮水,大鼠适应环境1 w后开始实验。利用随机数字法随机分为假手术组(Sham组)、蛛网膜下腔出血模型组(SAH组)、Edaravone治疗组(Edaravone组)、ERK1/2抑制剂干预组(U0126组),每组10只,术前禁食水12 h。
1.2主要试剂和仪器兔抗beclin-1单克隆抗体(美国Abcam公司),DAB显色试剂盒(北京中杉金桥生物技术有限公司),二甲亚砜溶剂(DMSO,美国Sigma公司),GADPH(武汉博士德生物工程有限公司),大鼠脑立体定位仪(上海奥尔科特生物科技有限公司),OLYMPUS摄像显微镜(日本奥林巴斯公司),图像采集及分析系统(北京航空航天大学),酶标仪(北京普天新桥技术有限公司),电泳仪(北京东方仪器厂),电转槽(瑞典Phmarcia公司),Gel-Doc凝胶成像分析系统(美国Bio-Rad公司),PBS缓冲液,枸橼酸盐缓冲液。
1.3SAH大鼠模型制作及给药方法动物模型的制备:采用血管内穿刺[9]的方法复制SAH模型,大鼠用质量浓度为100 g/L的水合氯醛(35 mg/kg)腹腔注射麻醉,仰卧位固定,颈部剃毛,消毒,沿颈部中线剪开暴露右侧颈总动脉分叉。血管夹阻断颈外动脉,于血管夹近端剪断颈外动脉;将4-0单股尼龙线插入颈内动脉,从颈总动脉分叉开始,刺破大脑中动脉和大脑前动脉分叉处,停留15 s撤出,缝合伤口。Sham组在穿刺线刺入时感到阻力退出,不刺破大脑中动脉和大脑前动脉分叉,其余步骤与实验组相同。
麻醉清醒后,单笼饲养。Edaravone组通过腹腔给药干预,常规SAH造模术后以5 mg/kg给予Edaravone腹腔注射,12 h后重复给药1次,直至24 h处死。U0126组于造模前30 min前经尾静脉注射U0126,给药剂量为0.05 mg/kg,Sham组与SAH组注射等体积生理盐水。
1.4HE染色每组随机选取5只大鼠,在模型制造成功后24 h处死,用4%多聚甲醛灌注然后取脑,在30 min内及时固定,用酒精做脱水剂脱水透明;常规石蜡包埋,切片,贴片;梯度酒精水化,脱蜡染色;脱水透明,滴加中性树胶,加盖玻片,封固切片。每只大鼠海马CA1区取6个不完全重叠的视野,在光学显微镜(400倍)下观察视野内的细胞形态。应用Motic-6.0图像采集及图像分析系统观察计数高位视野下的存活与坏死神经细胞数。
1.5免疫组织化学染色标本采集同HE染色,切片常规脱蜡、水化,3%过氧化氢封闭10 min,高压热修复抗原90 s,分别滴加磷酸化ERK1/2(p-ERK1/2)、LC3-Ⅱ及beclin-1抗体(1∶200稀释),湿盒中37℃孵育30 min,然后滴加二抗(1∶400),37℃恒温箱孵育40 min,DAB显色、脱水、透明,中性树胶封片,于400倍光镜下观察并摄片,每张切片在海马CA1区随机选取5个视野,运用Image Pro Plus 6.0进行阳性细胞计数并测量平均A值,对结果进行半定量分析。

2 结果
2.1HE染色结果Sham组大鼠脑组织结构完整,海马区神经细胞形态正常且有序,数量较多,核仁清晰可见,胞核未固缩破裂。同Sham组比较,SAH组海马区神经细胞变性、水肿、肿胀,形成空泡结构,细胞核边界形状不规则,出现核固缩破裂溶解,神经细胞大量损伤,数量较少(P<0.05)。同SAH组比较,Edaravone组海马区神经细胞数量较SAH组明显增多(P<0.05),形态有所恢复,接近正常;U0126组海马区神经细胞形态不规整,细胞损伤加重,细胞数量较SAH组明显减少(P<0.05)。HE染色结果见图1,细胞计数分析见表1。

Sham组
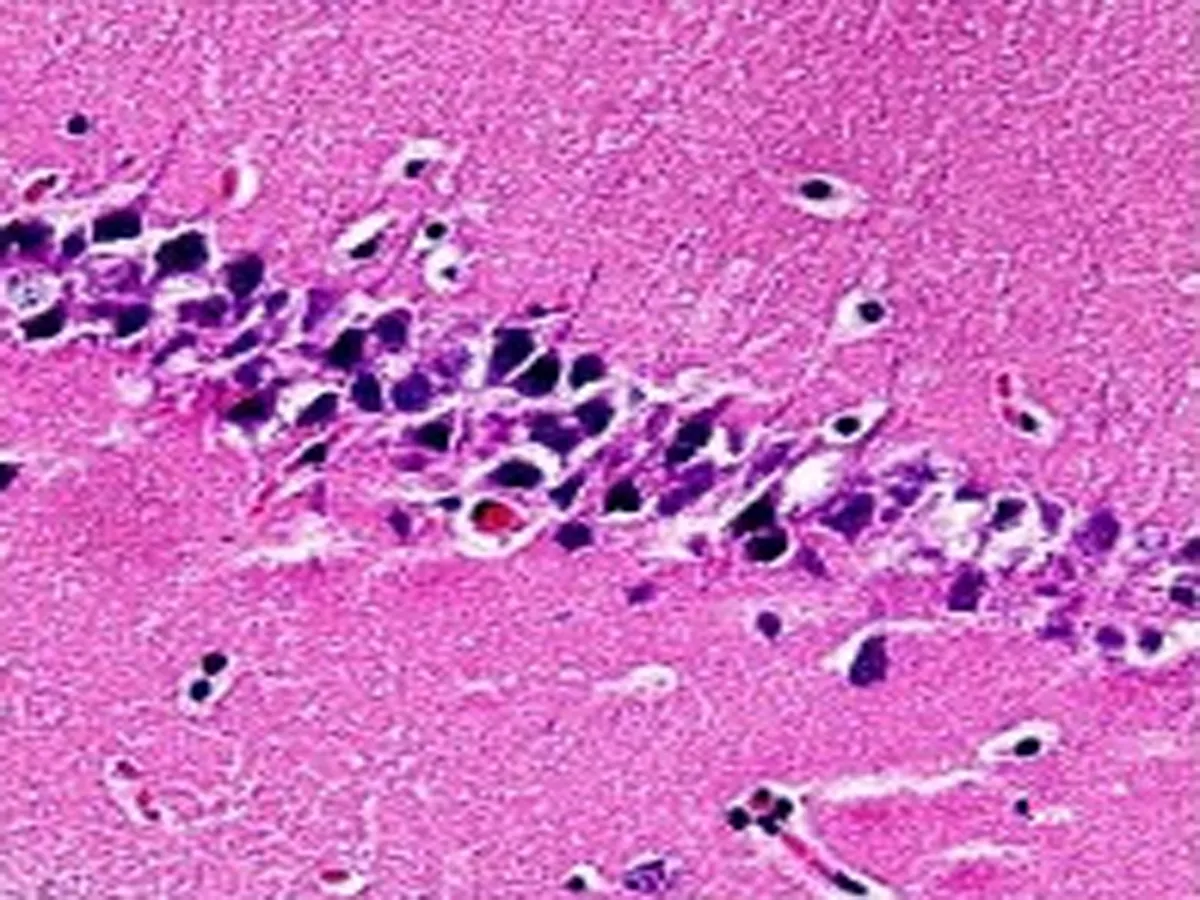
SAH组

Edaravone组
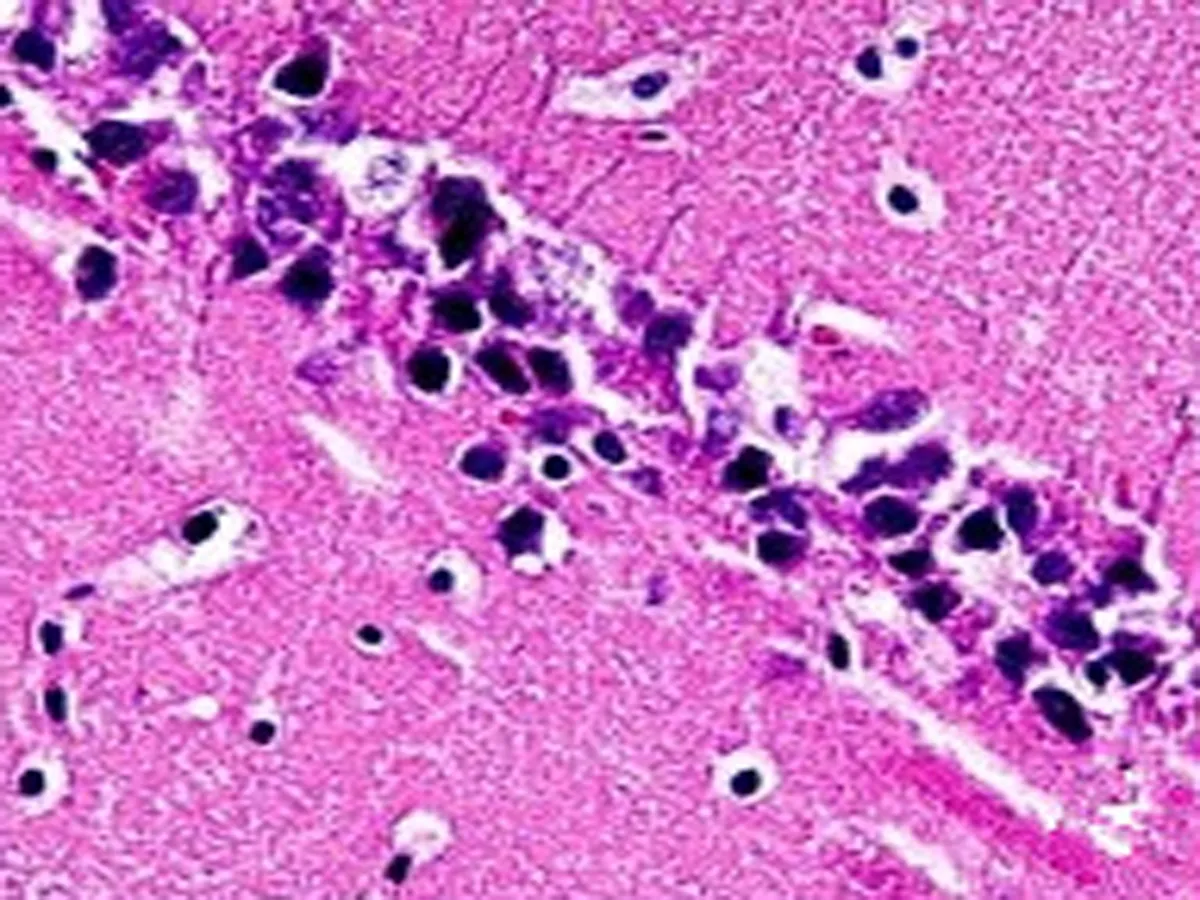
U0126组
图1 各组大鼠海马区神经细胞HE染色(HE×400)
注:与Sham组比较,*P<0.05; 与SAH组比较,△P<0.05。
2.2各组大鼠海马区beclin-1、LC3-Ⅱ、p-ERK1/2的表达beclin-1和LC3-Ⅱ蛋白主要表达于细胞胞质,阳性细胞胞质中可见大量棕黄色颗粒。与Sham组比较,SAH组阳性细胞数量明显增多(P=0.000);与SAH组比较,Edaravone组阳性细胞数量显著增多(P=0.000)、U0126组阳性细胞数量显著降低(P=0.000)。
阳性p-ERK1/2主要定位于细胞核,少数表达在细胞浆,阳性细胞染色呈棕黄色。Sham组大鼠阳性细胞数目较少,与Sham组比较,SAH组p-ERK1/2蛋白阳性细胞数量较多(P=0.000)。与SAH组比较,Edaravone组p-ERK1/2蛋白阳性细胞表达量明显增加(P=0.000)、U0126组p-ERK1/2蛋白阳性细胞表达量明显减少(P=0.000),见图2、表2。
3 讨论
本实验研究发现,Edaravone治疗可使SAH大鼠存活神经细胞的数量明显增加,提示其具体有神经保护作用。刘宏雅[10]在脑出血患者应用Edaravone治疗和常规治疗的对照中,发现其可以延缓神经细胞死亡和神经功能障碍,改善脑功能,提高脑出血患者的生活质量;彭秉纲等[11]和滕秀涵[12]应用Edaravone对脑出血患者治疗后发现其具有保护患者脑神经细胞、促进神经功能恢复的作用。本研究结果与众多研究结果一致,但其具体的保护机制尚未阐明。自噬性死亡又称Ⅱ型程序性细胞死亡(CDP),是细胞的一种自我降解途径,真核细胞在自噬相关基因调控下,通过自身溶酶体作用而降解细胞生物大分子、细胞器,以维持细胞的生长分化和稳定的过程。本研究结果发现自噬导致beclin-1和LC3-II蛋白表达异常增强,应用Edaravone治疗后其自噬蛋白表达量明显增加。周波等[13]建立帕金森病(PD)小鼠脑细胞自噬模型,利用Edaravone对其进行治疗后发现小鼠海马区神经细胞beclin-1和LC3-II蛋白表达量相对于对照组明显增加,且神经细胞死亡率下降;徐继伟等[4]在建立的SAH模型中应用Edaravone治疗,结果发现LC3-II、beclin-1表达显著增加,大鼠抓力恢复明显,神经损伤下降。本研究结果与此结果一致,说明Edaravone能够上调自噬相关蛋白的表达,适度激活自噬,保护脑神经细胞,减少神经细胞的损伤,促进神经功能恢复。
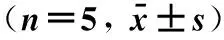
表2 各组大鼠海马区Beclin-1、LC3-Ⅱ和p-ERK1/2蛋白表达
注:与Sham组比较,*P<0.05;与SAH组比较,△P<0.05。

图2各组大鼠海马区神经细胞beclin-1、LC3-Ⅱ、p-ERK1/2的表达
ERK1/2是MAPK家族中的一类,其信号通路是最经典的MAPK信号通路,为三级激酶级联反应,即Ras-Raf-MEK-ERK1/2通路。当Ras受到外界鸟苷酸交换因子(GEF)刺激时可与三磷酸鸟苷(GTP)结合成为激活肽,GTP-Ras可以磷酸化Raf进而活化MEK/ERK[14]。而U0126是ERK1/2信号蛋白的特异性阻滞剂,可以有效地抑制ERK1/2磷酸化过程。本实验结果显示,与SAH组相比较,U0126组海马区神经细胞数量减少,自噬相关蛋白表达量降低,ERK1/2信号通路明显被抑制。同时本研究还发现,Edaravone治疗组p-ERK1/2蛋白表达水平明显上调,同时自噬水平也明显被上调。说明ERK1/2通路与自噬的激活之间存在正反馈循环,ERK1/2信号转导通路的激活能降低神经细胞自噬水平的表达。杨淑娟等[15]对TGF-β1诱导的肝星状细胞应用碧萝芷下调ERK1/2磷酸化水平后,自噬水平也明显被抑制,细胞损伤加重;刘俊杰等[16]对SAH大鼠早期脑损伤应用MEK的特异性阻滞剂U0126抑制ERK1/2信号通路后,大鼠自噬水平下降,脑损伤加重。综上所述,认为Edaravone可以通过ERK1/2信号蛋白的磷酸化适度提高神经细胞自噬的表达水平,进而发挥神经保护作用。
目前研究认为SAH后的脑血管痉挛(CVS)并非发生迟发性脑缺血(DCI)和迟发性缺血性脑损伤(NIND)的先决条件,而SAH后的早期脑损伤(EBI)则被认为是参与NIND发生的重要原因[2],而自噬在SAH后EBI中起保护作用,可以缓解EBI中的病理生理进程[17],但是目前对SAH后自噬的研究仅涉及到复杂的病理过程中的一小部分。本实验通过研究发现Edaravone可以激活ERK1/2信号蛋白,适度地提高了自噬的水平,进而保护神经细胞,以期为改善SAH患者预后和探索自噬在SAH中的作用提供方法和思路。
[1] TOPKORU B C, ALTAY O, DURS K, et al. Nasal administration of recombinant osteopontin attenuates early brain injury after subarachnoid hemorrhage[J]. Stroke, 2013, 44(11): 3189-3194.
[2] 冷放达,闫军浩.蛛网膜下腔出血研究: 从脑血管痉挛到早期脑损伤[J].解剖科学进展,2016,22(6):650-653.
[3] 蔺素英.脑保护剂Edaravone在蛛网膜下腔出血中的临床应用[J]. 医学理论与实践,2013,12(24):3257-3259.
[4] 徐继伟,赵雅宁,李建民,等. Edaravone对SAH大鼠海马区神经细胞自噬的影响[J]. 安徽医科大学学报,2016,4(4):531-535.
[5] 高阳.Edaravone治疗大鼠蛛网膜下腔出血神经保护机制的研究[D].南京医科大学,2008.
[6] 陈禹廷,刘俊杰,丁家杉,等. 抑制JNK通路对蛛网膜下腔出血大鼠海马区神经细胞自噬与学习记忆功能的影响[J]. 新疆医科大学学报,2017,40(2):196-200,205.
[7] 丁煌,唐映红,黄小平.自噬在脑缺血性损伤中的作用[J]. 中国药理学通报,2015,7(8):1048-1052.
[8] 覃芳,张智博.JNK信号通路与自噬的研究进展[J].中南大学学报(医学版),2015,40(9):1035-1038.
[9] KLEIN J, CRANER M, CUMMINS T R, et al. Sodium channel expression in hypothalamic osmosensitive neurons in experimental diabetes[J].Neuroreport,2002,13(11):1481-1484.
[10] 刘宏雅.Edaravone治疗脑出血的疗效观察[J].中国实用神经疾病杂志,2008,11(2):119-120.
[11] 彭秉纲,苏赤,肖彧,等.Edaravone对急性脑出血患者自由及含量的影响及临床效果探讨[J].临床医学工程,2016,2(35):633-634.
[12] 滕秀涵.Edaravone治疗脑出血患者的临床疗效[J].中国药物经济学,2016,11(4):62-63.
[13] 周波,文敏,王赟,等.Edaravone对帕金森病小鼠模型中脑细胞自噬的影响[J].山东大学学报(医学版),2012,50(8):1-4.
[14] MEBRATU Y, TESFAIGZI Y. How ERK1/21/2 actication controls cell proliferation andcell death:Is subcellular localization the answer[J]Cell Cycle,2009,8(8):1168-1175.
[15] 杨淑娟,何英利,马晓华,等. 碧萝芷通过下调ERK1/2磷酸化及自噬水平抑制TGF-自噬诱导的肝星状细胞活化[J]. 中国病理生理杂志,2016,12(12):2261-2265.
[16] 刘俊杰,赵雅宁,陈禹廷,等.ERK1/2信号通路抑制剂U0126对SAH大鼠早期脑损伤及神经元自噬的影响[J].西安交通大学学报(医学版),2017,38(1):1-7.
[17] 肖遥,徐善才,史怀璋,等.自噬在蛛网膜下腔出血后早期脑损伤中作用的研究进展[J].中国脑血管病杂志,2016,10(10):553-556.
