CalliSpheres载药微球经动脉导管化疗栓塞治疗肝癌患者的有效性及安全性分析
2018-01-19曹国洪李佳琪叶圣利陈卫飞王文晶胡文超
曹国洪,王 凯,李佳琪,叶圣利,陈卫飞,王文晶,胡文超
[树兰(杭州)医院放射科,浙江 杭州 310000]
肝癌是世界上最常见的恶性肿瘤之一,包括原发性肝癌(肝细胞癌、胆管细胞癌及混合型肝癌)和继发性肝癌。我国每年肝癌新发病例约39万,发病率居肿瘤的第5位,死亡居第2位[1]。近年来,经导管动脉化疗栓塞术(transarterial chemoembolization, TACE)已经成为中期不可切除肝癌的主要治疗方法[2-3]。传统TACE(conventional TACE, cTACE)由于载体碘油与化疗药混合乳剂稳定性差,化疗药容易分离并扩散到患者外周循环系统中,导致药物局部释放的不可控制性,进而加重化疗药物的全身不良反应[4]。而载药微球TACE (drug eluting beads TACE, DEB-TACE)因载药微球具有可以负载化疗药物并持续缓慢释放这个优点,不仅可长时间维持化疗药物的局部浓度,达到更高的客观反应率,而且降低了药物不良反应的发生率,使患者获益更多。目前针对CalliSpheres®DEB-TACE治疗肝癌患者的疗效和安全性的研究较少见。本研究旨在评估CalliSpheres®DEB-TACE治疗肝癌患者的疗效和安全性。
1 资料与方法
1.1 一般资料 连续收集2016年5月—9月在我院放射科就诊的肝癌患者20例,男18例,女2例,年龄18~80岁,平均(59.2±13.6)岁。其中肝细胞癌13例、胆管细胞癌患者3例、转移癌患者4例。肿瘤最大结节直径(6.13±4.76)cm。纳入标准:①参考美国肝病研究协会诊断标准,经临床、影像学和病理确诊为肝癌;②根据患者意愿和临床需要准备接受DEB-TACE治疗。排除标准:①合并严重肝功能或肾功能异常;②难以正常随访。本研究经我院伦理委员会批准,所有患者均签署知情同意书。患者的一般资料见表1。
1.2 治疗方法
1.2.1 CalliSpheres®微球加载化疗药物 本研究均采用100~300 μm的CalliSpheres®可载药微球。原发性肝癌均加载表柔比星50~100 mg,转移性肝癌均加载伊立替康100 mg。
1.2.2 微球栓塞治疗 ①肝动脉造影:采用Seldinger法经皮股动脉穿刺,置入5F动脉鞘,经鞘置入5F动脉导管插管至腹腔动脉造影,评价肝肿瘤的动脉血供情况,再使用3F微导管逐支超选至肿瘤所有的供血动脉;②动脉栓塞:以1 ml/min的速度缓慢注入混有对比剂的微球混悬液,待对比剂流速缓慢时停止栓塞;③再次造影:待5 min后继续造影,如发现仍有肿瘤染色,则继续步骤2,直至造影显示肿瘤染色全部消失;④拔出导管及导管鞘,穿刺点压迫止血加压包扎并制动24 h。
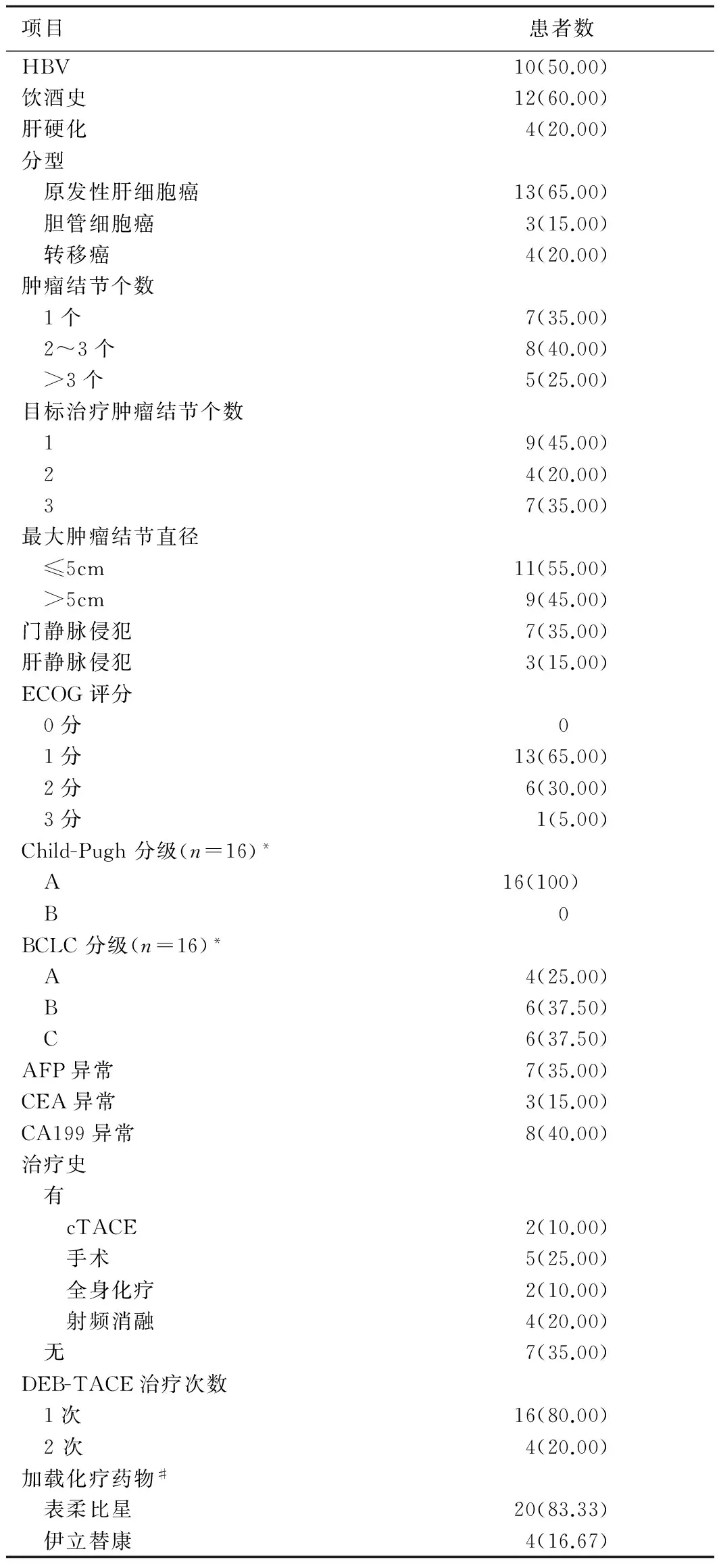
表1 患者的一般资料[例(%)]
注:*:为原发性肝癌患者的分级;#:共24例次接受加载化疗药物治疗
1.3 术后处理 常规给予还原性谷胱甘肽每日1.2 g,处理1周;恶心、呕吐患者予以格拉司琼3 mg或托烷司琼5 mg静脉推注治疗,并同时镇痛、通便以及对症补液支持治疗。
1.4 信息采集及评估 术前及术后记录患者临床、病理信息,记录术前、术后1周和术后1~3个月患者的白蛋白(ALB)、总胆红素(TBIL)、谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)水平。术后1~3个月采用改良实体瘤疗效评价标准4.0版评估DEB-TACE临床疗效,疗效分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD),总有效率(overall response rate, ORR)为CR+PR/总例数×100%。采用美国国立癌症研究所制定的常见不良反应事件评价标准评估肝功能异常情况及患者术中、术后常见不良反应(包括疼痛、发热、恶心、呕吐)。无复发生存 (relapse free survival, RFS)期指手术后至疾病复发或最后随访的时间间隔;总体生存(overall survival, OS)期指手术后至死亡或最后随访的时间间隔。
1.5 统计学分析 采用SPSS 21.0统计分析软件。连续变量采用±s表示,分类变量采用百分比表示。不同治疗次数的CR率比较及不同治疗时间点的肝功能分级比较采用χ2检验。绘制Kaplan-Meier(K-M)曲线分析患者的OS和RFS。P<0.05为差异有统计学意义。
2 结果
20例肝癌患者共38个癌结节。随访时间为56~212天,中位随访时间157.5天,最后随访日期为2016年12月。每次随访时间一般为DEB-TACE治疗后30~45天。对于DEB-TACE治疗后未达到CR的病例或病灶,分别采用手术或移植、cTACE、靶向药物及化学药物治疗,其中1例PD患者放弃治疗,采用镇痛对症支持治疗。
2.1 DEB-TACE治疗有效率 20例患者中,8例达到CR(8/20,40.00%)、8例达PR(8/20,40.00%)、3例达SD(3/20,15.00%)、1例达PD(1/20,5.00%),总体ORR为80.00%(16/20)。38个肝癌结节中,19个达CR(19/38,50.00%),12个达PR(12/38,31.58%),6个达SD(6/38,15.79%),1个达PD(1/38,2.63%),总体ORR为81.58%(31/38)。12个达PR肿瘤结节的总体肿瘤坏死率为(62.50±20.10)%,其中4个结节肿瘤坏死率>80%、5个结节肿瘤坏死率50%~80%、3个结节肿瘤坏死率<50%。
本组4例连续采用2次DEB-TACE治疗,16例仅采用1次DEB-TACE治疗。经过DEB-TACE连续治疗2次患者肿瘤总体(4/4,100%)和单个结节(8/8,100%)的CR均比仅1次DEB-TACE治疗患者的肿瘤总体(4/16,25.00%)和单个结节(11/30,36.67%)的CR更高(肿瘤总体:χ2=7.500,P=0.006;单个结节:χ2=10.133,P=0.001)。
患者经DEB-TACE治疗后的病理检查示微球分布在大部分血管内(图1A),其中一些病灶获得完全缓解,所有肿瘤细胞基本死亡(图1B);一些病灶仅获得部分缓解,仍有肿瘤细胞残存,坏死率较低(图1C),一些病灶获得部分缓解,少量肿瘤细胞残留,坏死率高(图1D)。
患者经DEB-TACE治疗前后的MRI示,治疗后右肝区的肿瘤相比治疗前均达到了完全坏死(图2A、2B),而DSA影像检查结果显示栓塞后的肿瘤血管相比栓塞前均达到完全栓塞(图2C、2D)。术中采用C臂CT评估栓塞程度及均匀度(图2E)。
2.2 DEB-TACE治疗后RFS和OS的K-M分析 DEB-TACE治疗后,患者的半年RFS率为85.00%,半年OS率为95.00%(图3)。
2.3 DEB-TACE治疗前后肝功能的比较 与治疗前比较,治疗后1周患者ALT(P=0.005)、AST(P=0.008)明显上升,治疗后1~3个月均恢复至治疗前水平(P=0.366、0.705);与治疗前比较,治疗后1周ALB、TBIL(P=0.932、0.096)及治疗后1~3个月(P=0.470、1.000)差异无统计学意义。
2.4 DEB-TACE治疗后的不良反应 术中及术后24 h内,出现轻至中度疼痛18例次,低至中度发热3例次,恶心、呕吐5例次。术后24 h至出院时间内,出现轻至中度疼痛8例次,低至高度发热18例次,恶心、呕吐仅有1例。

图1 DEB-TACE治疗后病理图 A.病理图示微球分布在大部分血管内(HE,×4); B.完全缓解病灶中肿瘤细胞基本死亡(HE,×10); C.部分缓解病灶中仍有肿瘤细胞残存,坏死率较低(HE,×10); D.部分缓解病灶中有少量肿瘤细胞残留,坏死率高(HE,×20)

图2患者男,59岁 A.DEB-TACE治疗前MRI; B.DEB-TACE治疗后MRI,右肝区的肿瘤均达到完全坏死; C.DEB-TACE治疗前DSA图; D.DEB-TACE治疗后DSA示栓塞后的肿瘤血管均达完全栓塞; E.术中采用C臂CT评估栓塞程度及均匀度

图3 DEB-TACE治疗后RFS和OS的K-M分析曲线
3 讨论
本研究发现:①经CalliSpheres®DEB-TACE治疗后,患者ORR可达80.00%,其中CR率达40.00%,而针对单个肿瘤结节的ORR可达81.58%,其中CR率为50.00%,提示DEB-TACE具有较好的临床疗效;②经DEB-TACE连续治疗2次患者肿瘤总体和单个结节相对于单次DEB-TACE治疗均可实现更高的CR;③DEB-TACE术后疼痛、发热、恶心、呕吐等不良反应轻微,患者耐受性好。本研究13例患者DEB-TACE前曾接cTACE (n=2)、手术(n=5)、射频消融(n=4)或全身化疗(n=2),但DEB-TACE前均明确复发,因此仅对复发灶进行疗效评价。
目前手术切除仍是治疗肝癌的首选方法,目前对于不能手术切除的中期肝癌患者推荐行TACE治疗。对于DEB-TACE治疗后未达CR的病例或病灶,笔者结合患者的病情、经济情况及意愿,分别采用手术或移植、cTACE、靶向药物及化学药物治疗,其中1例PD患者放弃治疗,采用镇痛对症支持治疗。由于本研究样本量较小,因此未进一步对其余治疗方法进行分析。
一项采用QuadraSphere 微球DEB-TACE治疗BCLC A 级肝癌患者的研究[5]显示,患者ORR为63.0%;另有研究[6]采用索拉菲尼联合DEB-TACE 治疗中期肝癌患者,治疗后的ORR为55.9%,均低于本研究的ORR(80%),原因可能为:①本研究样本量较少,单个病例较好的治疗效果可能导致整体较高的ORR;②对本组患者均行逐支超选肿瘤供血动脉,并于术中采用C臂CT评估栓塞程度及均匀度,尽可能做到真正去血管化。
一项研究[7]表明,DEB-TACE可以作为拟行肝移植手术早期肝癌患者的一种桥梁术式,使其满足行肝移植手术的米兰标准。研究[8]表明,DEB-TACE可以作为肝癌切除手术前的准备术式,使不能手术切除的巨大肿瘤缩小到可以手术切除的标准;以上研究[7-8]与本研究连续2次DEB-TACE治疗可以使患者达到更高的CR类似。从存活的区域分析主要原因可能为异位血供以及门静脉癌栓导致的动门静脉瘘患者需要二次补充栓塞。
既往研究[9]显示,DEB-TACE不良反应发生率低于cTACE治疗。另一项研究[10]显示,使用cTACE治疗后对90%以上患者会出现栓塞综合征,但使用DEB-TACE治疗的患者均出现了较好的耐受性。此外,有研究[11]显示,与cTACE治疗相比,DEB-TACE治疗并未加重患者的肝脏毒性,另有研究[12]显示,患者的阿霉素相关不良反应发生率显著降低。以上均表明肝癌患者对DEB-TACE治疗具有较好的耐受性。本研究发现经CalliSpheres®DEB-TACE治疗后,患者肝功能部分指标虽然1周内有所提高,但是1~3个月后恢复到治疗前水平。患者主要不良反应为发热(主要为低中热)和疼痛(轻至中度疼痛)、胸闷,少部分患者出现恶心、呕吐。
本研究的局限性:①为单中心设计且样本量较小,可能导致统计学效能较低;②DEB-TACE治疗前,13例患者接受cTACE、手术、射频消融或全身化疗,因此对DEB-TACE术前未接受任何治疗的肝癌患者的有效性及安全性还需进一步评估。
总之,CalliSpheres®DEB-TACE治疗肝癌可达到较高的临床缓解率,且不良反应少、无严重并发症,有较好的安全性,是治疗肝癌的有效方法。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015,65(2):87-108.
[2] Kishore S, Friedman T, Madoff DC. Update on embolization therapies for hepatocellular carcinoma. Curr Oncol Rep, 2017,19(6):40.
[3] Malagari K, Kiakidis T, Pomoni MA, et al. Pharmacokinetics, safety, and efficacy of chemoembolization with Doxorubicin-loaded tightly calibrated small microspheres in patients with hepatocellular carcinoma. Cardiovasc Intervent Radiol, 2016,39(10):1379-1391.
[4] Rahman F, Naidu J, Ngiu CS, et al. Conventional versus doxorubicin-eluting beads transarterial chemoembolization for unresectable hepatocellular carcinoma: A tertiary medical centre experience in Malaysia. Asian Pac J Cancer Prev, 2016,17(8):4037-4041.
[5] Bishay VL, Maglione K, Khanna R, et al. Chemoembolization with drug-eluting microspheres (DEM-TACE) for hepatocellular carcinoma: Single-center review of safety and efficacy. J Hepatocell Carcinoma, 2014,1:187-193.
[6] Lencioni R, Llovet JM, Han G, et al. Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC: The SPACE trial. J Hepatol, 2016,64(5):1090-1098.
[7] Manini MA, Sangiovanni A, Martinetti LA, et al. Transarterial chemoembolization with drug-eluting beads is effective for the maintenance of the Milan-in status in patients with a small hepatocellular carcinoma. Liver Transplantation, 2015,21(10):1259-1269.
[8] Gao S, Yang Z, Zheng Z, et al. Doxorubicin-eluting bead versus conventional TACE for unresectable hepatocellular carcinoma: A Meta-analysis. Hepatogastroenterology, 2013,60(124):813-820.
[9] Recchia F, Passalacqua G, Filauri P, et al. Chemoembolization of unresectable hepatocellular carcinoma: Decreased toxicity with slow-release doxorubicineluting beads compared with lipiodol. Oncol Rep, 2012,27(5):1377-1383.
[10] Nicolini D, Svegliati-Baroni G, Candelari R, et al. Doxorubicin-eluting bead vs conventional transcatheter arterial chemoembolization for hepatocellular carcinoma before liver transplantation.World J Gastroenterol, 2013,19(34):5622-5632.
[11] Song MJ, Chun HJ, Song DS, et al. Comparative study between doxorubicin-eluting beads and conventional transarterial chemoembolization for treatment of hepatocellular carcinoma. J Hepatol, 2012,57(6):1244-1250.
[12] Lammer J, Malagari K, Vogl T, et al. Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: Results of the PRECISION V study. Cardiovasc Intervent Radiol, 2010,33(1):41-52.
致谢
科研工作的顺利完成离不开他人的帮助,在正文的最后应向对本研究提供过帮助的人致以谢意。致谢的对象包括:对研究工作提出指导性建议者,论文审阅者,资料提供者,技术协作者,帮助统计者,为本文绘制图表者,提供样品、材料、设备以及其他方便者。
致谢必须实事求是,应防止剽窃掠美之嫌,也勿强加于人,如未经允许写上专家、教授的名字,以示审阅来抬高自己。致谢一般要说明被谢者的工作的内容,如“技术指导”、“收集资料” 、“提供资料”等。