内嗅皮质萎缩评价糖尿病患者认知功能
2018-01-19杨琪放周丽娜李传明尹训涛左智炜梁明龙
李 畅,杨琪放,周丽娜,李传明,尹训涛,左智炜,梁明龙,韩 祺,王 健*
[1.陆军军医大学(第三军医大学)第一附属医院放射科,2.内分泌科,重庆 400038]
2型糖尿病(type 2 diabetes mellitus, T2DM)是一种常见的全身代谢性疾病,研究[1]显示约10.8%~17.5%的T2DM患者会出现认知功能损害,包括早期的轻度认知功能损害(mild cognitive impairment, MCI)和晚期不可逆性的痴呆[2-3]。大脑皮质体积与认知功能密切相关。本研究通过MR结构成像探讨T2DM伴MCI患者大脑皮质体积的改变及其与认知功能的相关性,为临床诊断和疗监测提供帮助。
1 资料与方法
1.1 一般资料 收集2015年10月—2016年10月于我院内分泌科确诊为T2DM的患者30例(T2DM组)和T2DM伴MCI患者30例(T2DM伴MCI组)。T2DM均符合WHO的糖尿病诊断标准[4]。对MCI的诊断根据2006年欧洲老年痴呆症协会制定的MCI诊断标准[5],包括主诉记忆力减退、简易智力状态检查量表(mini-mental state examination, MMSE)>24分、蒙特利尔认知评估量表(montreal cognitive assessment, MoCA)<26分、临床痴呆评定量表(clinical dementia rating, CDR)≥0.5。排除[6-7]头部外伤,癫痫,酒精依赖,帕金森病,抑郁及其他神经精神类疾病,痴呆(MMSE≤24),严重抑郁[汉密尔顿抑郁量表(Hamilton depression scale, HAMD)≥18],幽闭恐惧症及MR禁忌证、糖尿病肾病、糖尿病视网膜疾病等糖尿病微血管病变者。另同期从社区招募30名健康志愿者为对照组(HC组),纳入标准:无糖尿病、神经精神类疾病及其他器质性疾病史,且MoCA≥26分、MMSE>24分。3组受试者均为右利手,年龄、性别以及受教育程度均匹配。本研究获得我院伦理委员会批准;受试者及家属均签署知情同意书。
1.2 实验室检查 影像学检查的当日清晨,对受试者空腹行实验室生化检查,包括糖化血红蛋白、空腹血糖、高密度脂蛋白、低密度脂蛋白、总胆固醇等。
1.3 仪器与方法 采用Siemens Trio Tim 3.0T MR扫描仪,常规8通道头部线圈。常规进行T1W、T2W和FLAIR序列扫描,以排除颅内器质性病变;然后采集高分辨率T1W结构像。扫描参数:TR 1 900 ms,TE 2.52 ms,TI 900 ms,翻转角 9°,矩阵256×256,层厚1.0 mm,体素1 mm×1 mm×1 mm,共176层。
1.4 图像分析 由2名工作10年以上的放射医师分别阅片,意见不一致时经协商解决。首先将所有高分辨率结构像数据转换为MGZ格式,然后使用FreeSurfer软件(version 5.3.0,http://surfer.nmr.mgh.harvard.edu),计算大脑皮质体积。计算步骤:①将数据进行Talairach转换配准;②去除颅骨、硬脑膜等非脑组织;③进行拓扑学校准;④将折叠的大脑膨胀化并行标准化处理;⑤通过以高斯分类图集脑模板匹配并信号阈值设定的方式区分脑皮质、脑白质和脑脊液;⑥通过mris_ca_label程序,按照Desikan-Killian和Christopher神经解剖学分类,将大脑皮质划分为34个脑区;⑦通过mris_anatomical_stats程序计算每个脑区大脑皮质体积[8]。
1.5 心理学量表测试 对所有受试者进行心理学量表测试,包括MMSE、MoCA、听觉词语学习测验(auditory verbal learning test, AVLT)、复杂图形测验(complex figure test, CFT)、数字广度测验(digit span test, DST)、词语流畅性测验(verbal fluency test, VFT)、连线测验(trail-making test, TMT)、数字符号编码测验(digit symbol coding Test, DSCT)和HAMD。
1.6 统计学分析 采用SPSS 18.0统计分析软件。计量资料以±s表示。采用单因素方差分析比较3组临床资料、实验室指标、心理学量表数据及大脑皮质体积值的差异,并采用Bonferroni法进行两两比较;采用χ2检验比较3组性别差异;采用两独立样本t检验比较T2DM组和T2DM伴MCI组的糖尿病病程。将3组间有差异的大脑皮质体积与有差异的实验室指标及心理学量表数据进行偏相关分析,同时将性别、年龄和受教育年限作为协变量。P<0.05为差异有统计学意义。
2 结果
2.1 实验室指标 T2DM组和HC组空腹血糖、糖化血红蛋白和高密度脂蛋白差异有统计学意义(P<0.05);T2DM组与T2DM伴MCI组间的实验室指标差异均无统计学意义;3组患者年龄、性别及受教育年限差异均无统计学意义(P>0.05),见表1。
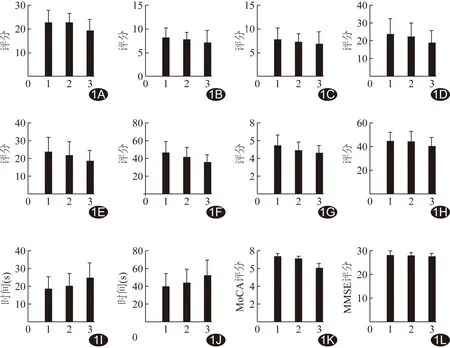
图1 3组受试者心理学量表评分比较 A.AVLT评分即刻; B.AVLT-5 min回忆评分;C.AVLT-20 min回忆评分; D.CFT-即刻评分; E.CFT-20 min回忆评分; F.DSCT评分; G.DST评分; H.VFT评分; I.TMT-A评分; J.TMT-B评分; K.MoCA评分; L.MMSE评分分 (1:HC组;2:T2DM组;3:T2DM伴MCI组)
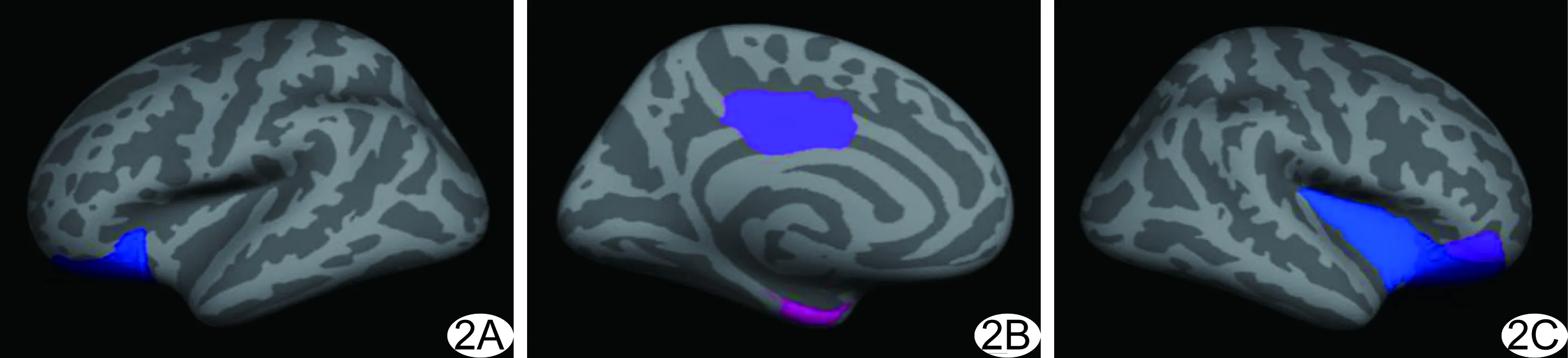
图2 T2DM伴MCI患者体积降低的脑区 A.左侧大脑外侧面; B.左侧大脑内侧面; C.右侧大脑外侧面
2.2 心理学量表得分 与HC组比较,T2DM组MoCA得分低(P<0.05);T2DM伴MCI组的AVLT即刻、CFT-20 min回忆、DSCT、TMT-A、TMT-B、MoCA评分均明显低于T2DM组(P<0.05),其余指标3组间差异无统计学意义(图1)。
2.3 脑区皮质体积 T2DM与HC组间各脑区皮质体积比较差异无统计学意义;与T2DM组比较,T2DM伴MCI组的左侧内嗅皮质、左侧外侧眶额皮层、左侧后扣带回皮质、右侧外侧眶额皮质、右侧眶部皮质、右侧岛叶皮质体积均降低(P均<0.05);与HC组比较,T2DM伴MCI组的左侧扣带回峡部皮质、左侧外侧眶额皮质、左侧颞中回皮质、左侧眶部皮质、左侧中央前回皮质、左侧岛叶皮质和右侧外侧眶额皮层、右侧顶上小叶皮质、右侧岛叶皮质体积降低(P均<0.05)。见表2、图2。
2.4 相关性分析 除T2DM伴MCI患者的左侧内嗅皮质体积与AVLT即刻评分呈正相关外(r=0.452,P=0.018;图3),T2DM伴CI及T2DM患者有差异的脑区皮质体积与实验室指标及心理学量表得分均无相关性。
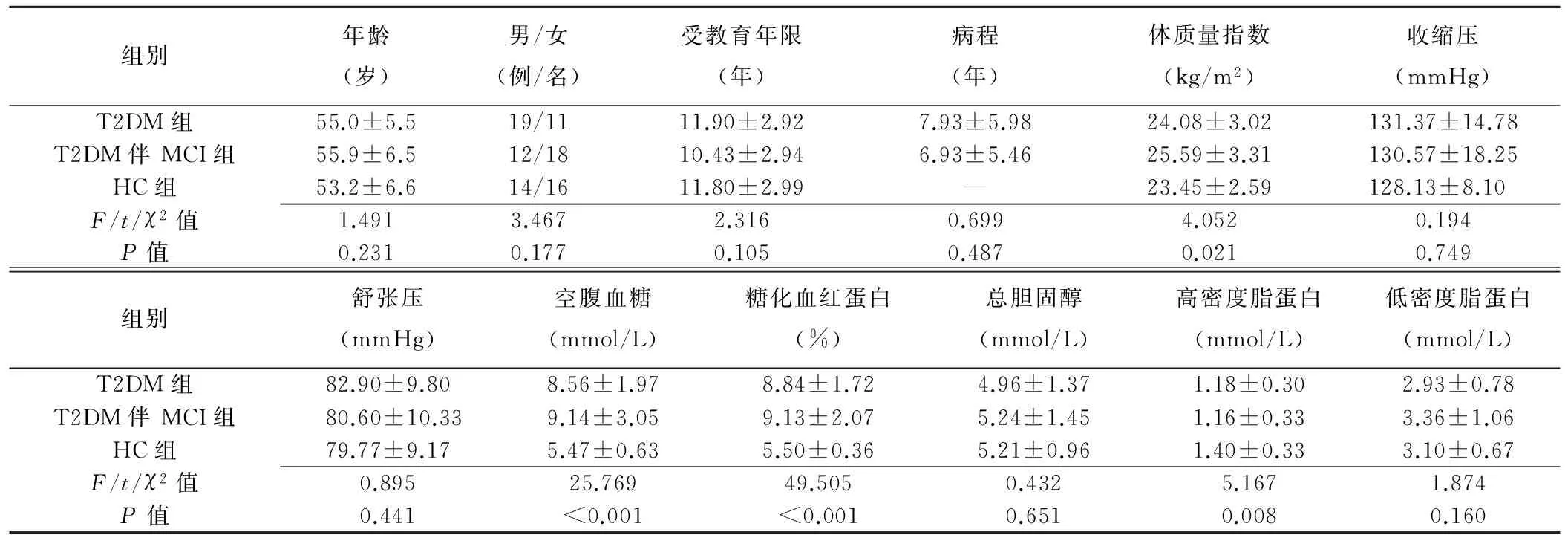
表1 3组临床资料和实验室指标比较(n=30)
表2 3组间有差异脑区的体积比较(mm3,±s, n=30)
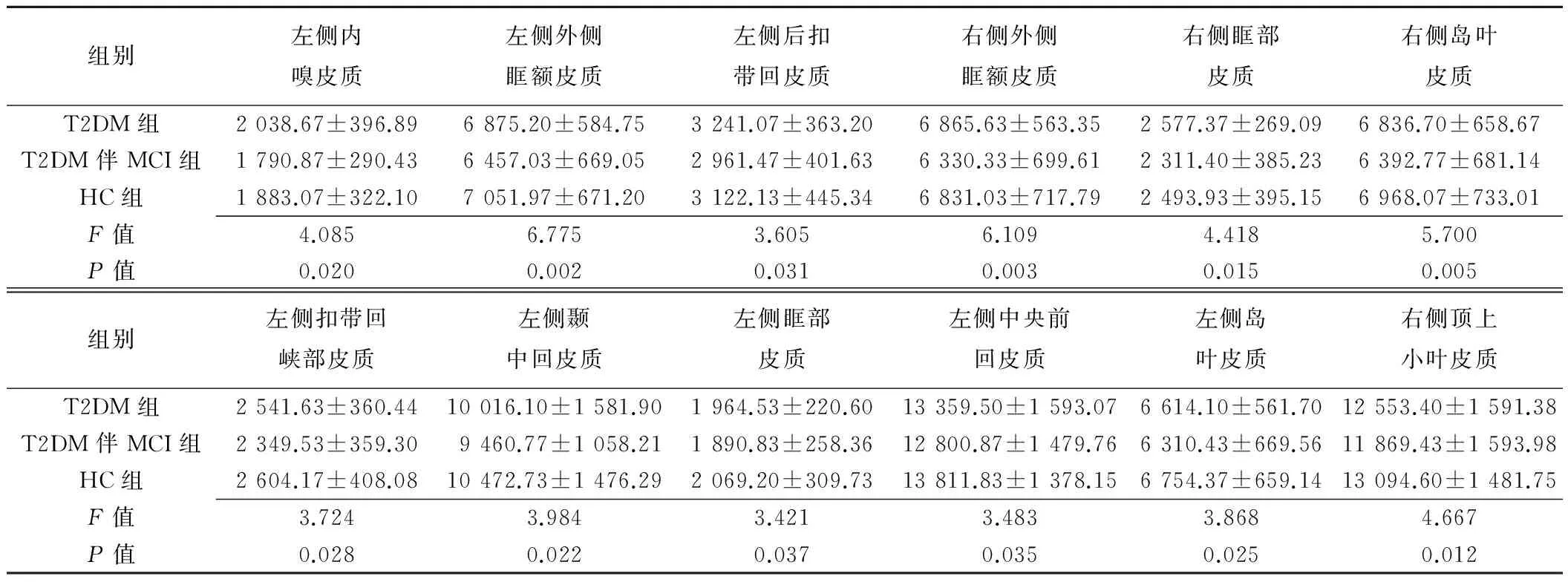
表2 3组间有差异脑区的体积比较(mm3,±s, n=30)
组别左侧内嗅皮质左侧外侧眶额皮质左侧后扣带回皮质右侧外侧眶额皮质右侧眶部皮质右侧岛叶皮质T2DM组2038.67±396.896875.20±584.753241.07±363.206865.63±563.352577.37±269.096836.70±658.67T2DM伴MCI组1790.87±290.436457.03±669.052961.47±401.636330.33±699.612311.40±385.236392.77±681.14HC组1883.07±322.107051.97±671.203122.13±445.346831.03±717.792493.93±395.156968.07±733.01F值4.0856.7753.6056.1094.4185.700P值0.0200.0020.0310.0030.0150.005组别左侧扣带回峡部皮质左侧颞中回皮质左侧眶部皮质左侧中央前回皮质左侧岛叶皮质右侧顶上小叶皮质T2DM组2541.63±360.4410016.10±1581.901964.53±220.6013359.50±1593.076614.10±561.7012553.40±1591.38T2DM伴MCI组2349.53±359.309460.77±1058.211890.83±258.3612800.87±1479.766310.43±669.5611869.43±1593.98HC组2604.17±408.0810472.73±1476.292069.20±309.7313811.83±1378.156754.37±659.1413094.60±1481.75F值3.7243.9843.4213.4833.8684.667P值0.0280.0220.0370.0350.0250.012
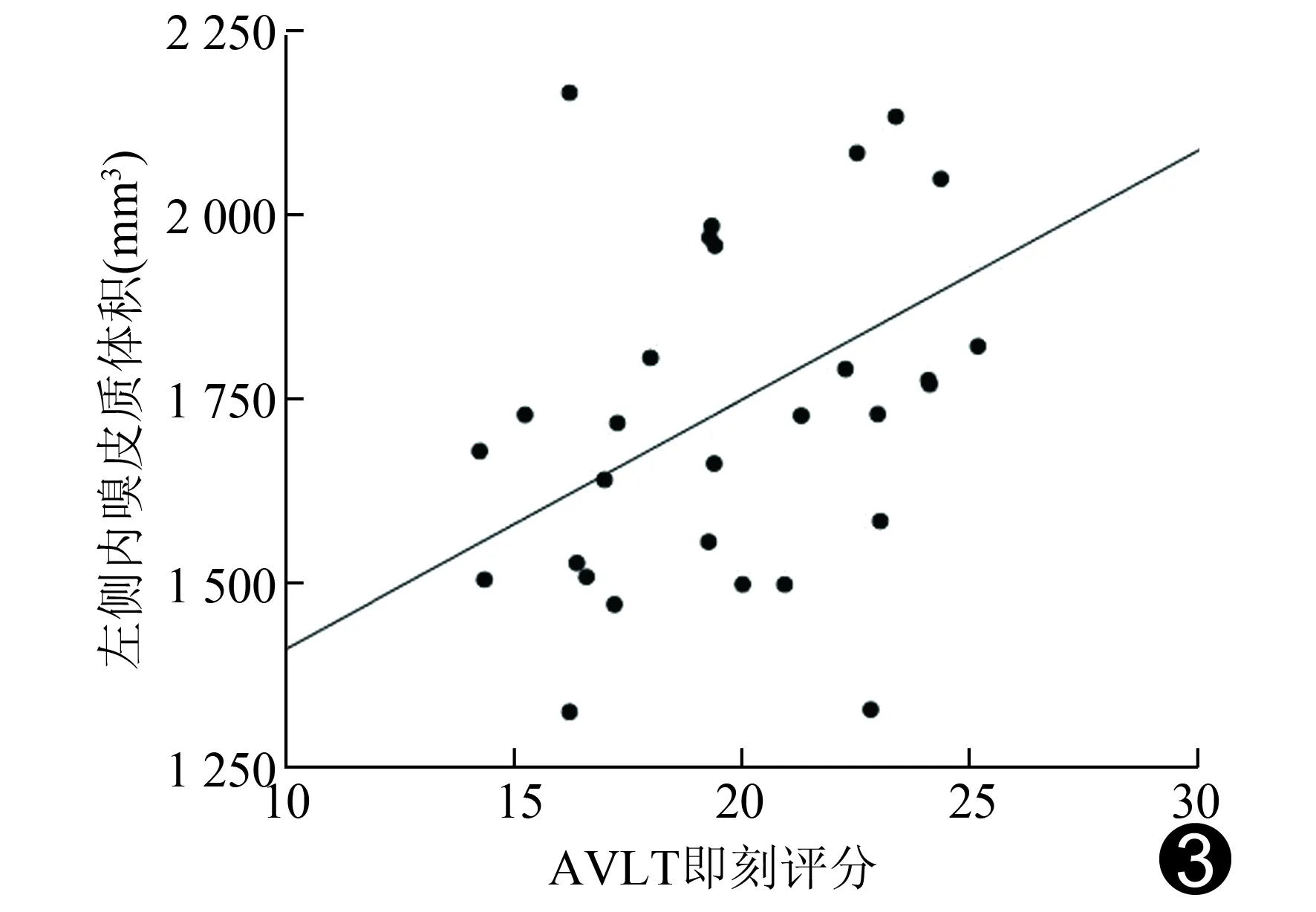
图3 T2DM伴MCI组左侧内嗅皮质体积与AVLT评分(即刻)相关性分析
3 讨论
MRI可无创分析大脑结构,其对大脑皮质体积的量化研究主要通过FreeSurfer和基于体素的形态学测量(voxel-based morphometry, VBM)软件。VBM因混杂了皮层大小、形态、位置等多方面数据,导致测量结果的特异性不高[9]。在分割方面,VBM对脑组织如灰质、白质和脑脊液的错配和分级敏感,灰白质交界区域可能被错误识别为密度萎缩,从而导致结果不准确[10]。因此本研究选择FreeSurfer对高分辨率T1W结构像数据进行分析,获得大脑皮质体积数据。
本研究显示,与T2DM组比较,T2DM伴MCI组的AVLT即刻、CFT-20 min回忆、DSCT、TMT-A、TMT-B、MoCA得分均明显低于T2DM组。表明T2DM伴MCI组患者词语记忆、图形回忆、言语逻辑等认知功能出现损害,与既往研究[11]结果一致。
体积检测和相关分析表明内嗅皮质是糖尿病患者认知损害的关键脑区。内嗅皮质位于内侧颞叶,与海马、海马旁回和杏仁核等联系紧密,其作用主要与记忆有关[12]。研究[13]显示,MCI的病理学改变主要为内嗅皮质等颞叶内侧结构的体积降低,甚至在出现症状之前,颞叶内侧体积已经开始出现降低,可能因内嗅皮质结构改变通常早于海马结构的改变,因此测量内嗅皮质体积更具有预测性[14]。MCI的发生与内嗅皮质体积的萎缩明显相关,其中以左侧内嗅皮质体积减小最为显著。本研究发现,与T2DM组比较,T2DM伴MCI组的左侧内嗅皮质体积降低,与既往研究[15]结果一致。左侧内嗅皮质体积减少与记忆功能密切相关[16]。而AVLT主要反映词语记忆功能,主要与颞叶内侧脑区有关。本研究发现T2DM伴MCI患者的左侧内嗅皮质体积与AVLT即刻得分呈正相关,与既往研究[17]结果一致。有研究[18]证实,内嗅皮质体积萎缩可用于区分健康对照组和轻度阿尔兹海默病患者,还可评价阿尔兹海默病的进展情况。通过测量内嗅皮质体积的降低程度可较精确地区分出MCI[19]。因此,左侧内嗅皮质体积的变化可作为诊断T2DM伴MCI和反映病情发展情况的潜在生物学指标。
除内嗅皮质外,与T2DM组比较,T2DM伴MCI组的左侧外侧眶额皮层、左侧后扣带回皮质、右侧外侧眶额皮质、右侧眶部皮质、右侧岛叶皮质体积均降低。外侧眶额皮层位于前额皮质,主要与认知决策有关[20]。后扣带回皮质位于扣带回皮质后侧,其作用主要与空间记忆和学习认知有关[21]。眶部皮质位于额下回皮质眶部,其作用主要与语言组织和选择相关[22]。岛叶皮质与意识、表达、认知以及情感有关[23-24]。这些脑区的皮质功能均与认知功能密切相关。脑皮质体积改变可能与糖尿病所致微血管病变有关[25]。本研究的局限性为患者样本量较小,还可进一步增加样本量,从而获得更多有意义的结果。
综上所述,T2DM患者发生认知损害与左侧内嗅皮质、外侧眶额叶、后扣带回、右侧外侧眶额叶、眶部皮质、岛叶皮质体积降低相关,其中左侧内嗅皮质体积可作为潜在的诊断和衡量T2DM认知损害发展情况的生物学指标。
[1] van Harten B, de Leeuw FE, Weinstein HC, et al. Brain imaging in patients with diabetes: A systematic review. Diabetes Care, 2006,29(11):2539-2548.
[2] Biessels GJ, Deary IJ, Ryan CM, Cognition and diabetes: A lifespan perspective. Lancet Neurol, 2008,7(2):184-190.
[3] 彭娟,罗天友,陈莉,等.2型糖尿病患者脑局部一致性的静息态功能MRI.中国医学影像技术,2017,33(1):6-10.
[4] Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet Med, 1998,15(7):539-553.
[5] Portet F, Ousset PJ, Visser PJ, et al. Mild cognitive impairment (MCI) in medical practice: A critical review of the concept and new diagnostic procedure. Report of the MCI Working Group of the European Consortium on Alzheimer's Disease. J Neurol Neurosurg Psychiatry, 2006,77(6):714-718.
[6] Peng B, Chen Z, Ma L, et al. Cerebral alterations of type 2 diabetes mellitus on MRI: A pilot study. Neurosci Lett, 2015,606:100-105.
[7] Chen Z, Sun J, Yang Y, et al. Cortical thinning in type 2 diabetes mellitus and recovering effects of insulin therapy. J Clin Neurosci, 2015,22(2):275-279.
[8] Desikan RS, Segonne F, Fischl B, et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. Neuroimage, 2006,31(3):968-980.
[9] Ashburner J. Computational anatomy with the SPM software. Magn Reson Imaging, 2009,27(8):1163-1174.
[10] Salmond CH, Ashburner J, Vargha-Khadem F, et al. Distributional assumptions in voxel-based morphometry. Neuroimage, 2002,17(2):1027-1030.
[11] Moheet A, Mangia S, Seaquist ER. Impact of diabetes on cognitive function and brain structure. Ann N Y Acad Sci, 2015,1353:60-71.
[12] Suthana N, Haneef Z, Stern J, et al. Memory enhancement and deep-brain stimulation of the entorhinal area. N Engl J Med, 2012,366(6):502-510.
[13] Li X, Coyle D, Maguire L, et al. Gray matter concentration and effective connectivity changes in Alzheimer's disease: A longitudinal structural MRI study. Neuroradiology, 2011,53(10):733-748.
[14] Miettinen PS, Pihlajamaki M, Jauhiainen AM, et al. Structure and function of medial temporal and posteromedial cortices in early Alzheimer's disease. Eur J Neurosci, 2011,34(2):320-330.
[15] Lopez ME, Bruna R, Aurtenetxe S, et al. Alpha-band hypersynchronization in progressive mild cognitive impairment: A magnetoencephalography study. J Neurosci, 2014,34(44):14551-14559.
[16] Di Paola M, Macaluso E, Carlesimo GA, et al. Episodic memory impairment in patients with Alzheimer's disease is correlated with entorhinal cortex atrophy. A voxel-based morphometry study. J Neurol, 2007,254(6):774-781.
[17] Winblad B, Palmer K, Kivipelto M, et al. Mild cognitive impairment--beyond controversies, towards a consensus: Report of the International Working Group on Mild Cognitive Impairment. J Intern Med, 2004,256(3):240-246.
[18] Long X, Chen L, Jiang C, et al. Prediction and classification of Alzheimer disease based on quantification of MRI deformation.PLoS One, 2017,12(3):e0173372.
[19] Matsuda H. The role of neuroimaging in mild cognitive impairment. Neuropathology, 2007,27(6):570-577.
[20] Tanferna A, Lopez-Jimenez L, Blas J, et al. Different location sampling frequencies by satellite tags yield different estimates of migration performance: Pooling data requires a common protocol. PLoS One, 2012,7(11):e49659.
[21] Tomadesso C, Perrotin A, Mutlu J, et al. Brain structural, functional, and cognitive correlates of recent versus remote autobiographical memories in amnestic mild cognitive impairment. Neuroimage Clin, 2015,8:473-482.
[22] Knoch D, Gianotti LR, Pascual-Leone A, et al. Disruption of right prefrontal cortex by low-frequency repetitive transcranial magnetic stimulation induces risk-taking behavior. J Neurosci, 2006,26(24):6469-6472.
[23] Xue G, Lu Z, Levin IP, et al. The impact of prior risk experiences on subsequent risky decision-making: The role of the insula. Neuroimage, 2010,50(2):709-716.
[24] Basilakos A, Fridriksson J, Rorden C, et al. Activity associated with speech articulation measured through direct cortical recordings. Brain Lang, 2017,169:1-7.
[25] 邹燕珂,黄晶,熊波,等.三维斑点追踪成像评价糖尿病患者心脏损害的Meta分析.中国介入影像与治疗学,2017,14(2):86-91.
