改性大豆磷脂在脂质体制备中的应用研究
2018-01-19赵多艳卫延安南京理工大学化工学院南京210094
赵多艳,卫延安(南京理工大学 化工学院,南京 210094)
长循环脂质体又称空间稳定脂质体(sterically stabilized liposomes, SSL),具有增加靶向性、延长药物在血液循环中的半衰期、提高其体内稳定性、改变脂质体在体内的生物学分布、隐性等优点[1],广泛用作抗癌、抗菌、抗寄生虫、抗病毒等的药物载体。SSL是通过在脂质体的成分中加入一定比例的糖脂(如单唾液酰神经节苷脂GM1)或在磷酸分子上连接含多羟基基团的物质(如聚乙二醇PEG),使脂质体表面暴露出一些亲水性的多糖或多羟基基团等方式,减少与血浆中调理成分的结合,从而使脂质体稳定[2]。由于GM1难以大量提取或合成,且价格比较昂贵,目前应用最广泛的是PEG化脂质体。
磷脂酰乙醇胺-聚乙二醇作为药物辅料在靶向药物输送和药物缓释等方面具有较好的应用价值,是常用的脂质体空间稳定膜材料,然而其昂贵的价格,在一定程度上制约了SSL的研究及应用[3-4],所以寻找一种合适的替代品很有必要。
大豆磷脂是加工大豆油的一种副产物,主要由大豆磷脂酰乙醇胺(SPE)和大豆磷脂酰胆碱(SPC)组成,其中SPE中存在较多的不饱和脂肪酸,具有软化血管、降低血压和胆固醇的功能[5-7]。用SPE作为合成磷脂酰乙醇胺-聚乙二醇的磷脂来源,能够显著降低成本,具有一定的开发前景。本文以大豆磷脂和聚乙二醇单甲醚2000(MPEG2000)为原料制备了改性大豆磷脂——大豆磷脂酰乙醇胺-聚乙二醇单甲醚2000(SPE-MPEG2000),并对用其制备的SSL进行了体外稳定性评价。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
聚乙二醇单甲醚2000:海安石油化工厂;大豆磷脂(工业级;PC含量约21.2%,PE含量约19.8%,PI含量约16.2%,PA含量约6.9%):广州倚德磷脂科技有限公司;氢化大豆磷脂(HSPC,PC含量约95%)、胆固醇(Chol,95%):南京都莱生物技术有限公司;钙黄绿素(98%,色谱纯):无锡中坤生化科技有限公司;葡聚糖凝胶G-50:上海源叶生物科技有限公司;二次蒸馏水:实验室自制;其他试剂均为国产分析纯。
1.1.2 仪器与设备
AVANCE(III)500MHz型核磁共振仪:瑞士 Bruker; Nicolet iS10 FTIR型红外光谱仪、EVOLUTION220型紫外可见分光光度计:美国赛默飞世尔科技公司;Tecnai 12型透射电子显微镜:美国FEI;ZS90型纳米粒度及Zeta电位仪:英国Malvern;FL3-Tcspc型荧光光谱仪:法国HoribaJobinYvon;UP-250手携式超声波细胞粉碎机:宁波新芝生物科技股份有限公司;透析袋。
1.2 实验方法
1.2.1 SPE-MPEG2000的制备
以MPEG2000为原料,采用琼斯试剂氧化法室温下制备聚乙二醇单甲醚2000羧基衍生物(CMPEG2000),然后以CMPEG2000为原料,制备高活性的聚乙二醇单甲醚2000酰氯,最后以聚乙二醇单甲醚2000酰氯为原料与经丙酮脱油处理后的大豆磷脂反应制备SPE-MPEG2000,具体制备过程参照文献[3]。将产物置于透析袋中透析1周以除去未反应的MPEG2000[8-10],然后冻干,备用。
1.2.2 SPE-MPEG2000的鉴定
分别采用核磁共振波谱法和红外光谱法对SPE-MPEG2000进行鉴定。
核磁共振波谱法检测条件:氢核共振频率500 MHz;5 mm PABBO BB的仪器探头;溶剂为DMSO;内标物质为TMS;脉冲序列为Lclpncwps;弛豫时间为3.00 s;采样次数为16次。
红外光谱法:溴化钾压片。
1.2.3 脂质体的制备
以薄膜分散法[11]制备普通脂质体CLs(组成为HSPC-Chol,二者摩尔比为2∶1)和含有SPE-MPEG2000的SSL(组成为HSPC-Chol-SPE-MPEG2000,摩尔比为2∶1∶0.2)。分别取一定量的脂质材料溶于适量氯仿,减压旋转蒸发挥去氯仿,得到脂质薄膜,于真空干燥箱中放置一段时间,待有机溶剂挥干后,加入5 mL磷酸盐缓冲液(PBS, pH 7.4)进行旋转水化,然后置于水浴中超声使之形成脂质体悬液。将上述脂质体悬液进行探头超声6 min,进一步匀化脂质体粒径,3 500 r/min离心10 min后,弃去少量沉淀,过0.22 μm滤膜3次,得脂质体CLs和SSL。
1.2.4 脂质体的形态观察
分别吸取等量且适量的两种样品并以PBS缓冲液稀释相同倍数后(下同),滴于电镜铜网上,铜网自然晾干后,使用磷钨酸负染,待干燥后,使用透射电子显微镜观察并拍照。4℃放置30 d后再次测定。
1.2.5 脂质体粒径及Zeta电位的测定
CLs和SSL于制备后立即测定其平均粒径、粒度分布、多分散系数以及Zeta电位,4℃放置30 d后再次测定。测试条件:测试温度为25℃;分散介质为蒸馏水。
1.2.6 乙醇对脂质体吸光度的影响
取等量且适量稀释后的CLs和SSL,分别加入一定量的无水乙醇,混合均匀,使溶液中乙醇含量分别为5%、10%、15%、20%、25%、30%,室温放置 1 h 后于400 nm处测定吸光度[12]。
1.2.7 钙黄绿素脂质体的制备及包封率的测定
1.2.7.1 钙黄绿素脂质体的制备
钙黄绿素溶液的配制参照文献[13]。将CLs和SSL用50 mmol/L的钙黄绿素溶液(PBS,pH 7.4)水化,包封钙黄绿素,分别制得钙黄绿素脂质体1和钙黄绿素脂质体2,计算包封率。
1.2.7.2 包封率的测定
配制质量浓度依次为1.0、1.25、2.5、5.0、7.5、10.0 mg/L的钙黄绿素溶液,在484 nm处分别测定其吸光度,以吸光度(Y)对质量浓度(X)作线性回归,得回归方程为Y=0.094 4X+0.036 4,R2=0.999 4。
移取钙黄绿素脂质体0.1 mL过葡聚糖凝胶G-50 柱分离(以PBS缓冲液为洗脱剂),收集脂质体洗脱液,加入10% Triton X-100破坏脂质体并定容,在484 nm处测定吸光度,代入标准曲线方程计算脂质体悬液包封的钙黄绿素质量浓度(C1)。另取钙黄绿素脂质体0.1 mL直接加入10% Triton X-100 破坏并定容后测定脂质体中钙黄绿素的总质量浓度(C0)。包封率=C1/C0×100%。
2 结果与讨论
2.1 SPE-MPEG2000结构分析

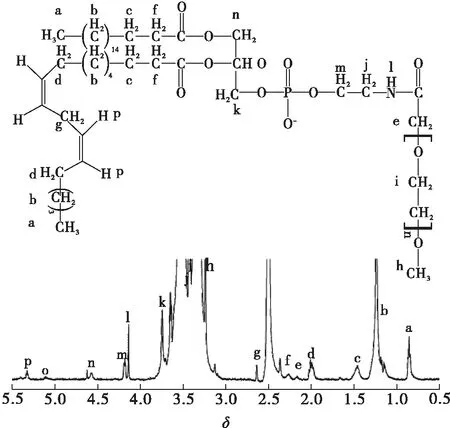
图1 SPE-MPEG2000的1H NMR谱图
图2为原料及产物的红外谱图。由图2可知,c中1 616 cm-1为伯氨基的剪式振动,b中1 649、1 532 cm-1分别为形成的酰胺键的羰基峰及仲酰胺的氨基峰,a和b中1 100 cm-1处为聚乙二醇C—O—C结构的伸缩振动峰,由b中出现C—O—C结构和脑磷脂上的羰基峰,同时1 616 cm-1处吸收峰的消失,可以判断产物的生成。

注:a.CMPEG2000;b.SPE-MPEG2000;c.大豆磷脂。
图2原料及产物的红外谱图
2.2 脂质体的形态(见图3)

注:a、b为初始制备的CLs;c、d为初始制备的SSL;e为4℃放置30 d后的CLs;f为4℃放置30 d后的SSL。
图3CLs及SSL的透射电镜图
由图3可知,制备所得CLs、SSL粒子都呈类球形且为空心结构。通过对比可知SSL颗粒较为完整,粒径较均匀,分散性好,粒径小于200 nm,脂质体膜相对略厚一些。4℃放置30 d后,观察发现CLs出现结晶,而SSL中无结晶,这可能是由于CLs在放置过程中发生了泄漏。
2.3 脂质体粒径分布及Zeta电位
所得初始CLs和SSL均为乳白色均一、无沉淀的悬液,两种脂质体粒径分布较为集中且呈单峰正态分布。初始及4℃放置30 d后脂质体的粒径及Zeta电位见表1。由表1可知,CLs的平均粒径为(196.4±2.1)nm,多分散系数为0.216±0.003;SSL的平均粒径为(178.3±1.8)nm,多分散系数为0.199±0.002,颗粒大小基本上与透射电镜图吻合。含SPE-MPEG2000的SSL粒径略小,这是由于SPE-MPEG2000具有较强的乳化能力,在同样的工艺条件下,磷脂等物质更容易分散在水中形成脂质体,使粒径减小,这有利于增强脂质体的稳定性。
Zeta电位测定结果表明,两种脂质体表面均呈荷电状态,且SSL的Zeta电位绝对值低于CLs。因SPE-MPEG2000是一种非离子型亲水性表面活性剂,当脂质体中加入SPE-MPEG2000后,SPE-MPEG2000可物理吸附于脂质双层表面,其聚氧乙烯基从脂质双层中伸出,覆盖在双层表面,形成具有一定厚度的立体位阻层[14-15],但是过多的加入会造成脂质体的泄漏,使脂质体变得不稳定[16],因此SSL的Zeta电位测定值受SPE-MPEG2000的添加量所影响[17]。
4℃放置30 d后,两种脂质体的粒径均增大,CLs的平均粒径为(269.4±1.9)nm,比初始的CLs增大了37.17%,SSL的平均粒径为(197.7±2.0)nm,比初始的SSL增大了10.88%,可知CLs粒径增大幅度较SSL大得多。此外,CLs溶液中有少量白色絮状沉淀物出现,与电镜观察结果相一致。实验结果表明含SPE-MPEG2000的SSL稳定性要优于CLs。

表1 初始及4℃放置30 d后脂质体的粒径分布及Zeta电位
2.4 乙醇对脂质体吸光度的影响(见图4)

图4 乙醇含量对两种脂质体吸光度的影响
由图4可知,在加入一定比例的乙醇后,SSL的吸光度随乙醇含量的增大基本保持不变,当所加乙醇含量超过25%时,SSL的吸光度开始明显减小;CLs的吸光度随乙醇含量的增大呈现出不规律的波动变化。这可能是由于MPEG2000具有水溶性和高柔顺性,可在脂质体表面形成一层水化膜[18],起到保护SSL脂质体膜的作用,故其表现为抗乙醇溶蚀能力较强;而CLs表面无此水化膜,因此乙醇的加入对其吸光度影响较大,因此脂质体SSL的稳定性要优于CLs。
2.5 脂质体对钙黄绿素的包封效果
按照1.2.7制备2种钙黄绿素脂质体,经计算钙黄绿素脂质体1的平均包封率为4.78%(n=3),钙黄绿素脂质体2的平均包封率为8.23%(n=3),钙黄绿素脂质体2的包封率高于钙黄绿素脂质体1(P<0.05),说明含SPE-MPEG2000 SSL的稳定性高于CLs。
3 结 论
(1)以大豆磷脂和MPEG2000为原料制备改性大豆磷脂,方法简易、条件温和,且在一定程度上解决了磷脂酰乙醇胺-聚乙二醇生产成本高的问题,具有较好的应用前景。
(2)脂质体粒径大小和分布均匀程度与其包封率和稳定性有关,直接影响脂质体在机体组织的行为和处置。通过实验可知,适量改性大豆磷脂的加入可以改善普通脂质体的粒径分布,提高颗粒的完整度及包封率,增强其放置稳定性及膜稳定性,因此改性大豆磷脂对脂质体有良好的稳定作用,符合脂质体空间稳定膜材料的要求。故以大豆磷脂为原料合成磷脂酰乙醇胺-聚乙二醇能够拓宽脂质体的研究范围且具有一定的意义。
[1] 马超, 匡安仁. 长循环脂质体的研究进展及其在核医学中的应用[J]. 生物医学工程杂志, 2007, 24(4): 941-945.
[2] 张景勍,张志荣,陈开杰,等. 长循环脂质体的研究进展[J]. 药学进展, 2003, 27(3): 139-142.
[3] 陈龙, 卫延安. 大豆磷脂酰乙醇胺-聚乙二醇单甲醚2000的制备及其性能研究[J]. 中国粮油学报, 2015, 30(5): 111-115.
[4] 牛国琴, 潘弘, 张静,等. 甲氧基聚乙二醇-磷脂酰乙醇胺的制备及其对脂质体的稳定作用[J]. 中国医药工业杂志, 2003, 34(10): 501-503.
[5] 于福宽, 孙君明, 韩粉霞,等. 大豆籽粒中脂肪酸组分快速检测方法的比较分析[J]. 大豆科学, 2011, 30(4): 626-631.
[6] PANTHEE D R, PANTALONE V R, SAXTON A M. Modifier QTL for fatty acid composition in soybean oil [J]. Euphytica, 2006, 152(1): 67-73.
[7] SPENCER M M, LANDAU-ELLIS D, MEYER E J, et al. Molecular markers associated with linolenic acid content in soybean [J]. J Am Oil Chem Soc, 2004, 81(6): 559-562.
[8] TORCHILIN V P, LEVCHENKO T S, LUKYANOV A N, et al.p-Nitrophenylcarbonyl-PEG-PE-liposomes: fast and simple of specific ligands, including monoclonal antibodies, to distal ends of PEG chains viap-nitrophenylcarbonyl groups [J]. Biochim Biophys Acta, 2001,1511: 397-411.
[9] LUNDBERG B B, MORTIMER B C, REDGRAVE T G. Submicron lipid emulsions containing amphipathic polyethylene glycol for use as drug-carriers with prolonged circulation time[J]. Int J Pharm, 1996,134: 119-127.
[10] 陈静. 磷脂酰聚乙二醇单甲醚的合成及其自组装纳米胶束的研究[D]. 北京:中国协和医科大学(北京协和医学院), 2008.
[11] SHIMANOUCHI T, ISHII H, YOSHIMOTO N, et al. Calcein permeation acrossphosphatidylcholine bilayer membrane: effects of membrane fluidity, liposome size, and immobilization [J]. Colloids Surf B Biointerf, 2009,73(1): 156-160.
[12] EI-SAMALIGY M S, AFIFI N N, MAHMOUD E A, et al.Evaluation of hybrid liposomes-encapsulated silymarin regarding physical stability and in vivo performance [J]. Int J Pharm, 2006, 319(1): 121-129.
[13] MAHERANI B, ARABTEHRANY E, KHEIROLOMOOM A, et al. Calcein release behavior from liposomal bilayer; influence of physicochemical/mechanical/structural properties of lipids [J]. Biochimie, 2013,95(11): 2018-2033.
[14] TASI L M, LIU D Z, CHEN W Y. Microcalorimetric inv-estigation of the interaction of polysorbate surfactants with unilamellar phosphatidylcholines liposomes[J]. Colloids Surf A, 2003, 213(1): 7-14.
[15] 周伟, 刘玮琳, 刘伟, 等. 不同因素对中链脂肪酸脂质体Zeta电位的影响[J]. 食品科学, 2012, 33(19): 128-132.
[16] 杨水兵, 刘成梅, 刘伟, 等. VC脂质体的制备与稳定性测定[J]. 食品科学, 2010, 31(20): 230-234.
[17] CUPRI S, MUSUMECI T, GRAZIANO A C E, et al. Evaluation of amphiphilic PEG derivatives as surface modifiers for the production of stealth liposomes [J]. Colloid Polym Sci, 2015, 293(4): 1083-1092.
[18] MOGHIMI S M, SZEBENI J. Stealth liposomes and long circulating nanoparticles: critical issues in pharmacokinetics, opsonization and protein-binding properties [J].Prog Lipid Res, 2003, 42(6): 463-478.
