饲料和饲料原料中致泻性大肠杆菌的检测
2018-01-19李金磊狄元冉方忠意张发旺周红霞吴志明高延玲
李金磊,董 鹏,狄元冉,方忠意,张发旺,周红霞,吴志明,高延玲
(河南省兽药饲料监察所,河南郑州 450008)
腹泻病是导致发展中国家儿童发病和死亡的主要病因之一[1-2]。研究表明,致泻性大肠杆菌(DiarrheagenicEscherichiacoli,DEC)是导致腹泻的重要原因[3]。大肠杆菌是寄生于人体肠道和其他温血动物体内的一种无害共生菌[4]。与人类疾病有关的大肠杆菌统称为致泻性大肠杆菌,根据临床特征、流行病学和毒性特征可将致泻性大肠杆菌分为6类:产肠毒素大肠杆菌(EnterotoxigenicE.coli,ETEC)、典型和非典型肠致病性大肠杆菌(Typical and atypical enteropathogenicE.coli,tEPEC、aEPEC)、肠侵袭性大肠杆菌(EnteroinvasiveE.coli,EIEC)、肠聚集性大肠杆菌(EnteroaggregativeE.coli,EAEC)、肠黏附性大肠杆菌(Diffusely adherentE.coli,DAEC)和产志贺毒素的大肠杆菌(Shiga-toxin-producingE.coli,STEC)[5-6]。致泻性大肠杆菌除了能引起急性发病和死亡外,还能导致严重的后遗症,如出血性结肠炎(Hemorrhagic colitis,HC)和溶血性尿毒综合征(Hemolytic uremic syndrome,HUS)以及营养不良等[3,7]。
近年来,致泻性大肠杆菌的感染越来越严重,对社会公共安全构成了极大威胁。2010年哥伦比亚的加勒比腹泻儿童中,致泻性大肠杆菌的检出率为14.4%[8],印度在5岁以下腹泻儿童中的检出率高达52.0%[9],而加纳在儿童和成人腹泻病例中的检出率分别为77.0%和38.0%[10]。2011年,德国致泻性大肠杆菌疫情导致3 500多人感染,45人死亡[11]。2013年,我国对1 658份粪便拭子中致泻性大肠杆菌进行检则,总阳性率为8.93%[12]。
饲料及饲料原料作为畜牧业的初级投入品,其受到致病菌污染尤其是致泻性大肠杆菌污染将直接影响畜产品质量,危害人类健康。笔者对2015—2016年饲料及饲料原料中致泻性大肠杆菌的检出情况进行分析,以期引导饲料生产企业加强管理,提高产品质量。
1 材料与方法
1.1材料与试剂
1.1.1菌株。EIEC CVCC1372、EPEC CVCC1396、ETEC CVCC195,均购自中国兽医药品监察所;菌株EHEC CICC21530购自中国工业微生物菌种保藏中心。
1.1.2样品。共抽取河南、辽宁、北京、浙江、广东、黑龙江、内蒙古、江西浓缩饲料、配合饲料、动物原料、微生态制剂、酶制剂463批,具体抽样情况见表1。
1.1.3试剂。营养肉汤、肠道增菌肉汤均购自北京路桥技术股份有限公司;5种致泻性大肠埃希氏菌多重PCR检测试剂购自北京卓诚惠生生物科技有限公司;Marker DL2000购自北京康为世纪生物科技有限公司;西班牙琼脂糖购自宝生物工程(大连)有限公司。
1.2仪器与设备低温可叠放摇床MaxQ SHKE 600-8CE型(美国Thermo scientific公司);梯度PCR仪LabCycle Standard Plus型(德国SENSO公司);凝胶电泳成像系统GeiDov XR(美国Bio-Red);拍击式均质器400m型(美国Interscience公司);台式高速冷冻离心机3-18K(德国Sigma公司);电子天平PL2002型[梅特勒-托利多仪器(上海)有限公司];高压灭菌锅HVE-50型(日本HIRAYAMA公司)。
1.3方法
1.3.1样品采集。用一次性手套无菌采集饲料及饲料原料约300 g,装于无菌自封袋内,4 ℃下保存,24 h内送回实验室检测。
1.3.2增菌。无菌称取待检样品25 g,置于无菌均质袋中,加入225 mL营养肉汤,由均质器拍打1~2 min,(36±1)℃下培养6 h。挑取1环,接种于30 mL肠道增菌肉汤内,42 ℃下培养18 h。同时,设置阳性对照和阴性对照。
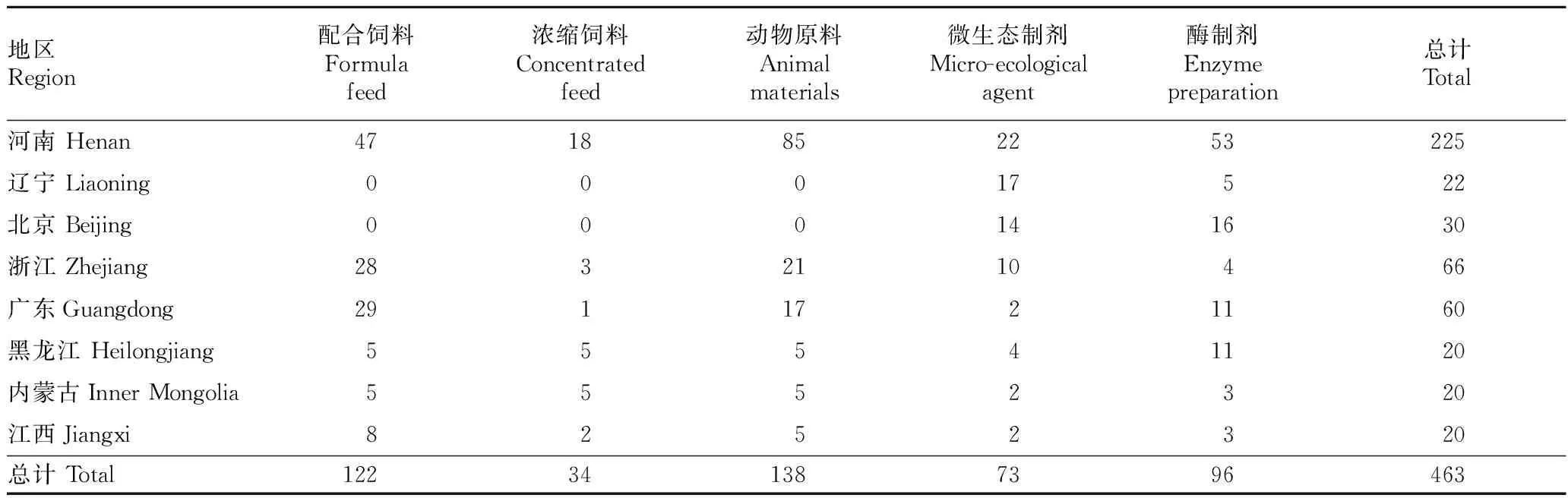
表1 2015—2016年饲料和饲料原料抽样数量统计
1.3.3菌液DNA的提取。采用煮沸裂解法提取样品DNA。取1 mL上述增菌液,12 000 r/min离心2 min,弃上清。加入1 mL灭菌去离子水重悬,12 000 r/min离心2 min,弃上清。加入100 μL灭菌去离子水重悬,于沸水中煮10 min后取出,12 000 r/min离心2 min。取上清作为PCR扩增模板。阳性对照和阴性对照均按照相同方法提取DNA。
1.3.4PCR扩增。采用致泻性大肠埃希氏菌多重PCR检测试剂盒进行PCR检测。PCR反应体系如下:2×PCR Buffer 12.5 μL、10×Multiplex Assay(A211L)2.5 μL、25×PCR Enzyme 1.0 μL、Nuclease-free Water 7.0 μL、模板核酸样品2.0 μL,总计25.0 μL。PCR反应程序如下:95 ℃ 4 min;95 ℃ 30 s,62 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 5 min。
1.3.5琼脂糖凝胶电泳检测。配制1.2%的琼脂糖凝胶,且胶的长度不小于10 cm;电压设置为10 V/cm;电泳时间为20~30 min。
1.3.6结果判定。若阳性对照有与设计长度一致的DNA电泳条带,且阴性对照无条带或无特定长度的DNA条带,则试验成立,否则试验不成立;若样品有与阳性对照一致的DNA电泳条带,则判定为检出致泻性大肠杆菌。
2 结果与分析
2.1总体检出情况2015—2016年共检测饲料及饲料原料463批,检出致泻性大肠杆菌阳性样品12批,阳性率2.6%。其中,EPEC阳性样品7批,阳性率1.5%;ETEC阳性样品3批,阳性率0.65%;EHEC阳性样品2批,阳性率0.43%;未检出EIEC阳性样品。部分阳性样品琼脂糖凝胶电泳图谱见图1。

注:M为Marker DL2000;P为4种致泻性大肠杆菌阳性对照;S1、S2、S3为阳性样品Note: M.Marker DL2000;P.positive control of 4 kinds of DEC; S1,S2,S3 were positive samples图1 部分样品4种致泻性大肠杆菌多重PCR检测电泳图谱Fig.1 The electrophoretogram for mutiple PCR results of 4 kinds of DEC in some samples
2.2各地区的检出情况由表2可知,河南共检测样品225批,阳性样品7批,阳性率3.1%;广东共检测样品60批,阳性样品2批,阳性率3.3%;北京共检测样品30批,阳性样品1批,阳性率3.3%;辽宁共检测样品22批,阳性样品2批,阳性率9.1%;浙江、黑龙江、内蒙古、江西未检出致泻性大肠杆菌阳性样品。
2.3各类样品的检出情况由表3可知,共检测96批酶制剂,其中阳性样品8批,阳性率8.3%;动物原料138批,阳性样品2批,阳性率1.4%;浓缩饲料34批,阳性样品1批,阳性率2.9%;微生态制剂73批,阳性样品1批,阳性率1.4%;配合饲料中未检出阳性样品。
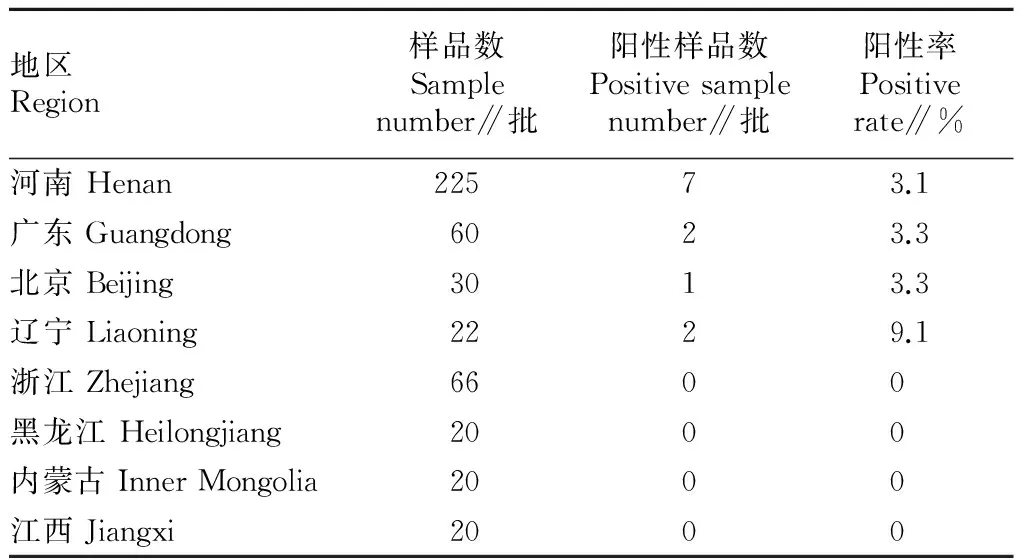
表2 各地区致泻性大肠杆菌检出情况
3 结论与讨论
近年来,致泻性大肠杆菌感染给公共卫生带来很大的威胁[5,13]。据估计,全球范围内每年有超过10亿腹泻病例,导致约200万人死亡,且腹泻是导致低收入国家和中等收入国家青少年儿童疾病和死亡的重要病因,而致泻性大肠杆菌是导致腹泻的重要原因[14]。研究发现,致泻性大肠杆菌在肠道致病菌中居于第3位,检出率达5.2%,其中以EPEC为主[3]。致泻性大肠杆菌很难像沙门氏菌或志贺氏菌一样通过常规生化试验加以区分,血清分型也不能很可靠地区分致泻性大肠杆菌,因此对致泻性大肠杆菌的检测需要非常专业的试验技术[15]。

表3 各类样品中致泻性大肠杆菌的检测结果
笔者于2015—2016年对饲料及饲料原料中致泻性大肠杆菌进行检测,从463批样品中共检出致泻性大肠杆菌12批,检出率为2.6%。其中,EPEC阳性样品7批、ETEC阳性样品3批,EHEC阳性样品2批,阳性率分别为1.50%、0.65%和0.43%;从96批酶制剂中检出阳性样品8批,阳性率8.3%;从34批浓缩饲料中检出阳性样品1批,阳性率2.9%;从138批动物原料中检出阳性样品2批,阳性率1.4%;从73批微生态制剂中检出阳性样品1批,阳性率1.4%。这说明饲料及饲料原料中致泻性大肠杆菌污染比较严重,尤其是浓缩饲料和酶制剂。今后,饲料生产企业应加强对饲料及饲料原料的生产管理,从源头做起,严把质量关,努力提高自检自控能力,尤其是对浓缩饲料、酶制剂和动物原料的监测和控制。
应用多重PCR检测技术,能够快速、准确、高通量地检测饲料及饲料原料中致泻性大肠杆菌,对防止食源性疾病的危害,开展主动监测和危险性评估进而解除致泻性大肠杆菌对人类的危害具有重要的意义。
[1] LIU L,JOHNSON H L,COUSENS S,et al.Child health epidemiology reference group of WHO and UNICEF:Global,regional,and national causes of child mortality:An updated systematic analysis for 2010 with time trends since 2000[J].Lancet,2012,379:2151-2161.
[2] KOTLOFF K L,NATARO J P,BLACKWELDER W C,et al.Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the global enteric multicenter study,GEMS):A prospective,case-control study[J].Lancet,2013,382(9888):209-222.
[3] ASSIS F E A,WOLF S,SUREK M,et al.Impact ofAeromonasand diarrheagenicEscherichiacoliscreening in patients with diarrhea in Paraná,southern Brazil[J].J Infect Dev Ctries,2014,8(12):1609-1614.
[4] DUTTA S,PAZHANI G P,NATARO J P,et al.Heterogenic virulence in a diarrheagenicEscherichiacoli:Evidence for an EPEC expressing heat-labile toxin of ETEC[J].International journal of medical microbiology,2014,305(1):47-54.
[5] CROXEN M A,LAW R J,SCHOLZ R,et al.Recent advances in understanding enteric pathogenicEscherichiacoli[J].Clin Microbiol Rev,2013,26(4):822-880.
[6] NATARO J P,KAPER J B.DiarrheagenicEscherichiacoli[J].Clin Microbiol Rev,1998,11(1):142-201.
[7] CAINE L A,NWODO U U,OKOH A I,et al.Occurrence of virulence genes associated with diarrheagenicEscherichiacoliisolated from raw cow′s milk from two commercial dairy farms in the eastern cape province,South Africa[J].Int J Environ Res Public Health,2014,11:11950-11963.
[9] RAJENDRAN P,AJJAMPUR S S R,CHIDAMBARAM D,et al.Pathotypes of diarrheagenicEscherichiacoliin children attending a tertiary care hospital in South India[J].Diagn Microbiol Infect Dis,2010,68(2):117-122.
[10] OPINTAN J A,BISHAR R A,NEWMAN M J,et al.Carriage of diarrhoeagenicEscherichiacoliby older children and adults in Accra,Ghana[J].Transactions of the royal society of tropical medicine and hygiene,2010,104:504-506.
[11] FRANK C,WERBER D,CRAMER J P,et al.Epidemic profile of Shiga-toxin-producingEscherichiacoliO104:H4 outbreak in Germany[J].N Engl J Med,2011,365(19):1771-1780.
[12] 朱林英,赵冰,黄红,等.分子诊断技术结合传统分离方法在致泻性大肠杆菌检测中的运用[J].中国卫生检验杂志,2015,25(4):467-470.
[13] ESTRADA-GARCIA T,NAVARRO-GARCIA F.EnteroaggregativeEscherichiacolipathotype:A genetically heterogeneous emerging foodborne enteropathogen[J].FEMS Immunol Med Microbiol,2012,66(3):281-298.
[14] PATZI-VARGAS S,ZAIDI M B,PEREZ-MARTINEZ I,et al.DiarrheagenicEscherichiacolicarrying supplementary virulence genes are an important cause of moderate to severe diarrhoeal disease in mexico[J].PLoS Negl Trop Dis,2015,9(3):1-18.
[15] JANDA J M,ABBOTT S L.Revisiting bacterial gastroenteritis,Part I:Issues,possible approaches,and an ever-expanding list of etiologic agents[J].Clin Microbiol Newsletter,2010,33(10):71-76.
科技论文写作规范——标点符号
标点符号按照GB/T 15834—2011执行,每个标点占1格(破折号占2格)。外文中的标点符号按照外文的规范和习惯。注意破折号“——”、一字线“—”(浪纹线“~”)和短横线“-”的不同用法。破折号又称两字线或双连划,占2个字身位置;一字线占1个字身位置,短横线又称半字线或对开划,占半个字身位置。破折号可作文中的补充性说明(如注释、插入语等),或用于公式或图表的说明文字中。一字线“—”(浪纹线“~”)用于表示标示相关项目(如时间、地域等)的起止。例如1949—1986年,北京—上海特别旅客快车。参考文献范围号用“-”。短横线用于连接词组,或用于连接化合物名称与其前面的符号或位序,或用于公式、表格、插图、插题、型号、样本等的编号。外文中的破折号(Dash)的字身与m宽,俗称m Dash,其用法与中文中的破折号相当。外文的连接符俗称哈芬(hyphen)。其中,对开哈芬的字身为m字身的一半,相当于中文中范围号的用法;三开哈芬的字身为m字母的1/3,相当于中文中的短横线的用法。
