土壤有效硒测定方法的研究
2018-01-18陈娥陈永波李卫东黄光昱胡百顺刘淑琴秦邦陈烨熊倩
陈娥 陈永波 李卫东 黄光昱 胡百顺 刘淑琴 秦邦 陈烨 熊倩

摘要:采用原子荧光形态分析法和原子荧光光谱法,检测了恩施市不同地点土壤的有效硒,并对浸提液浓度、液样比、振荡时间、超声时间、土壤细度、浸提液pH等条件进行了优化,建立了土壤有效硒的提取方法。提取方法为:称取土壤样品1.0 g于离心管中,准确加入10 mL 0.25 mol/L KH2PO4溶液,于30 ℃、1 500 r/min条件下振荡60 min,3 000 r/min离心15 min,取上清液5 mL消化后上机测定,样品加标回收率在90.17%~98.00%。该研究为土壤有效硒测定方法标准的制定奠定了基础。
关键词:原子荧光形态分析法;原子荧光光谱法;土壤有效硒;提取方法
中图分类号:X833 文献标识码:A
文章编号:0439-8114(2018)21-0022-05
DOI:10.14088/j.cnki.issn0439-8114.2018.21.005 开放科学(资源服务)标识码(OSID):
Study on the Method for Determination of Available Selenium in Soil
CHEN E,CHEN Yong-bo,LI Wei-dong,HUANG Guang-yu,HU Bai-shun,
LIU Shu-qin,QIN Bang,CHEN Ye,XIONG Qian
(Enshi Selenium Application Technology and Product Development Research Institute,Enshi 445000,Hubei,China)
Abstract: The atomic fluorescence speciation analysis and atomic fluorescence spectrometry were carried out to detect the available selenium in soil at different locations in Enshi City. Extraction conditions such as concentration of leachate,ratio of liquid to sample,shaking time,ultrasonic time,soil fineness,pH of leachate and other conditions were optimized to establish an effective extraction method of available selenium in soil. The extraction method is as follows,after 1.0 g soil sample is weighed into a centrifuge tube,accurately add 10 mL of 0.25 mol/L KH2PO4 solution,shaken at 30 ℃,1 500 r/min for 60 min,centrifuged at 3 000 r/min for 15 min. and take 5 mL supernatant for digestion. After digestion,the recovery of the sample was 90.17%~98.00%. It laid the foundation for the development of standards for soil available selenium determination methods.
Key words: atomic fluorescence speciation analysis; atomic fluorescence spectrometry; available selenium in soil; extraction method
硒是人畜必需的微量元素之一,在環境中分布分散且不均匀,但对人类的身体健康具有重要意义。植物是人类补硒的主要来源,植物对硒的吸收与土壤中硒的形态有直接关系[1]。有研究表明,富硒的土壤并不一定能生产出富硒的农作物,因为硒在土壤中以多种形态存在,作物能吸收的是有效态的硒,而总硒含量高的土壤有效硒含量不一定高[2-4]。由于不同形态硒化学和生物学特征不同,因此研究土壤中硒的形态分布对阐明硒的生物可利用性甚至整个生态环境具有重要的理论和实践意义。由于土壤本身的复杂性,硒在土壤中存在形态也呈现相应的复杂性[5]。土壤总硒并非都可以被植物吸收利用,根据瞿建国等[6-8]、朱英等[9]的研究,土壤硒分为水溶态、可交换态、有机结合态、元素态、碳酸盐结合态、碳化物/硒化物结合态和残渣态等形态,其中水溶态和可交换态硒可被植物吸收利用,称为生物有效态硒[10,11]。一般用生物有效态硒来反映土壤供硒能力更准确[12]。
目前,关于土壤有效硒的研究还没有统一的测定方法。一般采用KCl溶液[13]、KH2PO4溶液[14,15]、KH2PO4+K2HPO4缓冲液等提取土壤中的有效硒[16]。郭宇等[17]采用顺序提取法测定了富硒岩石中的硒形态,用去离子水提取水溶性硒,用0.1 mol/L KH2PO4+K2HPO4(pH=7)缓冲液提取可交换态硒。李辉勇等[18]用0.1 mol/L的KH2PO4适合作酸性水稻土的浸提液。温国灿等[19]用0.5 mol/L的NaH2PO4适合作酸性土壤的浸提液,但对不同类型的土壤浸提没有形成共识[20]。基于此,本研究采用HPLC-AFS形态分析法较为系统地研究了不同浸提液提取恩施市莲花池碎米荠土壤中SeO42-和SeO32-等有效硒的效果,并结合土壤有效硒含量较低且含有有机硒小分子的实际情况,选用0.25 mol/L的KH2PO4作为浸提液,然后再用氢化物-原子荧光光谱法测定浸提液的总硒作为土壤有效硒的测定方法,该方法灵敏度高、操作简便、省时,便于推广应用,对科学评价、开发、利用土壤硒资源具有重要意义。
1 材料与方法
1.1 试验材料
2016年3月,课题组从恩施市双河杨家堡菜园土、三岔沙子坝水稻土、莲花池碎米荠土、红庙西河坝水稻土采集的4个土壤样品,采用NY/T 1104-2006标准方法测定总硒含量,结果见表1。
1.2 试验方法
1.2.1 土壤中硒的测定方法 土壤中有效硒形态采用高效液相-原子荧光形态联用仪分析测定[21],HPLC为美国Waters 2695分离单元,SAP10+AFS-930由北京吉天有限仪器公司生产。仪器参考条件见表2。
1.2.2 土壤有效硒浸提方法的研究
1)浸提液的筛选。称取土壤样品1602号(pH 5.34,酸性)、1607号(pH 7.82,弱碱性)、1608号(pH 7.51,弱碱性)、1612号(pH 6.61,弱酸性)各1.0 g于10 mL离心管中,每个土样重复5份,分别准确加入10 mL去离子水、10 mL 0.25 mol/L的KCl溶液、10 mL 1.0 mol/L的HCl溶液、10 mL 0.1 mol/L KH2PO4溶液和10 mL 0.1 mol/L KH2PO4+K2HPO4缓冲液,于30 ℃、1 500 r/min条件下振荡60 min,3 000 r/min离心15 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定SeO32-和SeO42-的含量。
2)KH2PO4溶液浓度对土壤硒加标回收率的影响。做样品回收率试验选用本底值含量较低的土样1602号。称取1602号土样10份,每份1.0 g于10 mL离心管中,分成2组。一组作为对照,一组加入 1 μg/mL的Se(IV)、Se(VI)混合标准溶液0.1 mL, 然后准确加入0.10、0.25、0.50、0.75、1.00 mol/L的KH2PO4溶液10 mL,于30 ℃、1 500 r/min条件下振荡60 min,3 000 r/min离心15 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定SeO32-和SeO42-的含量,计算回收率。
3)液样比对SeO32-和SeO42-提取量的影响。称取1608号土样0.10~2.00 g于15 mL离心管中,准确加入0.25 mol/L KH2PO4溶液10 mL,于30 ℃、1 500 r/min振荡60 min,3 000 r/min离心15 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定SeO32-和SeO42-含量。
4)试液隔夜测定。将浸提液在4 ℃放置过夜,第二天取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定SeO32-和SeO42-含量。
5)振荡时间对SeO32-和SeO42-提取量的影响。称取1608号1.0 g,准确加入0.25 mol/L KH2PO4溶液15 mL,于30℃、1 500 r/min振蕩30、60、90、120 min,3 000 r/min离心15 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定SeO32-和SeO42-含量。
6)超声对SeO32-和SeO42-提取量的影响。称取1608号样品1.0 g,准确加入0.25 mol/L KH2PO4溶液15 mL,分别超声提取10、20、40、60 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定有效硒含量。
7)振荡+超声对SeO32-和SeO42-提取量的影响。称取1608号土样1.0 g于15 mL离心管中,准确加入0.25 mol/L KH2PO4溶液10 mL,于30 ℃、1 500 r/min振荡60 min,超声10 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定有效硒含量。
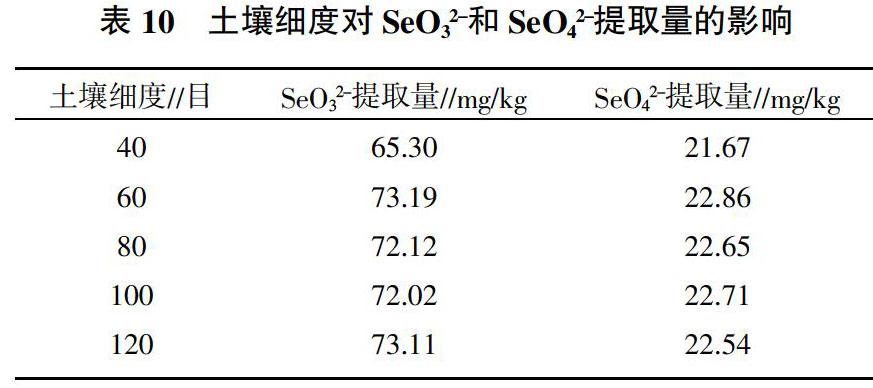
8)土壤细度对SeO32-和SeO42-提取量的影响。称取不同细度的1608号土壤样品1.0 g,准确加入0.25 mol/L KH2PO4溶液10 mL,于30 ℃、1 500 r/min振荡60 min,3 000 r/min离心15 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定有效硒含量。
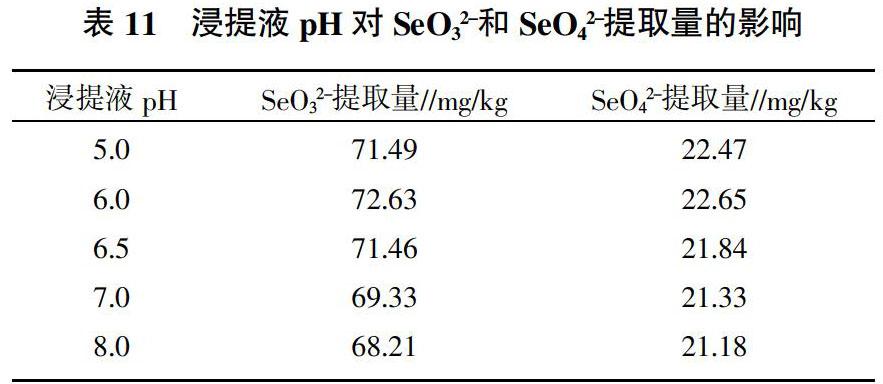
9)浸提液酸碱度对SeO32-和SeO42-提取率的影响。称取1608号样品1.0 g,准确加入未调pH及调节pH为5.0、6.0、7.0、8.0的0.1 mol/L KH2PO4溶液10 mL,于30℃、1 500 rpm振荡提取60 min,3 000 r/min离心15 min,取上清液过0.45 μm滤膜,滤液供HPLC-AFS分析,测定有效硒含量。
10)测定方法加标回收。分别称取土壤1602、1607、1612试样1.0 g(精确到0.001 g)各12份,分为4组,每组3次重复。加标浓度分别为0.1、0.2、0.4 mg/kg,准确加入10 mL 0.25 mol/L磷酸二氢钾溶液;根据前面确定的最佳提取条件处理后,取上清液5 mL于微波消解罐中,加入HNO3 7 mL、H2O2 1 mL进行消解;样品消解完毕后,在电热板上160 ℃左右加热至近干,切记不可蒸干,冷却后加入5 mL 6 mol/L盐酸,继续加热至溶液变为清亮无色并伴有白烟出现,冷却,转移至10 mL容量瓶中,消解罐用5%盐酸溶液洗涤2~3次,溶液一并转入容量瓶中,用5%盐酸溶液定容,用原子荧光光谱仪测定,计算样品加标回收率。
2 结果与分析
2.1 浸提液的筛选
不同浸提液对SeO32-和SeO42-的提取效果见表3。从表3可以看出,去离子水、0.25 mol/L KCL溶液、1.0 mol/L HCl溶液均未浸提出土样1602、1607、1612中SeO32-和SeO42-,只能浸提出土样1608中水溶性的硒,且提取量分别为40.80、41.44、1.56 mg/kg;0.1 mol/L KH2PO4溶液能够提出4个土样中水溶性的硒,且对土样1608中水溶性的硒提取量为81.94 mg/kg;0.1 mol/L KH2PO4+K2HPO4溶液只能提出土样1602、1607、1612中的SeO32、SeO42-未检出,对土样1608中水溶性的硒提取量为82.89 mg/kg,与0.1 mol/L KH2PO4溶液对土样1608中水溶性的硒提取量差异不显著。因此选择0.1 mol/L的KH2PO4溶液做浸提液。由于在所选4个土壤样品中1608号土样的有效硒含量最高,所以有效硒提取条件的探索选用1608号土样。
2.2 KH2PO4溶液浓度对土壤硒加标回收率的影响
不同浓度的KH2PO4溶液对土壤硒加标回收率的影响见表4。由表4可以看出,随着KH2PO4溶液浓度的提高,本底值浓度也逐渐增高;SeO32-回收率先增加后降低。当KH2PO4溶液浓度为0.25 mol/L时,SeO32-回收率最高为69.0%;SeO42-回收率均在80.0%以上,但配置1.0 mol/L KH2PO4溶液时已难以完全溶解,考虑到实际土壤中盐不可能达到这么高的浓度,最后选择浓度为0.25 mol/L KH2PO4溶液作为土壤有效硒的浸提液。
2.3 液样比对SeO32-和SeO42-提取量的影响
用0.25 mol/L KH2PO4溶液作为土壤有效硒的浸提液,取1608土样0.10~2.00 g进行SeO32-和SeO42-提取,结果见表5。从表5可以看出,液样比大约在10~100,SeO32-提取量稳定,液样比大于40时,SeO42-提取量降低;小于10,SeO32-提取量下降。综合考虑,液样比宜在10~40,称样量宜在0.25~1.00 g,含硒量较高的土壤可称取0.25 g,一般样品称取0.50~1.00 g,称样量太大,提取率反而下降。
2.4 试液隔夜测定结果
将2.3中的试液在冰箱放置过夜后,测定结果见表6,与表5相比,SeO32-含量升高,SeO42-含量明显下降,可能是SeO42-被还原成SeO32-所致,因此,制备的样品宜当天测定。
2.5 振荡时间对SeO32-和SeO42-提取量的影响
称取1608号土样1.0 g,加入0.25 mol/L KH2PO4溶液,检测振荡时间对SeO32-和SeO42-提取量的影响,结果见表7。从表7可知,振荡30 min时间太短,提取率极低;60~90 min,提取率升高;90~120 min,提取率趋于稳定,因此在未知土壤有效硒含量的情况下,振荡时间以60~90 min为宜。
2.6 超声时间对SeO32-和SeO42-提取量的影响
在不同超声时间下对1608号土样进行有效硒含量测定,结果见表8。从表8可以看出,超声20 min提取量最高。延长超声时间,效果不明显,但超声提取量较振荡提取60~90 min低。
2.7 振荡+超声对SeO32-和SeO42-提取量的影响
从表9可以看出,振荡时间为30 min时,超声10 min可以明顯提高SeO32-和SeO42-的浸出量;振荡60 min后,超声10 min对提取量影响效果不明显。振荡30 min+超声10 min的提取率较振荡60 min低,因此宜选用振荡60 min+超声10 min的提取方法。
2.8 土壤细度对SeO32-和SeO42-提取量的影响
由表10可知,土壤细度为40目时,SeO32-提取率较低,但不影响SeO42-的提取,大于60目时,SeO32-和SeO42-提取量均趋于稳定,因此土壤细度应为60~100目。
2.9 浸提液pH对SeO32-和SeO42-提取量的影响
由表11可知,浸提液的pH在5.0~6.5时,SeO32-和SeO42-提取量无明显差异,浸提液的pH高于7.0时,有效硒的提取量下降,表明配置的浸提液pH宜调节到6.0左右。
2.10 测定方法的验证
添加浓度在 0.01~0.10 mg/kg,准确度要求允许的相对标准偏差<20%,添加浓度 >0.10 mg/kg时,允许的相对标准偏差<15%。由表12可知,3个土壤样品平均回收率在90.17%~98.00%,相对标准偏差在0.64%~5.63%,说明测定方法是正确的。
3 结论与讨论
土壤硒的有效性是土壤供硒能力、作物吸收能力综合作用的结果,在生物强化上必须将作物-土壤-硒结合考虑[22]。本研究在采用HPLC-AFS法测定具体土壤样品有效硒的过程中,发现存在以下问题。
1)在中国,大多数土壤含硒量低于0.4 mg/kg,属于非富硒土壤,有效硒一般只有10%左右,即0.04 mg/kg以下[20],在有效硒含量很低的情况下,进行形态分析是没有意义的。浸提时,样品稀释了10倍,只有2 μg/L,低于方法检测限,需要富集后才能采用HPLC-AFS法。
2)土壤样品本底复杂,直接上样严重影响色谱柱寿命。在样品前处理时,需要采用固相萃取法对样品进行富硒和净化,C18柱不能吸附SeO42-和SeO32-,阴离子交换柱能吸附SeO42-和SeO32-,但不能吸附有机硒小分子,且价格较贵,只能一次性使用,测试成本高,不便于推广应用。
3)浸提液中SeO42-、SeO32-和有机硒小分子均为生物有效硒,无需分离测定。因此,经过讨论,将方法改为用KH2PO4溶液提取后,浸提液中有机硒采用HNO3+H2O2消化,SeO42-采用HCL还原后测定SeO32-的含量。即土壤有效硒的测定方法为:称取过60目的土壤样品1.0 g(精确到0.001 g)于离心管中,准确加入10 mL 0.25 mol/L KH2PO4浸提液,于30 ℃、1 500 r/min振荡提取60 min,3 000 r/min离心15 min,取上清液5 mL于微波消解罐中,加入HNO3 7 mL、H2O2 1 mL,样品消解完毕后,在赶酸板上赶酸至约2 mL,加入5 mL 6 mol/L盐酸,再赶酸至2 mL以下,转入10 mL容量瓶中,用5%盐酸溶液定容,用原子荧光光谱法测定溶液中硒的含量。
参考文献:
[1] 胡 婷.张家界市富硒植物中硒形态分布及种植规划研究[D].湖南吉首:吉首大学,2015.
[2] 安梦鱼.富硒土壤硒形态转化的主要影响因子及对作物吸收的研究[D].福州:福建农林大学,2017.
[3] 杨兰芳.土壤中的硒[J].湖北民族学院学报(自然科學版),2000, 18(1):43-46.
[4] BUJDOS M,MULOVA A,KUBOVA J,et al. Selenium fractionation and specia-tion in rocks,soils,waters and plants in polluted surface mine environ-ment[J].Environmental Geology,2005,47:353-360.
[5] 王松山.土壤中硒形态和价态及生物有效性研究[D].陕西杨凌:西北农林科技大学,2012.
[6] 瞿建国,徐伯兴,龚书椿.上海不同地区土壤中硒的形态分布及其有效性研究[J].土壤学报,1998,35(3):388-403
[7] 瞿建国,徐伯兴,龚书椿.氢化物发生-无色散原子荧光光度法测定土壤中有效硒和总硒[J].土壤通报,1998,29(1):47.
[8] 瞿建国,徐伯兴,龚书椿.连续浸提技术测定土壤和沉积物中硒的形态[J].环境化学1997,16(3):277-283.
[9] 朱 英,王 锝,熊玉祥.土壤中有效硒的提取和测定方法[J].资源环境与工程,2009,12(6):859-862.
[10] SHARMASARKAR S,VANCE G F.Fractional partitioning for assessing solid-phase speciation and transformations of soil selenium[J]Soil Science,1995,160(1):43-55.
[11] 王松山,梁东丽,魏 威,等.基于路径分析的土壤性质与硒形态的关系[J].土壤学报,2011,48(4):823-830.
[12] 耿建梅,王文斌,罗 丹,等.不同浸提剂对海南稻田土壤有效硒浸提效果比较[J].土壤,2010,42(4):624-629.
[13] 唐玉霞,王慧敏,刘巧玲,等.河北省麦田土壤硒的含量、形态及其有效性研[J].华北农学报,2010,25(增刊):194-197.
[14] 候军宁.硒的土壤化学研究进展[J].土壤学进展,1987(1):10-19.
[15] 赵美芸.影响土壤中硒有效性的若干因子[J].土壤,1991,23(5):236-240.
[16] 吴少尉,池 泉,陈文武,等.土壤中硒的形态连续浸提方法的研究[J].土壤,2004,36(1):92-95.
[17] 郭 宇,鲍征宇,马真真,等.湖北恩施地区土壤—植物系统中Se元素的地球化学特征[J].地质通报,2012,31(10):151-155.
[18] 李辉勇,刘 鹏,刘军鸽,等.酸性水稻土有效硒提取剂的比较研究[J]生态环境,2003,12(1):12-14.
[19] 温国灿,黄 艳,郭永玲,等.酸性土壤有效硒提取条件优化的研究[J].农业环境科学学报,2007(5):1996-2000.
[20] 吴雄平,鲍俊丹,伊 田.石灰性土壤有效硒浸提剂和浸提条件研究[J].农业环境科学学报,2009,28(5):931-936.
[21] 陈永波,刘淑琴,胡百顺,等.碎米荠及富硒产品中无机硒提取方法的建立[J].生物资源,2017,39(3):223-229.
[22] 梁东丽,彭 琴,崔泽伟,等.土壤中硒的形态转化及其对有效性的影响研究进展[J].生物技术进展,2017,7(5):374-380.
