酒石酸化学改性松针粉对Cr(VI)的吸附性能
2018-01-18贾洪祥田晓溪刘婧扬闫立东姜效军
李 真,艾 天,贾洪祥,田晓溪,刘婧扬,闫立东,姜效军
(1.辽宁科技大学 化学工程学院,辽宁 鞍山 114051;2.山东华鲁恒升集团有限公司,山东 德州 253024;3.鞍山出入境检验检疫局,辽宁 鞍山 114002;4.辽宁科技大学 矿业工程学院,辽宁 鞍山 114051)
伴随着我国经济及工业的迅猛发展,重金属离子污染对人体生命健康的危害以及对生态环境的破坏日益加重。重金属离子一旦进入自然界就会对人类、动植物、生态环境造成严重的危害。这引起了全世界科学家们广泛的研究和关注。近几年,生物吸附技术作为热门的重金属离子去除方法,引起了广大科研工作者的极大兴趣。生物吸附法多采用廉价的农林废弃物作为吸附载体,通过化学改性制备出的吸附材料具有吸附效率高、吸附速度快和可再生等优点[1-3]。
农林废弃物具有廉价、无毒、易降解、环境友好等优点,是重要的生物质资源[4]。杨晓庆[5]使用甘蔗渣活性炭作为吸附剂吸附含铬废水,结果表明吸附率最大可达90%;张庆芳等[6]以花生壳颗粒为研究对象,探讨了粒径0.25~0.50 mm范围内吸附Cr(VI)的反应动力学,并在不同条件下(pH、时间、吸附剂量、温度和金属离子浓度)进行了单因素实验。
本文以松针粉为研究对象,通过酒石酸改性处理,制备出一种新型生物吸附剂。考察了不同参数,如pH、吸附时间和Cr(VI)初始浓度使用改性吸附剂对Cr(VI)吸附性能的影响,并对动力学参数进行了比较和计算。此外,吸附平衡数据是由两个经典等温吸附模型进行了分析。
1 实验材料与方法
1.1 仪器与试剂
仪器:FA2004A型电子分析天平,上海精天仪器有限公司;SHA-TA型恒温水浴振荡器,常州国华电器有限公司;202A-O型数显电热恒温干燥箱,上海锦屏仪器仪表有限公司;AAnalyst 200型原子吸收光谱仪,美国Perkin-Elmer公司;
试剂:酒石酸、Cr(VI)离子储备液、HCl、NaOH等均为分析纯。
1.2 改性松针粉吸附剂的制备
本实验所使用的松针采自于辽宁科技大学松针林。取100 g松针经自来水洗净烘干粉碎后过0.18 mm筛,再经去离子水清洗数次后于75℃烘箱烘干24 h。取20 g烘干后的松针粉(Pine needle powder,PNP)于500 mL锥形瓶中,再加200 mL浓度为0.1 mol/L的酒石酸溶液,于室温下静置24 h之后过滤,并用去离子水洗涤数次后置于60℃烘箱中烘干24 h,得酒石酸改性的松针粉,简称TAPNP。
1.3 静态吸附试验
称取20 mg TA-PNP于150 mL磨口锥形瓶中,加入20 mL一定浓度的Cr(VI)溶液,用0.1 moL/L HCl或NaOH调节其pH,加塞子以防止试验过程中溶液体积发生变化。恒温水浴振荡后过滤,将滤液转移至小塑料瓶并密封保存,用原子吸收光谱仪测定滤液中Cr(VI)含量。
1.3.1 pH值实验 取8份20 mg TA-PNP和20 mL质量分数为万分之0.5 Cr(VI)溶液置于磨口锥形瓶中,调节溶液pH分别为0.7,1.5,2.1,3.0,4.1,4.8,5.6,6.4。室温下恒温水浴振荡120 min后过滤,考察pH值对TA-PNP吸附Cr(VI)性能的影响。
1.3.2 动力学实验 取15份20 mg TA-PNP和20 mL质量分数为万分之0.5 Cr(VI)溶液置于磨口锥形瓶中,溶液pH值由上述试验确定。恒温振荡5,10,30 s;1,1.5,2,5,10,20,30 min;1,1.5,2,2.5,3 h后离心过滤,考察振荡时间对TA-PNP吸附Cr(VI)性能的影响。
1.3.3 等温吸附试验 取9份20 mg TA-PNP和20 mL质量分数分别为万分之0.10,0.25,0.50,0.75,1.00,2.50,5.00,7.50,9.00的Cr(VI)溶液置于磨口锥形瓶中,溶液pH值和振荡时间由上述试验确定,考察Cr(VI)初始质量分数对TA-PNP吸附Cr(VI)性能的影响。
1.4 数据处理
吸附率η(%)和吸附量q(mg/g)计算式
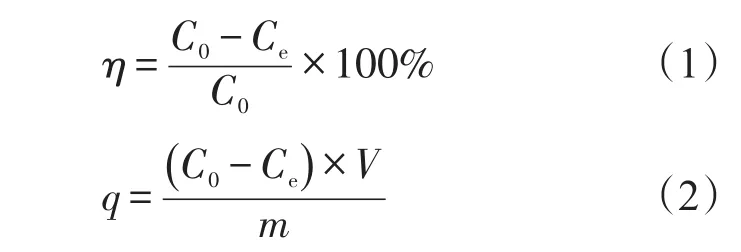
式中:V为溶液体积,L;C0和Ce分别为吸附反应前后溶液中Cr(VI)初始质量分数和平衡质量分数,mg/L;m为吸附剂的质量,g。
2 结果与讨论
2.1 pH值对吸附性能的影响
图1为不同平衡pH条件下TA-PNP对Cr(VI)的吸附效果。由图1可以看出,溶液pH对TA-PNP吸附Cr(VI)有显著影响。当pH<2.0时,吸附率随着pH值增大而增大,这是因为在强酸条件下,松针粉所携带的羟基、羧基等活性基团被质子化,以带正电的基团存在,易和含铬阴离子结合,从而达到Cr(VI)吸附去除的目的[7-11]。当pH≥2.0时,吸附率降低,这是由于酸度高时,TA-PNP表面的配位体与水合氢离子结合紧密,Cr(VI)难与其结合。因此,确定以后实验溶液中pH值为2.0左右。
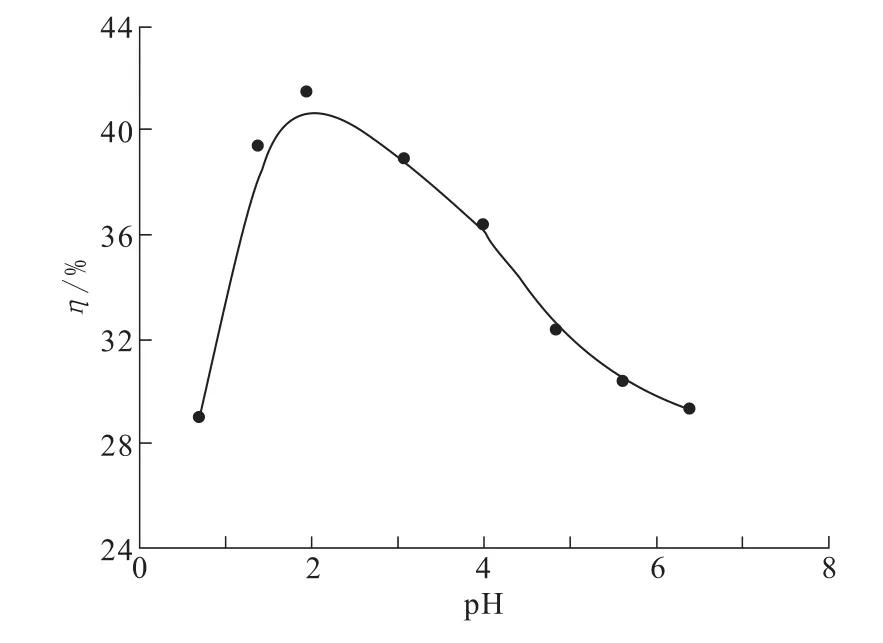
图1 pH值对吸附性能的影响Fig.1 Effect of pH on adsorption
2.2 吸附动力学
图2 为TA-PNP随时间对Cr(VI)吸附性能的影响。由图2可知,吸附量随吸附时间的延长而增加,在60 min时,吸附基本达到平衡。在本研究中,试验数据通过准一级、准二级和颗粒内扩散动力学方程进行了拟合计算。
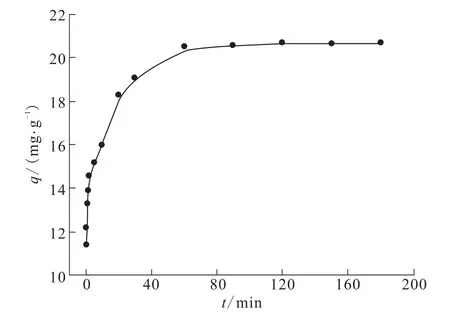
图2 吸附时间对吸附性能的影响Fig.2 Effect of time on adsorption
2.2 .1 准一级动力学方程 准一级动力学方程直线式
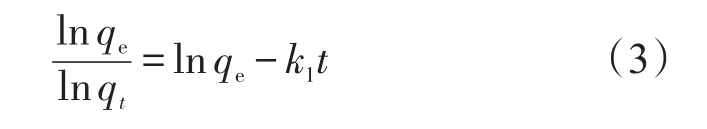
式中:k1为准一级速率常数,min-1;qe和qt分别为平衡吸附量和t时刻吸附量,mg/g;t为振荡时间,min。
图3为式(3)以lnqe/lnqt对t作直线方程拟合曲线。
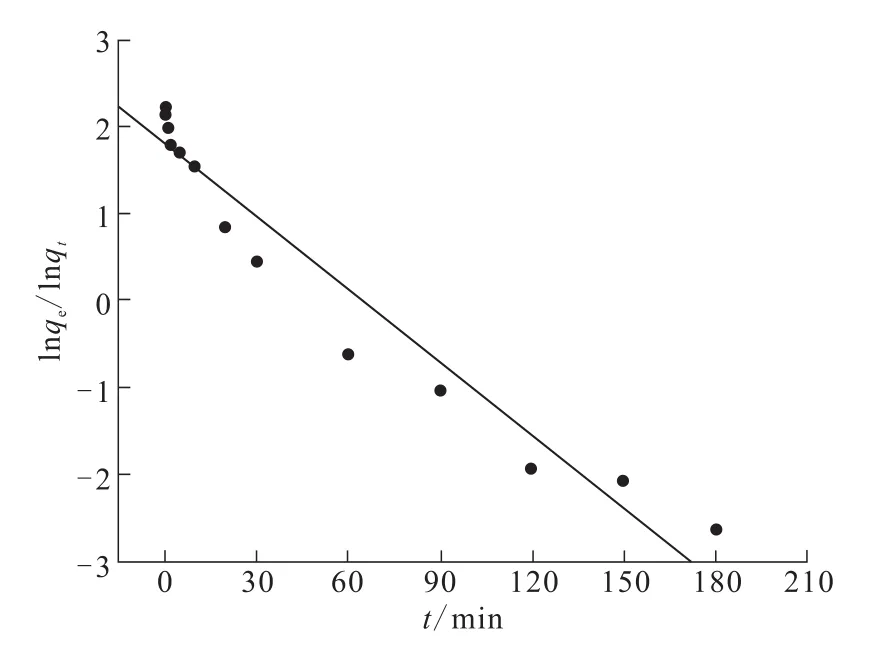
图3 TA-PNP吸附Cr(VI)的准一级动力学拟合曲线Fig.3 Pseudo-first order kinetic equation fitted curve of Cr(VI)adsorption on TA-PNP
由图3求得:拟合方程y=-0.027 93x+1.817 0,qe=6.15 mg/g,k1=0.028 min-1,R2=0.95。
2.2.2 准二级动力学方程 准二级动力学方程直线式
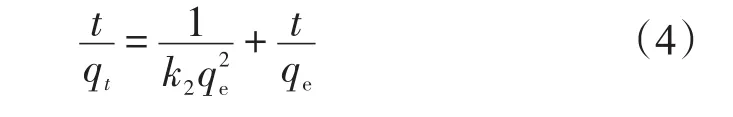
式中:k2为准二级速率常数,g/(mg·min)。
图4为公式(4)以t/qt对t作直线方程拟合曲线。
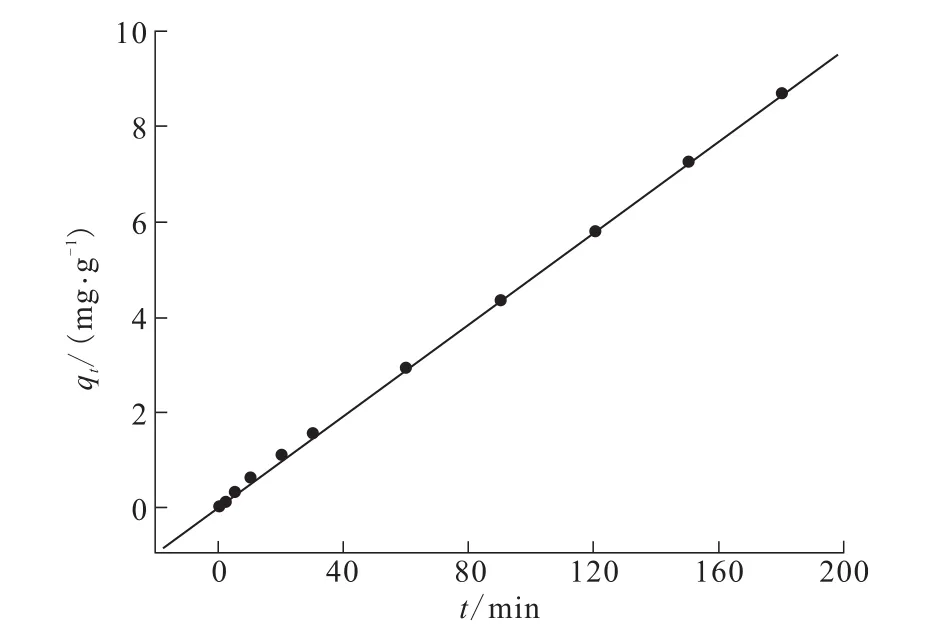
图4 TA-PNP吸附Cr(VI)的准二级动力学拟合曲线Fig.4 Pseudo-second order kinetic equation fitted curve of Cr(VI)adsorption on TA-PNP
由图4求得:拟合方程y=0.048 09x+0.058 7,qe=20.79 mg/g,k2=0.039 min-1,R2=0.99。
由图3和图4及求得的相关参数可以看出,TA-PNP在室温下吸附动力学符合准二级动力学方程,相关系数R2≈1。由图4求得的相关参数可知,平衡吸附量qe理论值为20.79;由图2可知,平衡吸附量qe实验值为20.59,qe理论值与qe实验值相差无几,这表明TA-PNP对Cr(VI)的吸附符合准二级动力学,为化学吸附。
2.2.3 内扩散模型拟合 吸附剂对吸附液相中重金属离子的动力学行为可分为三个阶段,一是膜扩散;二是内扩散;三是吸附反应。一般情况下吸附速率越快,总吸附速率是受膜扩散、内扩散或由两者共同控制[12]。我们对动力学数据进行了颗粒内扩散模型拟合,以便进一步了解TA-PNP对Cr(VI)的吸附机理。
颗粒内扩散方程为[13]

图5为式(5)以对qt作直线方程拟合曲线。
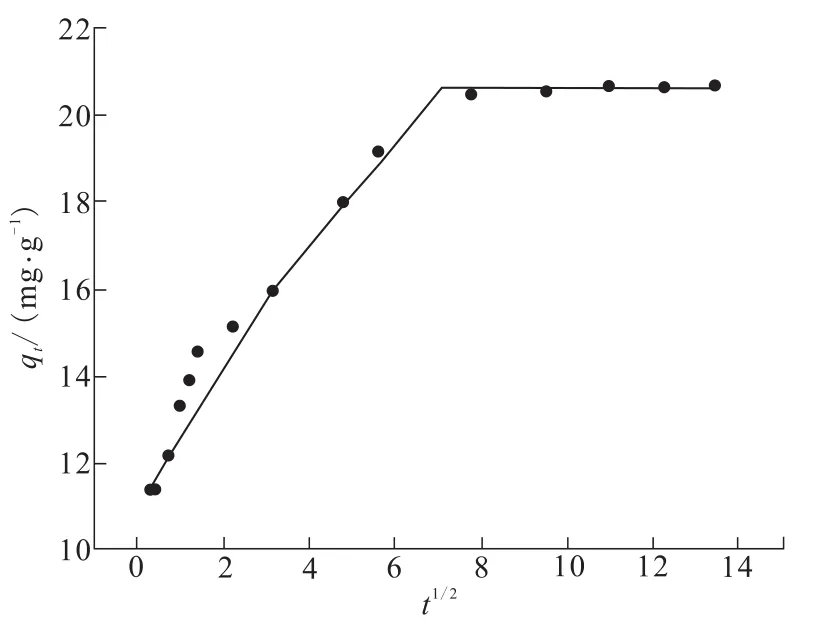
图5 TA-PNP吸附Cr(VI)的颗粒内扩散拟合曲线Fig.5 Intra-particle diffusion fitted curve of Cr(VI)adsorptionon TA-PNP
由图5可以看出,曲线经过了三次拟合,代表了吸附过程经历了三个步骤。第一阶段为膜扩散,表明Cr(VI)扩散到了TA-PNP表面;第二阶段为内扩散,表明Cr(VI)在TA-PNP在孔隙内的扩散;第三阶段为吸附反应。从图5还可以观察到,第一阶段直线的斜率比第二阶段的大,这说明膜扩散过程比内扩散快。第三阶段直线接近水平,表明TA-PNP浸入溶液中在短时间内达到吸附平衡,且随时间的延长解吸附作用没有显著增强。图5求得:拟合方程y1=1.672 9x1+11.298,R2=0.896 3;拟合方程 y2=0.672 3x2+15.294,R2=0.997 5;拟合方程 y3=0.030 6x3+20.267,R2=0.992 2。
2.3 等温吸附线
图6为TA-PNP对Cr(VI)的等温吸附线。由图6可得出,TA-PNP的吸附量随着Cr(VI)初始质量分数的增大而增大,当Cr(VI)初始质量分数大于750 mg/L时,曲线逐渐趋于平缓,最终到达吸附平衡状态。将图6的数据用Freundlich[14](式(6))和Langmuir[15](式(7))等温吸附模型进行模拟。
Freundlich等温吸附方程
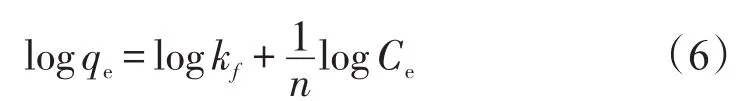
式中:kf和n分别为Freundlich吸附经验常数。
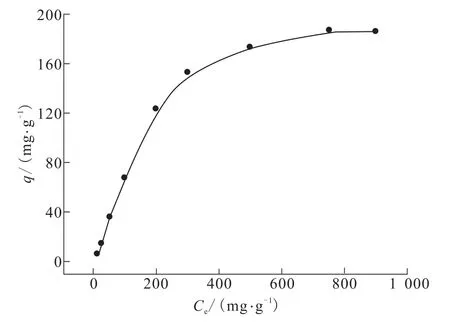
图6 TA-PNP吸附Cr(VI)的等温线Fig.6Adsorption isotherms of Cr(VI)adsorption on TA-PNP
图7 为式(6)以logqe对logCe作直线方程拟合曲线。
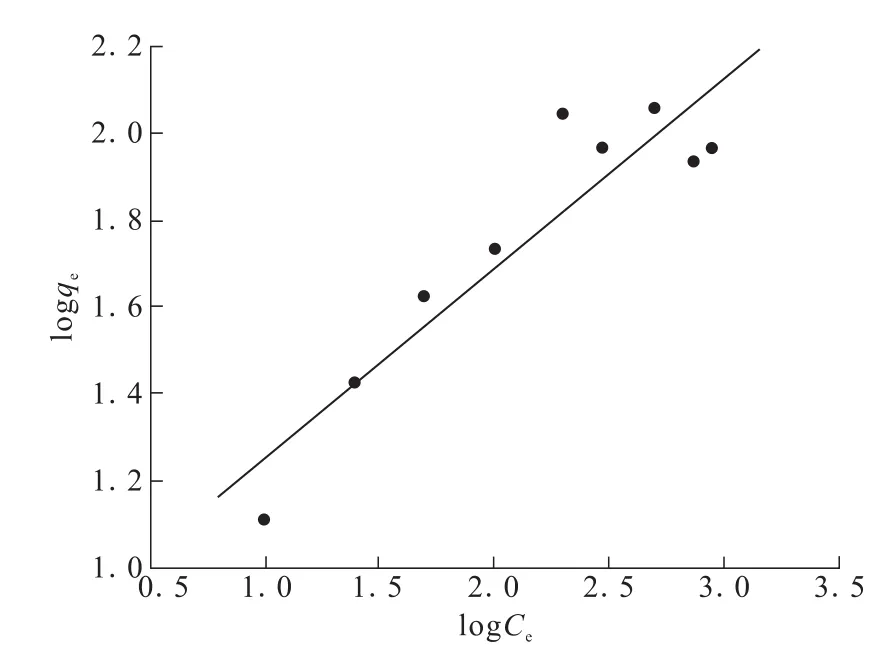
图7 TA-PNP吸附Cr(VI)的Freundlich吸附模型Fig.7 Freundlich adsorption model of Cr(VI)adsorption onTA-PNP
由图7求得相关参数:等温吸附方程y=0.439 3x+0.810 8,kf=6.470.44,R2=0.85。
Langmuir等温吸附方程
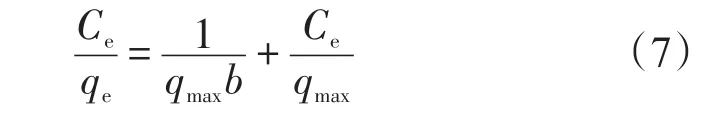
式中:b为Langmuir吸附常数,L/mg。
图8为式(7)以Ce/qe对Ce作直线方程拟合曲线。
由图8求相关参数:等温吸附方程y=0.011 22x+0.390 6,qmax=98.62 mg/g,b=0.026 L/mg,R2=0.95。
由图7和图8求得的相关参数可以看出,TA-PNP对Cr(VI)的吸附更符合Langmuir等温吸附模型,最大吸附量为98.62 mg/g。
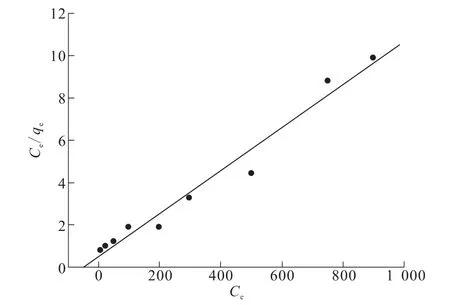
图8 TA-PNP吸附Cr(VI)的Langmuir吸附模型Fig.8Langmuir adsorption model of Cr(VI)adsorption on TA-PNP
3 结论
以松针粉为原料,经过酒石酸化学改性制备了一种新型松针粉生物吸附剂(TA-PNP)用于对水溶液中Cr(VI)的去除。通过单因素试验研究了溶液pH值,吸附反应时间和Cr(VI)溶液初始质量分数对TA-PNP吸附Cr(VI)性能的影响,建立了动力学和吸附等温线模型,并得到了相关的参数。根据实验结果可得出以下结论:
(1)室温下,pH=2.0,吸附剂用量20 mg,吸附时间60 min,处理20 mL Cr(VI)溶液质量分数为750 mg/L时,TA-PNP对C(rVI)吸附效果最佳。
(2)动力学研究表明,TA-PNP对Cr(VI)的吸附符合准二级动力学模型,这表明化学吸附控制其吸附速率;通过颗粒内扩散模型研究表明,膜扩散和内扩散共同控制总吸附速率。
(3)吸附等温线研究表明,TA-PNP对Cr(VI)的吸附遵循Langmuir等温吸附模型,通过酒石酸改性后的松针粉最大吸附量为98.62 mg/g。
[1]张建梅.含重金属废水的处理技术[J].西安联合大学学报,2003,6(2):55-59.
[2]粱莎,冯宁川,郭学益.生物吸附处理重金属废水的进展[J].水处理技术,2009,35(3):13-17.
[3]李霞,李风亭,张冰如.生物吸附去除水体的重金属[J].工业水处理,2004,24(3):1-5.
[4]崔杏雨,陈树伟,范彬彬,等.利用农林废弃物对重金属离子废水的去除[J].安全与环境学报,2008(6):43-46.
[5]杨晓庆,方正,侯芳丽,等.甘蔗渣活性炭处理含铬电镀废水[J].电镀与涂饰,2014,33(23):1033-1035.
[6]张庆芳,金鑫,王磊,等.花生壳对Cr(VI)吸附的动力学方程[J].安全与环境学报,2011,11(2):83-86.
[7]AGAR M K,KESKIN M E,MAZLUM S,etc.Hg(II)and Pb(II)adsorption on activated sludge biomass:Effective biosorption mechanism[J].International Journal of Mineral Processing,2008,87(1):1-8.
[8]GUPTA V K,RASTOGI A.Equilibrium and kinetic modeling of cadmium(II)biosorption by nonliving algal biomass Oedogonium sp.from aqueous phase[J].Journal of Hazardous Materials,2008,153(1-2):759-766.
[9]赵晖,廖祥,陈金文,等.改性木屑吸附处理含Cr(VI)废水[J].化工环保,2011(5):402-405.
[10]赵晖,廖雄,周子强,等.改性农业废弃物花生壳对含铬重金属废水的吸附处理[J].应用化工,2011,40(10):1741-1744.
[11]ZHANG S Q,HOU W G.Adsorption behavior of Pb(II)on montmorillonite[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2008,320(1-3):92-97.
[12]MOHANA S V,RAOA N C,KARTHIKEYAN J.Adsorptive removal of direct azo dye from aqueous phase onto coal based sorbents:a kinetic and mechanistic study[J].Hazardous Materials,2002,90(2):189-204.
[13]WEBER W J,MORRIS J C.Kinetics of adsorption on carbon from solution[J].Asce Sanitary Engineering Division Journal,1963,1(2):1-2.
[14]FREUNDLICH H M F.Uber die adsorption in losungen[J].ZeitschriftfurPhysikalische Chemie-Leipzig,1906,57:385-470.
[15]LANGMUIR I.The adsorption of gases on plane surfaces of glass,mica and platinum[J].Journal of American Chemistry Society,1918,143(9):1361-1403.
