肿瘤坏死因子对喉鳞状细胞癌细胞的增殖抑制作用
2018-01-18孙群胡翔胡福云
孙群,胡翔,胡福云
(深圳市宝安区石岩人民医院耳鼻喉科1、普外科2、外一科3,广东深圳518108)
喉鳞状细胞癌(laryngeal squamous cellcarcinoma,LSCC)是头颈部最常见的恶性肿瘤,也是仅次于肺癌的呼吸道癌症[1]。LSCC好发于中老年男性,流行病学资料显示,我国每年有3~5/10万新发喉癌患者,其中LSCC占96%左右,发病率占全身恶性肿瘤的5.7%~7.6%,并且呈现逐年上升的趋势[2]。手术、放疗、化疗仍为目前主要的治疗手段,但是治疗后复发、转移、化疗耐受等问题较多,术后5年生存率约为61%[3],预后不理想,迫切需要新的治疗手段。LSCC的病因和发病机制尚未完全明确,近来研究认为,其发生发展与细胞的过度增殖和凋亡的减少有关[4],相关的分子靶向治疗研究越来越广泛。肿瘤坏死因子(TNF)有明确的抗肿瘤活性,也是体内重要的细胞因子,能够抑制肿瘤细胞增殖,促进细胞凋亡,参与肿瘤发生、发展的调节,是目前肿瘤治疗常见的分子靶[5],已用于肿瘤免疫及肿瘤临床的研究,部分产品也已投入临床试用。但是,TNF在LSCC中对鳞癌细胞的毒作用和机制的相关研究较少。本研究旨在探讨TNF对喉鳞状细胞癌细胞的增殖抑制作用。
1 材料与方法
1.1 研究对象人喉鳞癌Hep-2细胞株,由中国科学院上海细胞生物学研究所提供。
1.2 药品与试剂重组人肿瘤坏死因子α(TNF-α),货号:CYT-223,以色列ProSpec-Tany公司产品,采用RPMI-1640培养基配制20 pg/mL、50 pg/mL、100 pg/mL、200 pg/mL浓度的TNF-α溶液;RPMI-1640培养基、胎牛血清(FBS)购自美国HyClone公司;磷酸盐缓冲溶液(PBS)、四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、0.5%聚乙二醇辛基苯基醚(0.5%Txiton X-100),购自上海紫一试剂厂;0.25%胰蛋白酶消化液,美国Gibco公司产品;细胞周期与细胞凋亡检测试剂盒[碘化丙啶染色法(PI)],碧云天生物技术研究所产品;BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司产品;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)凝胶配制试剂盒,购自上海歌凡生物科技有限公司;兔抗人CDK4单克隆抗体、辣根过氧化物酶(HRP)标记羊抗兔IgG二抗,购自上海意杰生物科技有限公司产品;增强型化学发光(ECL)底物显色试剂盒,购自南京森贝伽生物科技有限公司;SABC免疫组化染色试剂盒、DAB显色试剂盒,购自北京索莱宝科技有限公司。
1.3 仪器细胞培养板、细胞培养瓶,美国BD Falcon公司;J6HC离心机、CytoFLEX流式细胞仪及配套软件,美国Beckman Coulter公司产品;CO2细胞培养箱,日本三洋SANYO公司产品;YB12恒温水浴箱,英国Prima公司产品;Awareness 2100酶标仪,美国Awareness Technology公司产品;Gene genius凝胶成像仪,英国Syngene公司产品。
1.4 方法
1.4.1 细胞复苏及培养取出保存于液氮罐中的人喉鳞癌Hep-2细胞株冻存管,迅速置于37℃水浴锅中,恒温水浴,使其在1 min内快速融化;采用无菌移液器将细胞悬液移入离心管内,加入3 mL RPMI-1640完全培养基[含10%灭活胎牛血清(FBS)、100 U/mL青霉素、100 μg/mL链霉素],轻轻吹打均匀;采用1 000 r/min速度离心8 min,弃去上清液;于沉淀物中滴加10 mL RPMI-1640完全培养基,将细胞重悬,细胞悬液转移至50 mL细胞培养瓶内,在37℃、5%CO2相对饱和湿度的培养箱中培养;2~3 d后,加入4 mL 0.25%胰酶消化传代;待细胞贴壁生长占满培养瓶底面积80%时,即处于对数生长期。
1.4.2 MTT法检测喉鳞癌Hep-2细胞增殖抑制率取对数生长期的喉鳞癌Hep-2细胞,加入RPMI-1640完全培养基制备单细胞悬液,调整浓度为5×104个/mL,将100 μL细胞悬液接种于96孔培养板,每孔滴加200 μL RPMI-1640完全培养基,在37℃、5%CO2相对饱和湿度的培养箱中培养12 h;将培养孔分为对照组、用药组,吸去培养基,对照组加入100 μL完全培养基,用药组分别加入100 μL浓度为20 pg/mL、50 pg/mL、100 pg/mL、200 pg/mL的TNF-α溶液,各组设6个复孔,另外设置空白组,该组不含细胞;各培养孔滴加100 μL RPMI-1640完全培养基,在37℃、5%CO2相对饱和湿度的培养箱中培养;分别培养24 h、48 h后,每孔滴加5 mg/mL MTT溶液(pH=7.4)20μL,继续培养4 h;除去上清,每孔滴加150 μL DMSO溶液,充分混匀溶解10 min后,采用酶标仪在570 nm波长处检测对各培养孔光密度(OD值)。计算喉鳞癌Hep-2细胞增殖抑制率(%)=[1-(用药组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.4.3 流式细胞术(FCM)分析喉鳞癌Hep-2细胞凋亡率和细胞周期取对数生长期的喉鳞癌Hep-2细胞,加入RPMI-1640完全培养基制备单细胞悬液,调整浓度为1×105个/mL,取2 mL/孔细胞悬液接种于6孔板中,同时滴加100 μL RPMI-1640完全培养基,在37℃、5%CO2相对饱和湿度的培养箱中培养24 h,分为对照组、用药组,吸去培养基,对照组加入100 μL完全培养基,用药组分别加入100 μL浓度为20 pg/mL、50 pg/mL、100 pg/mL、200 pg/mL的TNF-α溶液,各组设6个复孔,培养48 h,收集各培养孔细胞,滴加0.25%胰酶4 mL消化后制备单细胞悬液,采用离心机以1 000 r/min速度离心,5 min后除去上清液,沉淀物采用磷酸盐缓冲液(PBS)冲洗2次,滴加70%乙醇5 mL固定;4℃过夜后,采用离心机以1 000 r/min速度离心,5 min后除去乙醇,PBS冲洗细胞,根据细胞周期与细胞凋亡检测试剂盒说明书的步骤进行操作,采用流式细胞仪分析不同时间各组喉鳞癌Hep-2细胞凋亡率及细胞周期。
1.4.4 免疫组织化学法检测喉鳞癌Hep-2细胞中PCNA表达水平按照1.4.3中的方法培养喉鳞癌Hep-2细胞,并进行分组干预,取细胞悬液滴于细胞爬片上贴片30 min,置于RPMI-1640完全培养基内,在37℃、5%CO2相对饱和湿度的培养箱中培养3 h,PBS冲洗,依次采用4%多聚甲醛处理20 min、0.5%Txiton X-100处理20 min、3%H2O2处理15 min,按照SABC免疫组化染色试剂盒、DAB显色试剂盒说明书进行免疫组化染色,在光镜下对染色结果进行观察。染色结果判定:细胞核呈棕黄色至棕褐色为染色阳性。阳性细胞率评分标准:0分:阳性细胞率<5%;1分:5%≤阳性细胞率<30%;2分:30%≤阳性细胞率<70%;3分:阳性细胞率≥70%。着色程度评分标准:阴性记0分,弱阳性记1分,阳性记2分,强阳性记3分。PCNA表达水平=阳性细胞率评分+着色程度评分。
1.4.5 Western blot法检测喉鳞癌Hep-2细胞CDK4表达水平按照1.4.3中的方法培养喉鳞癌Hep-2细胞,并进行分组干预,滴加细胞裂解液,置于冰上裂解细胞30 min,采用离心机以1 000 r/min速度离心10 min,获得含有蛋白质的上清液,按照BCA测定试剂盒说明书步骤进行操作,检测总蛋白浓度;配制SDS-PAGE凝胶,采用SDS-PAGE凝胶分离纯化蛋白质,将蛋白转移至聚偏二氟乙烯膜(PVDF),PVDF膜置于5%脱脂奶粉中封闭90 min,PBS冲洗3次,滴加兔抗人CDK4单克隆抗体(1:1 000稀释)、内参基因β-Actin抗体(1:500稀释),4℃过夜,PBS冲洗5 min×3次;滴加HRP标记二抗,室温孵育2 h,PBS冲洗5 min×3次;按照ECL显色试剂盒说明书进行操作,暗室内X线片显影、定影,重复三次。采用Gene genius凝胶成像仪对电泳结果进行拍照、分析,测定CDK4表达水平。
1.5 统计学方法所有统计数据均统一整理,应用SPSS18.0软件包分析,符合正态性的计量资料以均数±标准差(±s)表示,多组间资料比较采用单因素方差分析(One-way ANOVA),应用GraphPad Prism软件绘制图表。以P<0.05为差异有统计学意义。
2 结果
2.1 各组喉鳞癌Hep-2细胞增殖抑制率比较与对照组比较,各浓度TNF-α组在24 h、48 h喉鳞癌Hep-2细胞增殖抑制率明显较高,差异有统计学意义(P<0.05),且喉鳞癌Hep-2细胞增殖抑制率20 pg/mL TNF-α组<50 pg/mL TNF-α组<100 pg/mL TNF-α组和200 pg/mL TNF-α组(P<0.05);与24 h比较,相同浓度TNF-α作用48 h后细胞增殖抑制率较高,差异有统计学意义(P<0.05),见表1。
表1 各组喉鳞癌Hep-2细胞增殖抑制率比较±s,%)

表1 各组喉鳞癌Hep-2细胞增殖抑制率比较±s,%)
注:与对照组比较,aP<0.05;与50 pg/mL TNF-α组比较,bP<0.05;与20 pg/mLTNF-α组比较,cP<0.05;与24 h比较,dP<0.05。
组别对照组20 pg/mLTNF-α组50 pg/mLTNF-α组100 pg/mLTNF-α组200 pg/mLTNF-α组F值P值48 h 0.00±0.00 19.27±2.33abd 34.28±4.38acd 78.87±9.26abcd 79.14±9.75abcd 25.618<0.05例数66666 24 h 0.00±0.00 15.74±2.21ab 27.64±3.18ac 58.37±5.63abc 60.46±7.47abc 19.871<0.05
2.2 各组喉鳞癌Hep-2细胞凋亡率比较与对照组比较,各浓度TNF-α组在24 h、48 h喉鳞癌Hep-2细胞凋亡率明显较高,差异有统计学意义(P<0.05),且喉鳞癌Hep-2细胞凋亡率20 pg/mL TNF-α组<50 pg/mL TNF-α组<100 pg/mL TNF-α组和200 pg/mL TNF-α组(P<0.05);与24 h比较,相同浓度TNF-α作用48 h后细胞凋亡率较高,差异有统计学意义(P<0.05),见表2。
2.3 各组喉鳞癌Hep-2细胞细胞周期比例比较与对照组比较,各浓度TNF-α组喉鳞癌Hep-2细胞S期细胞比例降低,G2/M期细胞比例升高,差异有统计学意义(P<0.05),存在G2/M期细胞阻滞;且在20~100 pg/mL浓度范围内,TNF-α浓度越高,G2/M期细胞阻滞越严重(P<0.05),见表3。
表2 各组喉鳞癌Hep-2细胞凋亡率比较±s,%)
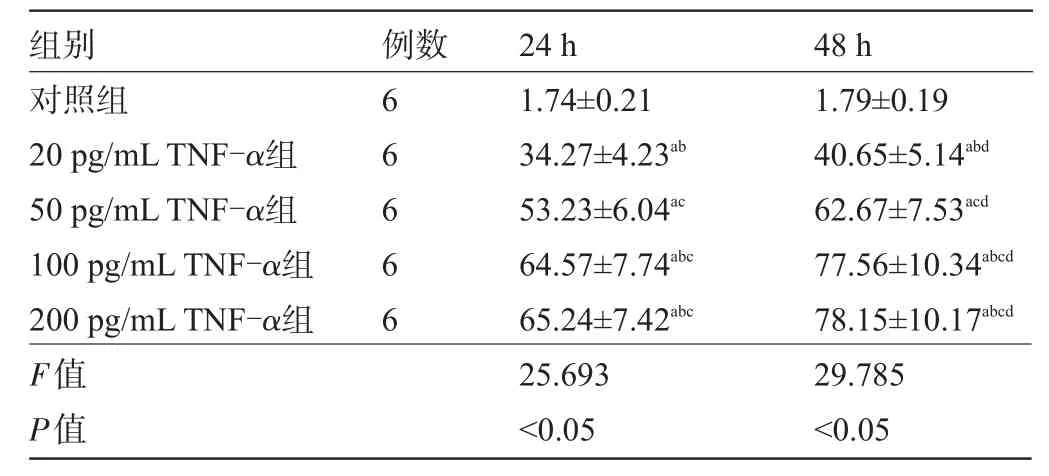
表2 各组喉鳞癌Hep-2细胞凋亡率比较±s,%)
注:与对照组比较,aP<0.05;与50 pg/mL TNF-α组比较,bP<0.05;与20 pg/mLTNF-α组比较,cP<0.05;与24 h比较,dP<0.05。
组别对照组20 pg/mLTNF-α组50 pg/mLTNF-α组100 pg/mLTNF-α组200 pg/mLTNF-α组F值P值48 h 1.79±0.19 40.65±5.14abd 62.67±7.53acd 77.56±10.34abcd 78.15±10.17abcd 29.785<0.05例数66666 24 h 1.74±0.21 34.27±4.23ab 53.23±6.04ac 64.57±7.74abc 65.24±7.42abc 25.693<0.05
表3 各组喉鳞癌Hep-2细胞细胞周期比例比较(±s,%)

表3 各组喉鳞癌Hep-2细胞细胞周期比例比较(±s,%)
注:与对照组比较,aP<0.05;与50 pg/mL TNF-α组比较,bP<0.05;与20 pg/mLTNF-α组比较,cP<0.05。
组别例数细胞周期对照组20 pg/mLTNF-α组50 pg/mLTNF-α组100 pg/mLTNF-α组200 pg/mLTNF-α组F值P值66666 G0/G1期68.84±3.36 67.63±4.35 66.74±4.83 62.85±3.84a 62.28±3.68ac 5.314<0.05 S期22.58±2.85 19.53±1.56ab 16.73±1.75ac 13.66±2.18abc 13.35±1.47abc 12.864<0.05 G2/M期7.16±0.94 11.63±1.03ab 18.64±1.47ac 25.36±2.17abc 25.75±2.05abc 17.548<0.05
2.4 各组喉鳞癌Hep-2细胞PCNA表达水平比较与对照组比较,各浓度TNF-α组在24 h、48 h喉鳞癌Hep-2细胞PCNA表达水平明显较低,差异有统计学意义(P<0.05),且喉鳞癌Hep-2细胞PCNA表达水平20 pg/mL TNF-α组>50 pg/mL TNF-α组>100 pg/mL TNF-α组和200 pg/mL TNF-α组(P<0.05);与24 h比较,相同浓度TNF-α作用48 h后细胞PCNA表达水平较低,差异有统计学意义(P<0.05),见表4。
表4 各组喉鳞癌Hep-2细胞PCNA表达水平比较(±s,%)
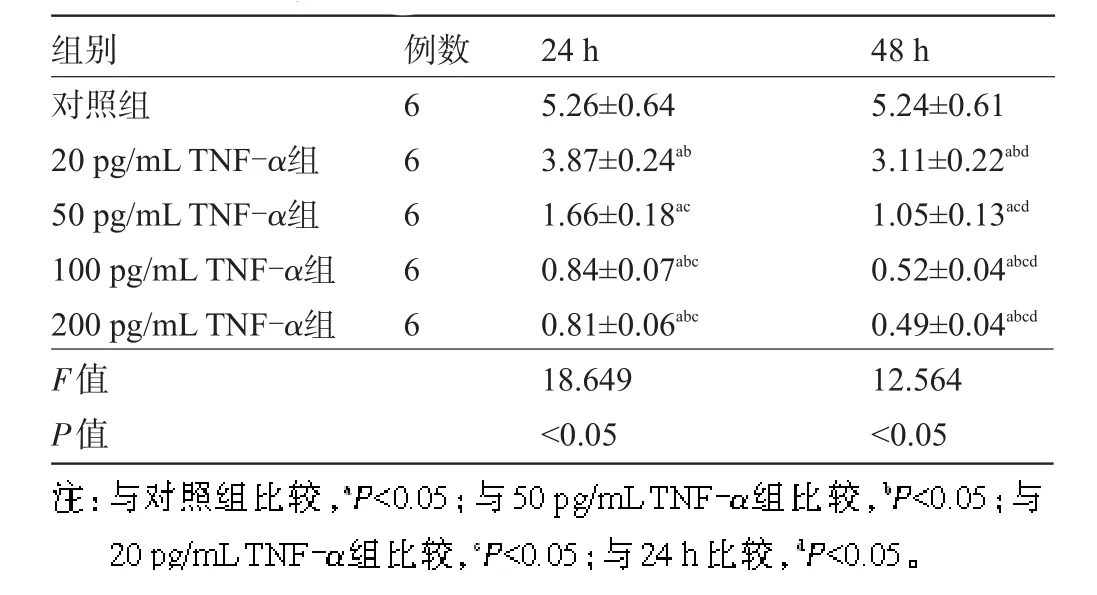
表4 各组喉鳞癌Hep-2细胞PCNA表达水平比较(±s,%)
组别对照组20 pg/mLTNF-α组50 pg/mLTNF-α组100 pg/mLTNF-α组200 pg/mLTNF-α组F值P值例数66666 24 h 5.26±0.64 3.87±0.24ab 1.66±0.18ac 0.84±0.07abc 0.81±0.06abc 18.649<0.05 48 h 5.24±0.61 3.11±0.22abd 1.05±0.13acd 0.52±0.04abcd 0.49±0.04abcd 12.564<0.05
2.5 各组喉鳞癌Hep-2细胞CDK4活性比较与对照组比较,各浓度TNF-α组在24 h、48 h喉鳞癌Hep-2细胞CDK4活性明显较低,差异有统计学意义(P<0.05),且喉鳞癌Hep-2细胞CDK4活性20 pg/mL TNF-α组>50 pg/mL TNF-α组>100 pg/mL TNF-α组和200 pg/mL TNF-α组(P<0.05);与24 h比较,相同浓度TNF-α作用48 h后细胞CDK4活性较低,差异有统计学意义(P<0.05),见表5和图1。
表5 各组喉鳞癌Hep-2细胞CDK4活性比较s)
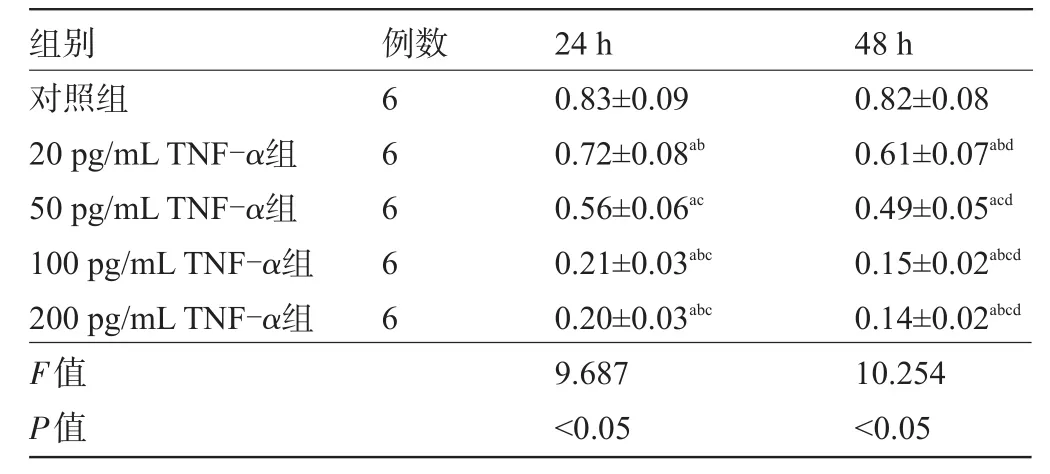
表5 各组喉鳞癌Hep-2细胞CDK4活性比较s)
注:与对照组比较,aP<0.05;与50 pg/mL TNF-α组比较,bP<0.05;与20 pg/mLTNF-α组比较,cP<0.05;与24 h比较,dP<0.05。
组别对照组20 pg/mLTNF-α组50 pg/mLTNF-α组100 pg/mLTNF-α组200 pg/mLTNF-α组F值P值48 h 0.82±0.08 0.61±0.07abd 0.49±0.05acd 0.15±0.02abcd 0.14±0.02abcd 10.254<0.05例数66666 24 h 0.83±0.09 0.72±0.08ab 0.56±0.06ac 0.21±0.03abc 0.20±0.03abc 9.687<0.05
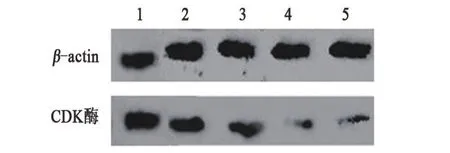
图1 Western blot法检测各组喉鳞癌Hep-2细胞CDK4活性的图像
3 讨论
LSCC是最常见的喉癌类型,临床上以声嘶、呼吸困难、咳嗽、吞咽异常等症状为主要表现,吸烟、饮酒、空气污染、长期接触有毒化学物质及放射线、病毒感染、性激素、微量元素缺乏等是引起该病常见的危险因素[6-7]。近年来随着吸烟人口增多、环境污染严重等发病率及死亡率不断上升,给患者造成很大痛苦,给社会也造成了沉重负担。LSCC的治疗以手术、化疗、放疗等为主,首次治疗后易发生局部复发,还有可能对抗肿瘤药物产生耐药性,导致患者预后较差[8],因此,寻找更为安全有效的治疗手段尤为重要。
TNF又被称为恶液质素,是由体内活化的巨噬细胞、NK细胞、T淋巴细胞等产生的重要细胞因子,也是首个用于肿瘤生物疗法的细胞因子,已经成为医学研究的热点。TNF有明确的抗肿瘤活性,能够通过诱导肿瘤细胞程序性死亡、增强宿主免疫功能、抗肿瘤新生血管形成、诱导肿瘤血管功能紊乱等机制来发挥抗肿瘤作用[9-10]。研究显示,TNF对多种恶性肿瘤有较好的效果,能提高常规化疗治疗晚期非小细胞肺癌的疗效[11],还对MKN45胃癌细胞株的生长有显著的增殖抑制作用[12]。但是,目前关于TNF在LSCC中作用的相关研究较少。本次选择人喉鳞癌Hep-2细胞株进行培养,分为对照组和药物组,分别采用0 pg/mL、20 pg/mL、50 pg/mL、100 pg/mL、200 pg/mL TNF-α溶液对细胞进行干预,培养24 h及48 h后,采用MTT法观察各组细胞的增殖,FCM法检测细胞凋亡及细胞周期比例分布。结果显示,与对照组比较,各浓度TNF-α组Hep-2细胞增殖抑制率及凋亡率较高,且20 pg/mL TNF-α组<50 pg/mLTNF-α组<100 pg/mL TNF-α组和200 pg/mL TNF-α组;与24 h比较,相同浓度TNF-α作用48 h后细胞增殖抑制率及凋亡率较高(P<0.05),表明TNF能够有效抑制人喉鳞癌Hep-2细胞增殖,促进细胞凋亡,且在20~100 pg/mL范围内,药物浓度越高,作用时间越长,对细胞增殖的抑制作用和促进细胞凋亡作用越强,具有剂量和时间依赖性。本研究中不同浓度TNF细胞增殖的抑制的相关研究既往尚不多见,这也是研究的创新之处,也提示TNF可能对喉鳞状细胞癌的治疗存在一定的临床意义。
细胞周期调节失控能够导致肿瘤细胞不受控制的进入细胞周期循环和快速复制,是恶性肿瘤细胞不断分裂增殖的原因之一,干预肿瘤细胞周期,防止其进入分裂期是治疗肿瘤的手段之一。G1/S期和G2/M期是细胞周期的关键节点[13],将细胞阻滞于此周期可延缓细胞分裂进程,抑制肿瘤细胞增殖。本研究结果显示,与对照组比较,各浓度TNF-α组Hep-2细胞S期细胞比例较低,G2/M期细胞比例较高;且在20~100 pg/mL浓度范围内,TNF-α浓度越高,G2/M期细胞阻滞越严重(P<0.05),表明TNF-α能有效干预肿瘤细胞周期,将人喉鳞癌Hep-2细胞阻滞于G2/M期,减少细胞增殖,从而防治肿瘤进展。另一方面,PCNA也参与细胞增殖过程,其为DNA聚合酶δ的辅助蛋白,主要由细胞核合成,与DNA合成关系密切,可以加速DNA合成速度,启动细胞增殖过程。另外,PCNA还能协同调控DNA修复、细胞周期控制、细胞凋亡等多个过程,是反映细胞增殖状态的良好指标。有研究认为,PCNA在LSCC中异常表达[14]。CDK4属于核内丝氨酸-苏氨酸蛋白激酶,是细胞周期调控的关键蛋白之一,其含量在各细胞周期中相对稳定,能够促进细胞增殖和分裂,在LSCC中呈高表达状态,可以推动LSCC进展,能够用于判断患者预后[15]。本研究结果显示,与对照组比较,各浓度TNF-α组Hep-2细胞PCNA表达水平及CDK4活性较低;且20 pg/mL TNF-α组>50 pg/mL TNF-α组>100 pg/mL TNF-α组和200 pg/mL TNF-α组;与24 h比较,相同浓度TNF-α作用48 h后Hep-2细胞PCNA表达水平及CDK4活性较低(P<0.05),表明TNF能剂量和时间依赖性地下调PCNA表达水平及CDK4活性,从而抑制细胞增殖,促进细胞周期阻滞,起到抗肿瘤和改善预后作用。
综上所述,TNF对喉鳞状细胞癌Hep-2细胞增殖具有抑制作用,能够使细胞阻滞于G2期,促进细胞凋亡,其作用可能与下调PCNA表达水平和CDK酶活性有关。因此,本研究可能为喉鳞状细胞癌的临床治疗提供了新的研究方向,有望探索出新的治疗有效方法。
[1] 谢芳,董频.喉癌预后相关因素的研究进展[J].中国中西医结合耳鼻咽喉科杂志,2014,22(4):317-320,265.
[2] 柴丽娟.健康教育在喉癌手术患者中的应用[J].医学信息,2014,28(13):254-255.
[3] Wiest I,Alexiou C,Mayr D,et al.Expression of the carbohydrate tumor marker Sialyl Lewis a(Ca19-9)in squamous cell carcinoma of the larynx[J].Anticancer Res,2010,30(5):1849-1853.
[4] 王洋,王斌全,高伟,等.MicroRNA-155对喉鳞状细胞癌Hep-2细胞株的作用[J].中国耳鼻咽喉头颈外科,2013,20(6):285-289.
[5] 江海龙,王宁远,陆一鸣.肿瘤坏死因子受体选择性拮抗剂的研究进展[J].药学实践杂志,2015,33(5):392-395.
[6] Langevin SM,Mcclean MD,Michaud DS,et al.Occupational dust exposure and head and neck squamous cell carcinoma risk in a population-based case-control study conducted in the greater Boston area[J].Cancer Med,2013,2(6):978-986.
[7] 马炳莲,潘绍永,田甜.薄层CT扫描对喉癌的诊断及临床价值[J].心血管病防治知识,2016,15(8):138-139.
[8] 马岩,孙磊,于雷,等.头颈部肿瘤靶向治疗的研究进展[J].中国肿瘤生物治疗杂志,2014,21(3):342-347.
[9] Thomas JA,Pope C,Wojtacha D,et al.Macrophage therapy for murine liver fibrosis recruits host effector cells improving fibrosis,regeneration,and function[J].Hepatology,2011,53(6):2003-2015.
[10] 马杰,李银平.肿瘤坏死因子治疗恶性肿瘤的研究进展[J].中国中西医结合急救杂志,2013,20(5):313-314.
[11] 马杰,孙茜,李银平.重组改构人肿瘤坏死因子联合常规化疗治疗晚期非小细胞肺癌有效性和安全性的系统评价[J].中国中西医结合急救杂志,2012,19(5):296-299.
[12] 张娜,季万胜,杨炳乾,等.肿瘤坏死因子对不同分化程度胃癌细胞增殖及Δ133p53表达的影响[J].中国肿瘤,2015,24(4):335-339.
[13] 叶俊杰,梅自洁,李杰,等.细胞分裂周期素25A影响放射线照射后HEp-2细胞的G2/M期阻滞及凋亡[J].武汉大学学报医学版,2013,34(2):201-204.
[14] 邱连升,王佳蓉,陈翊民,等.喉鳞癌和癌前病变中细胞凋亡及PCNA、P53、Bcl-2表达研究[J].世界最新医学信息文摘:连续型电子期刊,2015,15(36):8-9.
[15] 曹影,王培蓓,马荧雪,等.miR-137对人喉癌细胞株Hep-2细胞增殖的影响[J].江苏医药,2013,39(9):1015-1017.
