干扰性小核糖核酸靶向抑制趋化因子受体4基因表达对鼻咽癌细胞增殖和侵袭的影响
2018-01-18鲁保才卢振民张爱民余文发史海旭王慧敏袁东杰
鲁保才,卢振民,张爱民,余文发,连 荣,史海旭,李 靖,王慧敏,袁东杰
(新乡医学院第一附属医院耳鼻咽喉科,河南 卫辉 453100)
鼻咽癌是一种地方性高发的鼻咽部鳞状上皮癌,常发生在鼻咽部顶壁和咽隐窝。主要治疗方法是放射治疗或放射治疗联合化学治疗,但对于晚期病灶、转移及局部复发患者的治疗效果很差,且不良反应重[1]。鼻咽癌的发生是包括环境因素、癌基因、抑癌基因、基因的易感性、埃-巴二氏病毒(Epstein-Barr virus,EBV)在内的多因素作用的结果。因此,阐明鼻咽癌发生的分子机制及寻找新的治疗靶点是该病治疗的关键。趋化因子受体4(chemine receptor 4,CXCR4)是基质细胞衍生因子1唯一的趋化因子受体,参与各种生理及病理过程[2]。近年来研究显示,乳腺癌、胰腺癌、肝癌等多种肿瘤中CXCR4高表达,其表达与肿瘤细胞的播散、正常细胞的恶性转化及肿瘤细胞的非随机转移等有关[3-5]。也有研究指出,鼻咽癌中CXCR4也有高表达,其表达与鼻咽癌转移有关[6]。本研究拟采用RNA干扰技术,通过靶向沉默人鼻咽癌细胞系CNE-2Z中CXCR4基因的表达,观察其对鼻咽癌细胞增殖、侵袭的影响,并进一步研究其作用机制。
1 资料与方法
1.1一般资料收集新乡医学院第一附属医院2014年1月至2016年12月保存的鼻咽癌及相应的癌旁组织各42例,男28例,女14例,年龄19~85(42.2±12.1)岁。鼻咽癌患者经病理证实均为鼻咽部低分化鳞癌,均未接受任何治疗,且为首次确诊,所有样本的实验均经过医院伦理委员会审查。
1.2试剂和仪器人鼻咽癌细胞系CNE-2Z购自广州吉妮欧生物科技有限公司,胎牛血清、RPMI-1640培养基购于美国Hyclone公司,Transwell小室购自美国Corning公司,细胞计数试剂盒 (cell counting kit-8,CCK-8)和二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自江苏碧云天生物技术研究所,LipofectamineTM2000试剂盒购自美国Invitrogen公司,基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9、β-连环蛋白(β-catenin)、细胞周期素D1(Cyclin D1)抗体均购自美国Abcam公司;多功能酶标仪(Synergy HT)购自美国Bio-Tec公司,流式细胞仪购自美国Becton Dickinson公司。
1.3实时荧光定量聚合酶链式反应(realtime-polymerasechainreaction,RT-PCR)检测鼻咽癌及癌旁组织中CXCR4mRNA表达参照Trizol试剂盒操作说明提取患者鼻咽癌组织和癌旁组织中的总RNA,反转录为cDNA,参照GenBank中的基因序列,利用Primer Premier 6.0引物设计软件设计目的基因CXCR4及内参基因磷酸甘油醛脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的RT-PCR引物,送上海生工生物工程有限公司合成。CXCR4引物序列:上游为5′-TGGCCTTATCCTGCCTGGTAT-3′,下游为5′-GGAGTCGATGCTGATCCCAAT-3′。内参GAPDH引物序列:上游为5′-GAAGGTGAAGGTCGGAGTC-3′,下游为5′-GAAGATGGTGATGGGAT-TTC-3′。定量PCR扩增条件:95 ℃ 2 min;95 ℃ 30 s;55 ℃ 30 s,72 ℃ 60 s,以上共35个循环。72 ℃ 延伸10 min,4 ℃保存。根据相对模板量2-ΔΔCt计算CXCR4 mRNA相对表达量。
1.4细胞转染人鼻咽癌细胞系CNE-2Z在37 ℃,95%湿度,含体积分数5% CO2培养箱中用含体积分数10%胎牛血清的RPMI-1640细胞培养基培养。收集对数生长期的细胞,以1.0×108L-1接种于6孔细胞培养板中,细胞生长至孔底面积达85%~90%时进行转染,分为空白对照组(细胞未做任何处理)、阴性对照组(细胞转染无义siRNA序列)和CXCR4转染组(细胞转染CXCR4的靶向siRNA序列)。具体操作按照LipofectamineTM2000试剂盒的操作说明进行。
1.5Westernblot法检测鼻咽癌组织、癌旁组织及各组细胞中CXCR4、MMP-2、MMP-9、β-catenin及CyclinD1蛋白表达用细胞裂解液分别处理鼻咽癌组织、癌旁组织和细胞中的蛋白,BCA试剂盒检测蛋白浓度,取50 μg上样蛋白至十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转移至硝酸纤维素膜,质量分数5%脱脂奶粉封闭,分别加入CXCR4、MMP-2、MMP-9、β-catenin、Cyclin D1(均按照1500稀释)和GAPDH(11 000稀释)一抗,4 ℃过夜,洗膜缓冲液(tris buffered saline tween,TBST)洗涤(3次×10 min),加入 15 000 稀释的辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG,37 ℃ 孵育1 h,洗膜后在暗室X片曝光1 min左右,显影、定影后成像拍照。
1.6CCK-8检测细胞增殖能力以1×107L-1浓度将对数生长的CNE-2Z细胞接种至96孔细胞培养板,每孔设置3个复孔,培养24 h进行同步化处理,分别于转染后48 h每孔细胞中加入CCK-8试剂 10 μL,培养箱孵育1 h。酶标仪测定450 nm的吸光度,重复3次。细胞增殖率 =(转染组细胞/对照组细胞)×100%。
1.7Transwell小室检测细胞侵袭能力4 ℃融化Matrigel胶,与RPMI-1640培养液按照14比例稀释,取50 μL稀释后的胶铺在Transwell小室上层。常温放置10~15 min风干,转染48 h的各组细胞以每孔1×104个细胞接种于Transwell小室的上层,下室中加入含体积分数10%胎牛血清的RPMI-1640培养基,培养18 h,洗涤,棉球轻轻擦掉上室内的细胞,甲醛固定30 min,结晶紫染色5 min,磷酸盐缓冲液冲洗,随机取不同的6个视野(×200)观察;并记录穿膜的细胞数,重复3次,求均值。
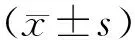
2 结果
2.1CXCR4mRNA和蛋白在鼻咽癌及癌旁组织中的表达结果见图1。鼻咽癌及相应的癌旁组织中CXCR4 mRNA表达分别为5.526±0.143、0.953±0.091,蛋白表达分别为0.522±0.047、0.053±0.011,鼻咽癌组织中CXCR4 mRNA及蛋白表达均显著高于癌旁组织,差异有统计学意义(P<0.05)。
A:CXCR4 mRNA表达;B:CXCR4蛋白表达。
图1CXCR4在鼻咽癌中的表达
Fig.1ExpressionofCXCR4inhumannasopharyngealcarcinomatissue
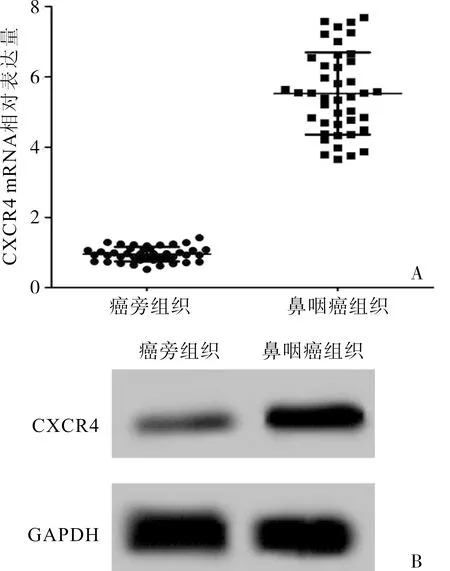
2.2转染CXCR4-siRNA后CNE-2Z细胞中CXCR4蛋白表达结果见图2。空白对照组、阴性对照组和CXCR4转染组细胞中CXCR4蛋白表达分别为0.383±0.031、0.369±0.029和0.037±0.010,CXCR4转染组细胞中CXCR4蛋白表达显著低于空白对照组和阴性对照组,差异有统计学意义(P<0.05),阴性对照组细胞中CXCR4蛋白表达与空白对照组比较差异无统计学意义(P>0.05)。
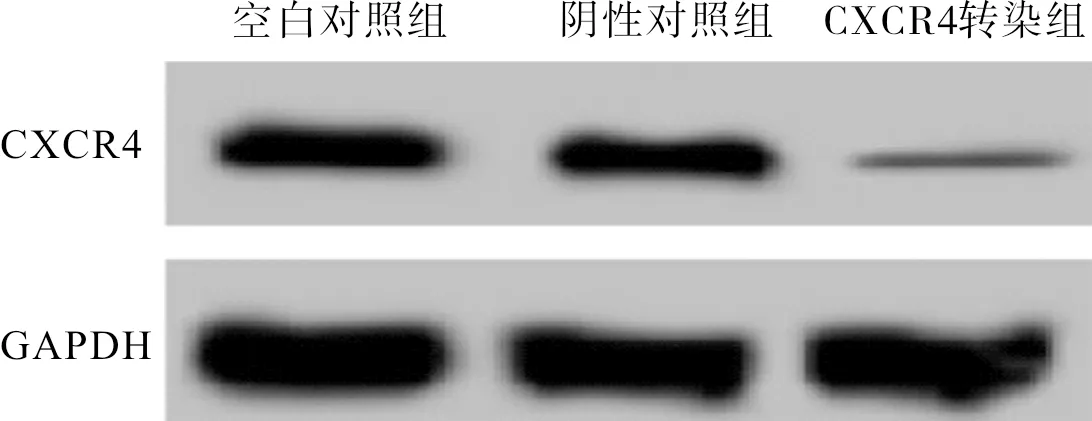
图2各组CNE-2Z细胞中CXCR4蛋白表达
Fig.2ExpressionofCXCR4proteininCNE-2Zcellsineachgroup
2.3各组细胞增殖能力比较空白对照组、阴性对照组和CXCR4转染组的细胞存活率分别为(95.62±3.23)%、(93.45±3.13)%和(61.18±4.44)%,CXCR4转染组细胞存活率显著低于空白对照组和阴性对照组,差异有统计学意义(P<0.05),阴性对照组细胞存活率与空白对照组比较差异无统计学意义(P>0.05)。
2.4各组细胞侵袭能力比较空白对照组、阴性对照组和CXCR4转染组细胞Transwell侵袭数分别为225±15、217±14和 102±12,MMP-2蛋白表达分别为0.475±0.042、0.498±0.041和0.223±0.027,MMP-9蛋白表达分别为0.481±0.036、0.462±0.034和0.330±0.010,CXCR4转染组细胞侵袭数、MMP-2和MMP-9蛋白表达均显著低于空白对照组和阴性对照组,差异有统计学意义(P<0.05),阴性对照组细胞侵袭数、MMP-2和MMP-9蛋白表达与空白对照组比较差异均无统计学意义(P>0.05)。MMP蛋白表达结果见图3。
图3各组CNE-2Z细胞中MMP-2和MMP-9蛋白表达
Fig.3ExpressionofMMP-2andMMP-9proteininCNE-2Zcellsineachgroup
2.5转染CXCR4-siRNA对Wnt/β-catenin信号通路中β-catenin和CyclinD1蛋白表达的影响结果见图4。空白对照组、阴性对照组和CXCR4转染组细胞中β-catenin蛋白表达分别为0.412±0.036、0.407±0.038和0.174±0.025,Cyclin D1蛋白表达分别为0.153±0.021、0.145±0.022和0.036±0.010,CXCR4转染组细胞中β-catenin和Cyclin D1蛋白表达均显著低于空白对照组和阴性对照组,差异有统计学意义(P<0.05),阴性对照组细胞中β-catenin和Cyclin D1蛋白表达与空白对照组比较差异均无统计学意义(P>0.05)。
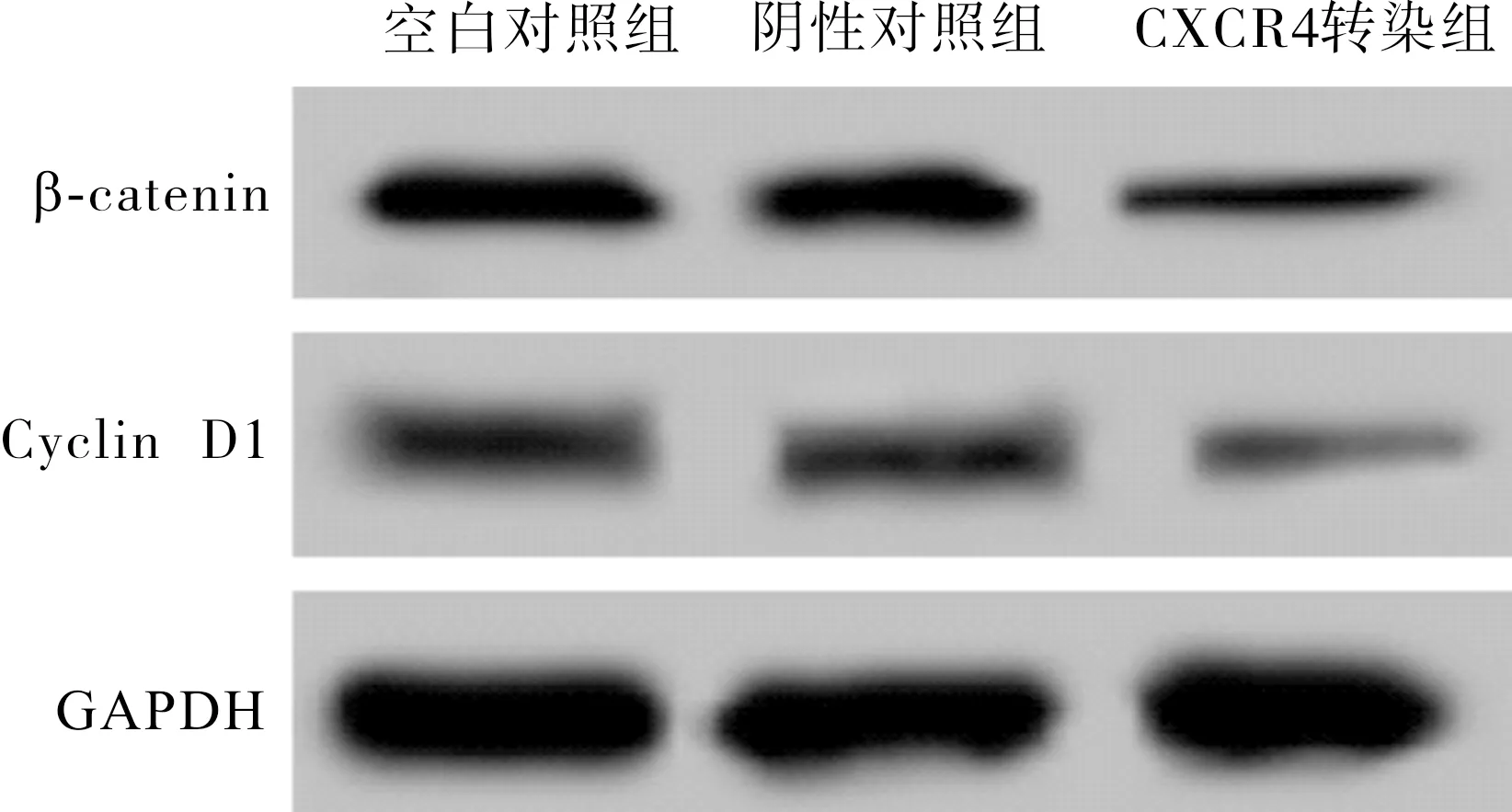
图4各组CNE-2Z细胞中β-catenin和CyclinD1蛋白表达
Fig.4Expressionofβ-cateninandCyclinD1proteininCNE-2Zcellsofeachgroup
3 讨论
趋化因子及其受体在大部分肿瘤中有表达,其表达影响肿瘤的发生、发展,因此,以趋化因子或其受体为靶点,通过抑制趋化因子受体的信号传导而调节趋化因子系统的功能对于恶性肿瘤的防治具有重要意义。研究显示,CXCR4是在组织中表达最广泛的细胞趋化因子受体之一,与其配体结合激活后可形成假伪足,影响多种恶性肿瘤的生长、侵袭、迁移[7]。在多种恶性肿瘤中有CXCR4基因的异常表达[8-9]。研究显示,抑制CXCR4基因的表达可显著降低卵巢癌、胃癌、肾癌等多种肿瘤细胞的增殖、侵袭及迁移能力[10-12]。CXCR4基因在鼻咽癌中也呈现高表达,其表达与鼻咽癌的转移、放射治疗史有关,可作为判断鼻咽癌预后的指标[13]。但CXCR4对鼻咽癌侵袭及其机制研究尚未清楚。RNA干扰是由RNA介导的转录后沉默调控,具有高度的特异性和有效性,是研究基因功能有效的途径[14]。
肿瘤细胞的侵袭能力是恶性肿瘤的一个重要生物学特性,也是治疗失败的重要因素。恶性肿瘤细胞的侵袭是由多步骤、多阶段控制的复杂过程,其中细胞外基质降解是侵袭的关键。MMPs可降解细胞外基质及基膜中的大多数蛋白质,在肿瘤中由于其表达增强,促进细胞外基质降解,进而增强细胞的转移、侵袭能力[15-16]。MMP-2和MMP-9在MMPs家族中研究的较多,既往研究表明,鼻咽癌中MMP-2和MMP-9过表达与鼻咽癌的浸润生长、淋巴转移、不良预后等有关,抑制其表达可降低鼻咽癌细胞的侵袭和迁移能力[17-18]。本实验通过转染CXCR-4-siRNA抑制鼻嗯癌细胞中CXCR4 mRNA和蛋白水平,抑制了MMP-2和MMP-9的表达,显著降低了鼻咽癌细胞的侵袭能力,提示CXCR4基因在鼻咽癌的侵袭能力可能与其调控MMP-2和MMP-9密切相关。Wnt/β-catenin信号通路由Wnt蛋白、核内转录因子、跨膜受体胞质蛋白和下游的靶基因组成,是一条经典的Wnt信号通路,与肿瘤、衰老和退化、骨质疏松等疾病有关[19]。β-catenin是Wnt信号通路的核心原件,在细胞膜及细胞质中均有分布,当有Wnt信号刺激时,可导致β-catenin的大量聚集并进入细胞核,最终激活和启动下游的Cyclin D1、c-myc基因的表达,从而影响肿瘤的发生、发展。既往研究认为,抑制Wnt/β-catenin信号通路可降低人鼻咽癌细胞的增殖、侵袭,促进细胞的凋亡能力[20]。本研究结果提示,抑制CXCR4表达后β-catenin、Cyclin D1蛋白表达水平显著降低,同时鼻咽癌细胞的增殖和侵袭能力也对应降低。因此,CXCR4基因可能通过Wnt/β-catenin信号通路参与到鼻咽癌细胞的恶性增殖和侵袭能力的调控;另外,本研究也观察到鼻咽癌细胞的恶性侵袭能力与MMP-2和MMP-9表达相关,但其具体调控方式和机制仍需进一步探讨。
综上所述,抑制鼻咽癌CXCR4表达可通过下调Wnt/β-catenin信号通路来降低鼻咽癌细胞的增殖及侵袭能力。CXCR4基因可能成为鼻咽癌检测的一个重要指标及作为分子治疗的潜在靶点,但其作用机制仍需进一步深入研究。
[1] BLANCHARD P,LEE A,MARGUET S,etal.Chemotherapy and radiotherapy in nasopharyngeal carcinoma:an update of the MAC-NPC meta-analysis[J].LancetOncol,2015,16(6):645-655.
[2] QIN L,KUFAREVA I,HOLDEN L G,etal.Crystal structure of the chemokine receptor CXCR4 in complex with a viral chemokine[J].Science,2015,347(6226):1117-1122.
[3] YI T,ZHAI B,YU Y,etal.Quantitative phosphoproteomic analysis reveals system-wide signaling pathways downstream of SDF-1/CXCR4 in breast cancer stem cells[J].ProcNatlAcadSciUSA,2014,111(21):E2182-E2190.
[4] 李鹏,刘冰,王志向,等.肾癌转移相关基因 CXC趋化因子受体4核定位信号的结构分析与功能鉴定[J].新乡医学院学报,2017,34(2):86-89.
[5] LIU J Y,CHIANG T,LIU C H,etal.Delivery of siRNA using CXCR4-targeted nanoparticles modulates tumor microenvironment and achieves a potent antitumor response in liver cancer[J].MolTher,2015,23(11):1772-1782.
[6] LU J,LUO H,LIU X,etal.miRNA-9 targets CXCR4 and functions as a potential tumor suppressor in nasopharyngeal carcinoma[J].Carcinogenesis,2013,35(3):554-563.
[7] TREON S P,CAO Y,XU L,etal.Somatic mutations in MYD88 and CXCR4 are determinants of clinical presentation and overall survival in Waldenström macroglobulinemia[J].Blood,2014,123(18):2791-2796.
[8] CHEN Y,RAMJIAWAN R R,REIBERGER T,etal.CXCR4 inhibition in tumor microenvironment facilitates anti-programmed death receptor-1 immunotherapy in sorafenib-treated hepatocellular carcinoma in mice[J].Hepatology,2015,61(5):1591-1602.
[9] GRAVINA G L,MANCINI A,MUZI P,etal.CXCR4 pharmacogical inhibition reduces bone and soft tissue metastatic burden by affecting tumor growth and tumorigenic potential in prostate cancer preclinical models[J].Prostate,2015,75(12):1227-1246.
[10] LIU W,WANG Y,WANG H,etal.Anticancer effects of chemokine receptor 4 (CXCR4) gene silenced by CXCR4-siRNA in nude mice model of ovarian cancer[J].CellBiochemBiophys,2014,70(3):1893-1900.
[11] KINOSHITA H,YASHIRO M,FUKUOKA T,etal.Diffuse-type gastric cancer cells switch their driver pathways from FGFR2 signaling to SDF1/CXCR4 axis in hypoxic tumor microenvironments[J].Carcinogenesis,2015,36(12):1511-1520.
[12] TANG B,TANG F,LI Y,etal.Clinicopathological significance of CXCR4 expression in renal cell carcinoma:a meta-analysis[J].AnnSurgOncol,2015,22(3):1026-1031.
[13] TAO H,WEI Y,WANG C,etal.Expression of chemokine receptor CXCR4 is closely correlated with clinical outcome in human nasopharyngeal carcinoma[J].TumourBiol,2016,37(5):6099-6105.
[14] DENG Y,WANG C C,CHOY K W,etal.Therapeutic potentials of gene silencing by RNA interference:principles,challenges,and new strategies[J].Gene,2014,538(2):217-227.
[15] 毛治尉,李巧玲,王平,等.曲美他嗪对慢性心力衰竭患者心功能和血清MMP-9,TIMP-1的影响[J].中国老年学杂志,2015,35(10):2817-2819.
[16] MERDAD A,KARIM S,SCHULTEN H J,etal.Expression of matrix metalloproteinases (MMPs) in primary human breast cancer:MMP-9 as a potential biomarker for cancer invasion and metastasis[J].AnticancerRes,2014,34(3):1355-1366.
[17] SUN W,LIU D B,LI W W,etal.Interleukin-6 promotes the migration and invasion of nasopharyngeal carcinoma cell lines and upregulates the expression of MMP-2 and MMP-9[J].IntJOncol,2014,44(5):1551-1560.
[18] ZERGOUN A A,ZEBBOUDJ A,SELLAM S L,etal.IL-6/NOS2 inflammatory signals regulate MMP-9 and MMP-2 activity and disease outcome in nasopharyngeal carcinoma patients[J].TumourBiol,2016,37(3):3505-3514.
[19] HUANG J,XIAO D,LI G,etal.EphA2 promotes epithelial-mesenchymal transition through the Wnt/β-catenin pathway in gastric cancer cells[J].Oncogene,2014,33(21):2737-2747.
[20] WU D,ZHANG Y,HUANG J,etal.Salinomycin inhibits proliferation and induces apoptosis of human nasopharyngeal carcinoma cellinvitroand suppresses tumor growthinvivo[J].BiochemBiophysResCommun,2014,443(2):712-717.
