落新妇苷对抑郁症小鼠脑内单胺递质多巴胺和5-羟色胺水平的影响
2018-01-18马丽娟关圆圆刘巨源
马丽娟,赵 媛,关圆圆,贾 杰,刘巨源
(新乡医学院三全学院药学院,河南 新乡 453003)
近年来,随着对天然黄酮类化合物研究的逐渐加深,发现黄酮类化合物在保护神经功能领域中表现出巨大的研究价值与前景[1]。菝葜属植物中含有丰富的落新妇苷(astilbin,AST),属于天然黄酮类化合物,抗抑郁中药贯叶金丝桃中也检测出该成分[2]。现代药理学证实,AST在利尿、抗氧化、抗病毒、抗炎、镇痛、抗菌、缓解心肌细胞缺血再灌注损伤、抗肿瘤等方面具有显著的作用[3-6]。而对AST抗抑郁的疗效报道甚少,本研究旨在探讨AST对抑郁症小鼠的抗抑郁作用,并分析其可能的作用机制。
1 材料与方法
1.1实验动物雄性成年C57BL/6J小鼠72只,体质量18~22 g,由郑州大学实验动物中心提供,饲养笼规格为320 cm×180 cm×160 cm,每笼喂养6只小鼠,饲养期间光照周期为12 h,光照时间为 07:00~19:00,温度23 ℃,实验前正常饮食、水,进行为期1周的环境适应性训练。所有动物实验操作严格遵守国际动物实验保护准则,尽量避免引起强烈的不适,减少实验误差。
1.2主要试剂与仪器AST (>98%)购自美国Bellancom Chemistry公司。5-羟色胺(5-hydrox ytryptamine,5-HT)标准品、丙米嗪(imipramine,IMI)、多巴胺(dopamine,DA)标准品购自美国Sigma公司。Prostar 210高效液相色谱(high performance liquid chromatography,HPLC)仪购自美国Varian 公司;TGL-16G-A高速冷冻离心机购自上海安亭科学仪器厂;-40 ℃ DW-FL270超低恒温冷冻储存箱购自中科美菱低温科技公司。
1.3实验方法
1.3.1动物分组与处理AST先用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,作为本次AST标准品的储备液,使用前储备液均采用医用生理盐水注射液稀释至所需浓度,浓度控制为本实验用标准浓度。采用随机数字表法将动物分成6组,每组12只。对照组小鼠不给予刺激,常规饲养,其他5组小鼠每天给予慢性不可预见性应激(chronic unexpected mild stress,CUMS),连续3周,制备抑郁症小鼠模型,具体包括:(1)禁食24 h;(2)禁水24 h;(3)倾斜鼠笼30° 24 h;(4) 小鼠尾根部1 cm夹尾1 min;(5) 采用9.5 cm×3 cm固定器束缚2 h;(6) 17 ℃冷水连续浸泡5 min;(7) 40 ℃热水浸泡5 min;(8)昼夜交替。连续2 d不采用同种刺激,保证动物对刺激无预料性[7]。模型组小鼠每天按10 mL·kg-1的剂量腹腔注射生理盐水且进行CUMS刺激;IMI组小鼠每天按10 mL·kg-1的剂量腹腔注射IMI,同时进行CUMS刺激;AST低、中、高剂量组小鼠每天分别按10、20、40 mL·kg-1的剂量腹腔注射AST,同时进行CUMS刺激;连续3周。IMI、AST腹腔注射的给药浓度参照文献[8-9]。干预期间,各组小鼠每天给予敞箱实验(open field test,OFT),强迫游泳实验(forced swimming test,FST),小鼠悬尾实验(tail suspension test,TST),连续3周。
1.3.2OFT整个实验操作每天完成于早上 8:30~11:30,全程保证安静,且通过盲法测试。参照XIONG等[10]的研究并改进后进行敞箱实验。本次均为规格相同的木箱,规格为1 000 mm ×1 000 mm×400 mm,底部为25个正方形,上盖黑色木板,确保全程处于黑暗条件,并采用红色灯泡(50 W)照明,木箱中央方格内分别放入实验小鼠,保证活动自如。详细观察小鼠5 min内三爪以上跨入方格的水平运动次数及两前肢脱离地面超过 1 cm 的垂直运动次数。
1.3.3FST每天注射药物30 min后,将所有实验小鼠逐个放入直径20 cm,高15 cm玻璃圆筒内,水温24 ℃,强迫浸泡 6 min,记录小鼠2 min后持续不动时间。判断标准:小鼠仅将头部露出水面,漂浮状态(四肢静止),或动作缓慢保证不溺水为不动状态。2次实验期间及时换水,保证水温适当,测试之后每只小鼠均用干毛巾擦干,原笼返回。
1.3.4TST实验方法参照文献[11]。所有操作均在暗箱内进行,将小鼠头部朝下,保持倒立,将其距离尾巴尖端1 cm处通过胶带固定于距地平面 35 cm 的横杆,维持6 min,适应1 min后记录各组小鼠的持续不动时间。判断标准:小鼠停止挣扎活动,除胡须轻微的晃动以及呼吸运动外,全程呈绝望状态[12]。
1.3.5SPT实验方法参照文献[13]。各组小鼠在实验前均单笼喂养,正常进食2 d,自由饮水,均给予0.03 mol·L-1蔗糖溶液及普通纯净水,饲喂期间每天2次调整水瓶位置,防止小鼠习惯性采食。然后各组小鼠均禁食、水24 h。次日上午09:00将0.03 mol·L-1蔗糖溶液100 mL 及相同规格的纯净水瓶放回原笼,所有小鼠自由饮水1 h后取下,测量2瓶液体的消耗量,糖水偏嗜度计算方法:糖水偏嗜度(%)=糖水消耗/总液体消耗×100%。
1.3.6HPLC法测各组小鼠前额叶皮层中5-HT和DA的水平参照MOSTALAC-PRECIADO等[14]方法,样品溶液置于-80 ℃的恒温冰箱保存,颈椎脱臼法处死小鼠取出前额叶皮层并测质量,添加为前额叶皮层脑质量3倍的0.1 mol·L-1高氯酸溶液,在冰上研磨成匀浆,将其匀浆提取液0 ℃ 10 000 r·min-1离心30 min,通过0.45 μm的水系滤膜对上清液过滤。标准溶液:配制含有高氯酸溶液(0.1 mol·L-1)及偏重亚硫酸钠(0.004 mol·L-1)的DA和5-HT的标准品溶液。采用等浓度梯度方法配制标准品,DA标准品溶液浓度分别为1.000 0、0.500 0、0.250 0、0.125 0、0.062 5 mg·L-1;5-HT标准品溶液浓度分别为0.500 0、0.250 0、0.125 0、0.062 5、0.031 2 mg·L-1。将5-HT和DA标准溶液按浓度由高到低依次混合取样,检测5-HT (0.5 mg·L-1)和DA (1.0 mg·L-1)混合标准的HPLC色谱图。各组小鼠样品依次进样,检测各组小鼠前额叶皮层HPLC色谱图。进样量:体积:20 μL,色谱柱:4.6 mm × 250 mm,5 μm的Varian C18柱,流动相:含1-辛烷磺酸钠(0.005 mol·L-1)的磷酸二氢钠(0.02 mol·L-1)溶液,采用pH 3.3的磷酸,再加上甲醇(34%)与纯净水按152的比例配制成的溶液,过滤、脱气用有机系滤膜厚度为0.45 μm,流速设置为1 mL·min-1,进行梯度洗脱。荧光检测器发射波长λem为360 nm、激发波长λex为280 nm,柱温保持26 ℃。最后以峰面积Y为纵坐标,标准品进样浓度X为横坐标(mg·L-1)绘制标准曲线,采用线性回归分析计算各组小鼠前额叶皮层中DA和5-HT水平。
2 结果
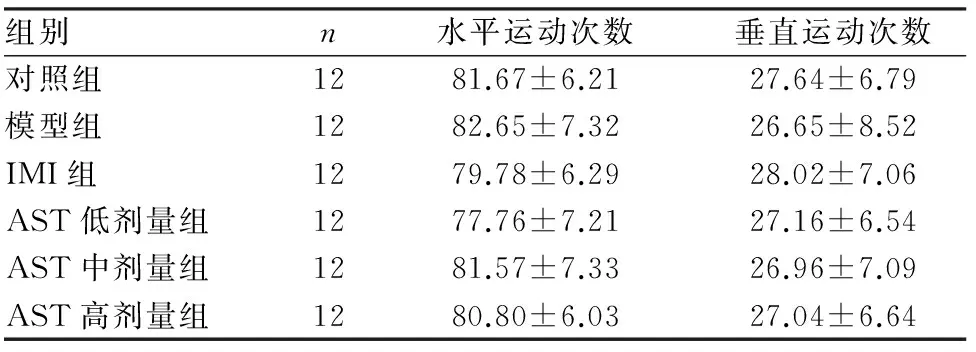
2.1AST对小鼠自发活动的影响结果见表1。持续3周给药后,对照组、模型组、IMI组及AST低、中、高剂量组小鼠的水平运动次数和垂直运动次数两两比较差异均无统计学意义 (P>0.05)。
表1AST对敞箱实验中小鼠自主活动的影响
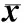
2.2各组小鼠FST、TST及SPT结果比较结果见表2。与对照组比较,模型组小鼠FST和TST持续不动时间显著增加,糖水偏嗜度显著降低,差异有统计学意义(P<0.05)。与模型组小鼠,AST低、中、高剂量组和IMI组小鼠FST和TST持续不动时间显著减少,糖水偏嗜度显著升高,差异有统计学意义(P<0.05)。AST低、中、高剂量组小鼠FST和TST持续不动时间及糖水偏嗜度两两比较差异均无统计学意义(P>0.05)。AST低、中、高剂量组小鼠FST和TST持续不动时间及糖水偏嗜度与IMI组和对照组比较差异均无统计学意义(P>0.05)。
表2各组小鼠FST和TST持续不动时间及糖水偏嗜度比较

注:与对照组比较aP<0.05;与模型组比较bP<0.01。
2.3各组小鼠前额叶皮层5-HT及DA水平比较结果见表3。与对照组比较,模型组小鼠前额叶皮层DA和5-HT水平显著降低(P<0.01)。AST低、中、高剂量组和IMI组小鼠前额叶皮层DA水平均显著高于模型组,差异有统计学意义(P<0.01)。AST中、高剂量组和IMI组小鼠前额叶皮层5-HT水平均显著高于模型组,差异有统计学意义(P<0.01),AST低剂量组小鼠前额叶皮层5-HT水平与模型组比较差异无统计学意义(P>0.05)。
表3各组小鼠前额叶皮层内DA和5-HT水平比较

注:与对照组比较aP<0.01;与模型组比较bP<0.01。
3 讨论
医学研究中啮齿类动物CUMS抑郁模型运用广泛,这一模型与人类抑郁症患者主要症状具有极高的相似性。本实验建立抑郁症小鼠模型,连续干预3周,结果表明,AST可拮抗慢性应激所致的小鼠FST、TST持续不动时间延长和糖水偏嗜度的降低,作用与IMI相似。
动物实验中,评价动物对新环境的探索能力以及自主活动程度常用敞箱实验,对动物的好奇心与兴奋性研究具有十分重要的作用。实验表明,部分中枢兴奋药对动物在敞箱实验中垂直移动、水平移动具有增强作用,也降低强迫游泳实验不动的时间,但这类药物对抑郁症无明显疗效[15]。为了减少实验的干扰因素,本研究敞箱实验测试还包含了对照组小鼠,结果显示,AST各剂量组和IMI组小鼠水平运动和垂直运动次数与模型组比较差异无统计学意义,证实AST对小鼠在中枢神经系统中未表现出兴奋作用。
FST和TST常作为评价药物潜在抗抑郁活性的经典行为学指标[16-17]。本实验中,模型组小鼠在FST和TST实验中的持续不动时间明显延长,这表明动物模型建立成功。而对抑郁症模型小鼠为期3周干预发现,在FST、TST实验中,AST能降低抑郁症小鼠持续不动时间,作用与IMI作用相似,这更加证明了AST具有抗抑郁活性。
小鼠经CUMS诱导能出现与人类相似的快感缺失症状[18]。抑郁症模型小鼠连续给药3周后各组小鼠的快感缺失状态可利用SPT检测,具有严密的科学根据,是学术界认可的衡量快感缺失的指标。本研究结果发现,小鼠经CUMS诱导对糖水的偏嗜度降低,与以往研究结果[19]保持一致,而由低到高剂量注射AST后对这一症状具有逆转作用,但剂量依赖关系尚不明显,因此,还需进一步研究探讨。小鼠降低了对糖水的偏嗜度也能证明小鼠经CUMS诱导能出现抑郁样症状,进一步证实了AST具有潜在的抗抑郁效应。
有研究认为,调控突触间单胺类神经递质是多种抗抑郁药的基本机制,包括临床常用的氟西汀及IMI等[20]。近来有报道认为,增加突触内DA和5-HT水平可通过黄酮类化合物抑制单胺氧化酶的活性以及生物胺的重吸收完成,以达到发挥抗抑郁作用的目的[21-22]。本实验中发现,AST低、中、高剂量组小鼠前额叶皮层DA水平显著升高;且20、40 mg·kg-1AST亦可提高小鼠前额叶皮层5-HT水平。本实验结果证实,抑郁症小鼠使用AST能增加前额叶皮层中DA和5-HT水平,但其影响5-HT、DA等单胺类神经递质产生抗抑郁作用的详细机制尚不清楚。
综上所述,AST对抑郁症模型小鼠具有显著的抗抑郁作用,上调前额叶皮层内DA和5-HT水平可能是其作用机制之一。
[1] MADHYASTHA S,SEKHAR S,RAO G.Resveratrol improves postnatal hippocampal neurogenesis and brain derived neurotrophic factor in prenatally stressed rats[J].IntJDevNeurosci,2013,31(7):580-585.
[2] 徐立,魏翠娥,赵明波,等.贯叶金丝桃总黄酮对小鼠抑郁症模型的试验研究[J].中国中药杂志,2005,30(15):1184-1188.
[3] NAQINEZHAD A,NABAVI S M,NABAVI S F,etal.Antioxidant and antihemolytic activities of flavonoid rich fractions of artemisia tschernieviana besser[J].EurRevMedPharmacolSci,2012,16 Suppl 3:88-94.
[4] HARADA S,TOMINARI T,MATSUMOTO C,etal.Nobiletin,a polymethoxy flavonoid,suppresses bone resorption by inhibiting NFkappaB-dependent prostaglandin E synthesis in osteoblasts and prevents bone loss due to estrogen deficiency[J].JPharmacolSci,2011,115(1):89-93.
[5] PETACCI F,FREITAS S S,BRUNETTI I L,etal.Inhibition of peroxidase activity and scavenging of reactive oxygen species by astilbin isolated from Dimorphandra mollis (Fabaceae,Caesalpinioideae)[J].BiolRes,2010,43(1):63-74.
[6] MOULARI B,PELLEQUER Y,LBOUTOUNNE H,etal.Isolation and in vitro antibacterial activity of astilbin,the bioactive flavanone from the leaves of Harungana madagascariensis Lam.ex Poir.(Hypericaceae)[J].JEthnopharmacol,2006,106(2):272-278.
[7] LUO J,ZHANG L,NING N,etal.Neotrofin reverses the effects of chronic unpredictable mild stress on behavior via regulating BDNF,PSD-95 and synaptophysin expression in rat[J].BehavBrainRes,2013,253C:48-53.
[8] FEI M,WU X,XU Q.Astilbin inhibits contact hypersensitivity through negative cytokine regulation distinct from cyclosporin A[J].JAllergyClinImmunol,2005,116(6):1350-1356.
[9] WANG J,ZHAO Y,XU Q.Astilbin prevents concanavalin A-induced liver injury by reducing TNF-alpha production and T lymphocytes adhesion[J].JPharmPharmacol,2004,56(4):495-502.
[10] XIONG Z,JIANG B,WU P F,etal.Antidepressant effects of a plant-derived flavonoid baicalein involving extracellular signal-regulated kinases cascade[J].BiolPharmBull,2011,34(2):253-259.
[11] GE J F,QI C C,ZHOU J N.Imbalance of leptin pathway and hypothalamus synaptic plasticity markers are associated with stress-induced depression in rats[J].BehavBrainRes,2013,249:38-43.
[12] MACHADO D G,BETTIO L E,CUNHA M P,etal.Antidepressant-like effect of the extract of Rosmarinus officinalis in mice:involvement of the monoaminergic system[J].ProgNeuropsychopharmacolBiolPsychiatry,2009,33(4):642-650.
[13] BOYKO M,KUTZ R,GRUENBAUM B F,etal.The influence of aging on poststroke depression using a rat model via middle cerebral artery occlusion[J].CognAffectBehavNeurosci,2013,13(4):847-859.
[14] MOSTALAC-PRECIADO C R,DE GORTARI P,LOPEZ-RUBALCAVA C.Antidepressant-like effects of mineralocorticoid but not glucocorticoid antagonists in the lateral septum:interactions with the serotonergic system[J].BehavBrainRes,2011,223(1):88-98.
[15] SHIRAYAMA Y,CHAKI S.Neurochemistry of the nucleus accumbens and its relevance to depression and antidepressant action in rodents[J].CurrentNeuropharmacology,2006,4(4):277-291.
[16] CTYAN J F,SLATTERY D A.Animal models of mood disorders:recent developments[J].CurrOpinPsychiatry,2007,20(1):1-7.
[17] CRYAN J F,MOMBEREAU C,VAASSOUT A.The tail suspension test as a model for assessing antidepressant activity:review of pharmacological and genetic studies in mice[J].NeurosciBiobehavRev,2005,29(4/5):571-625.
[18] ELHWUEGI A S.Central monoamines and their role in major depression[J].ProgNeuropsychopharmacolBiolPsychiatry,2004,28(3):435-451.
[19] HONG M,ZHENG J,DING Z Y,etal.Imbalance between Th17 and Treg cells may play an important role in the development of chronic unpredictable mild stress-induced depression in mice[J].Neuroimmunomodulation,2013,20(1):39-50.
[20] LOPEZ-MUNOZ F,ALAMO C.Monoaminergic neurotransmission:the history of the discovery of antidepressants from 1950s until today[J].CurrPharmDes,2009,15(14):1563-1586.
[21] ROJAS P,SERRANO-GARCIA N,MEDINA-CAMPOS O N,etal.Antidepressant-like effect of a Ginkgo biloba extract (EGb761) in the mouse forced swimming test:role of oxidative stress[J].NeurochemInt,2011,59(5):628-636.
[22] KULKARNI S K,BHUTANI M K,BISHNOI M.Antidepressant activity of curcumin:involvement of serotonin and dopamine system[J].Psychopharmacology(Berl),2008,201(3):435-442.
