Na+和Ca2+浓度对魔芋葡甘聚糖与黄原胶凝胶动态流变特性的影响
2018-01-18傅玉颖沈亚丽陈国文李肖蒙倪俊杰
傅玉颖,沈亚丽,陈国文,王 美,李肖蒙,张 豪,倪俊杰
(1. 浙江工商大学食品与生物工程学院,杭州 310018;2. 浙江工商大学杭州商学院,杭州 310018)
0 引 言
魔芋葡甘聚糖(konjac glucomannan,KGM)是一种从天南星科魔芋块茎中提取的储备性多糖,其分子链由D-甘露糖(M)与 D-葡萄糖(G)以 β-1,4吡喃糖苷键连接而成[1],KGM 溶于水后在乙酰基的作用下形成有空隙的双螺旋结构[2],游离的糖链可以吸附大量水分,因此KGM的溶胀性能良好,增稠效果显著,在医药、食品、化工等领域都具有良好的开发应用前景[3-6]。
2种或2种以上特定的胶体复配使用具有协同作用,可以在保证凝胶/增稠效果的同时减少多糖添加量,这对降低生产成本具有重要意义。KGM由于来源广泛、增稠效果良好而得到大量研究应用,研究者发现KGM和黄原胶(xanthan gum,XG)、卡拉胶、刺槐豆胶、淀粉等均具有良好的协同效应[7-10]。XG 与半乳甘露糖/葡甘聚糖类多糖之间强烈的协同作用很早就已经引起众多研究学者关注及研究,但由于XG多种分子构象同时存在且易受环境影响,因而XG与KGM之间的协同机制仍处于探究阶段[11-16]。由于 KGM-XG复配凝胶具有良好的控释特性及生物相容性,因而近些年针对 KGM-XG复配凝胶体系的研究集中在对药物及天然活性物质包埋控释等方面[7,17]。
KGM-XG复配形成的凝胶是一种多相非均匀、亚稳态的体系,很多因素都会对凝胶体系的微结构及流变学性质产生影响。有报道提出 KGM-XG的添加量以及KGM-XG的复配比例均会对 KGM-XG复配凝胶的性质产生影响,其中KGM∶XG=3∶7质量比时所得到复配凝胶的凝胶强度最高,XG与KGM 的协同作用最强[9,18]。Sinead等[19]发现温度对KGM-XG复配凝胶的性质影响非常大,在95 ℃时制备后再冷却到20 ℃得到的KGM-XG复配凝胶比在20 ℃制备的凝胶具有更高的储存模量。这可能是由于 95 ℃大于 XG的 Tm(有序/无序转化温度),XG分子构象处于无序状态并与KGM的结合更为紧密,因而比常温下制备的KGM-XG复配凝胶性质更好[19]。许东颖等[20]研究表明随着pH值的增大,香兰素在KGM-XG中的累计释放率增加,因而表面环境 pH值也会改变KGM-XG复配凝胶之间的空间结构,降低对香兰素的包埋作用。
除上述因素外,盐离子的存在也会显著影响KGM-XG复配凝胶的流变学性质。由于 KGM 是非离子型多糖,KGM与XG之间通过氢键在XG的主侧链与KGM结合从而实现两者之间的协同作用,但XG是阴离子多糖,其分子构象会受到添加的盐离子的影响,因而进一步影响XG与KGM的结合。实际上已有报道指出盐离子可以调控具有半乳甘聚糖基团的刺槐豆胶与XG凝胶体系[21-22],研究者从稳态流变学及其他角度分析盐离子对KGM-XG复配凝胶的调控机制,但相比稳态流变学而言,动态流变学手段可以提供关于凝胶体系分子构象、空间结构及质构特征等方面信息,更接近工厂生产实际[9,23]。
动态流变学是研究聚合物在交变应力作用下产生变形行为的学科,可以定量表征聚合物的凝胶性质,并且建立聚合物分子或聚合物空间结构与宏观形态之间的联系。本文选取了具有代表性的一价盐离子Na+和二价盐离子Ca2+,从动态流变学角度探究盐离子对KGM-XG复配凝胶体系的调控机制,通过分析受到外力作用时,凝胶体系空间结构的变化,建立微结构与宏观性质之间的联系,以期为添加KGM-XG复配凝胶的产品提供从质构设计到工业生产等多方面的实践指导。
1 材料与方法
1.1 材料与仪器
魔芋葡甘聚糖(KGM,纯度98%,合肥博美生物科技有限责任公司);黄原胶(XG,生化试剂,上海伊卡试剂公司);氯化钠(分析纯,天津永大化学试剂有限公司);其他试剂均为分析纯。
安东帕旋转流变仪(型号:MCR302,奥地利安东帕有限公司)。
1.2 试验方法
1.2.1 样品制备
依据前期预试验结果,称取一定量的KGM与XG,按照质量比1∶1的质量比溶于预先加热至85 ℃的蒸馏水中,使其质量分数达到 0.3%,并以磁力搅拌器以1 000 r/min,85 ℃温度搅拌使两者充分混合,然后准确称取一定质量的NaCl和CaCl2并使其浓度分别达到1、3、5、10、15 mmol/L,置于磁力搅拌器以1 000 r/min恒温搅拌30 min,冷却至室温25 ℃形成凝胶。
1.2.2 复配凝胶应变扫描
利用安东帕MCR302旋转流变仪对1.2.1制备的样品进行测试,选择PP-50平板系统(直径 50 mm),设定间隙为1 mm,测量温度为25 ℃,应变扫描范围为0.01%~100%按对数方式递增,恒定频率1 Hz,记录样品储能模量G′随应变γ的变化。样品添加后需在边缘加入硅油防止水分蒸发,测试前需在平板上平衡5 min。
1.2.3 复配凝胶应力扫描
利用安东帕 MCR302旋转流变仪进行测试,选择PP-50平板系统(直径 50 mm),设定间隙为1 mm,设定测量温度25 ℃,应力扫描范围为1~150 Pa,按对数方式递增,记录样品应变随应力变化的情况。
1.2.4 复配凝胶频率扫描
利用安东帕 MCR302旋转流变仪进行测试,选择PP-50平板系统(直径50 mm),设定间隙为1 mm,测量温度25 ℃,频率扫描范围为0.1~100 rad/s。基于应变扫描的结果,为保证测量时所有样品在线性黏弹区(linear viscoelastic region,LVR)内,选用应变为 1%,记录样品储能模量 G′、损耗模量 G″和损耗因子(tanδ=G″/G′)随角速率ω的变化。样品添加后需在边缘加入硅油防止水分蒸发,测试前需在平板上平衡5 min。
1.2.5 复配凝胶温度扫描
利用安东帕 MCR302旋转流变仪进行测试,选择PP-50平板系统(直径50 mm),设定间隙为1 mm,选用应变1%,频率设为1 Hz,温度扫描范围为25~90 ℃,升温和降温速率为 1 ℃/min,记录升降温过程中样品储能模量 G′随温度的变化。样品添加后需在边缘加入硅油防止水分蒸发,测试前需在平板上平衡5 min。
1.2.6 复配凝胶蠕变-恢复测试
蠕变测试是指对测试样品施加恒定大小的应力作用,测定物体形变随时间的变化[24-26]。蠕变-恢复行为可以通过Burger模型来拟合,Burger四要素蠕变阶段的数学表达式为:
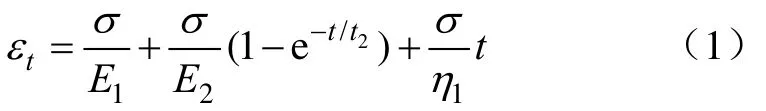
式中εt代表在t时刻KGM-XG复配凝胶的应变,σ(Pa)是施加的恒定大小的应力,E1(Pa)为胡克体瞬时弹性模量,η1(Pa·s)为阻尼体黏度(残余黏度),E2(Pa)是滞后弹性模量,t2(s)为蠕变时间暨形变达到最大形变量的(1-1/e)(约63%)时所用的时间。
恢复测试是紧接着蠕变测试的一个用于评估在撤去外加应力作用下,凝胶体系恢复应变的情况。
利用安东帕MCR302旋转流变仪进行流变测试,选择PP-50平板系统(直径50 mm),设定间隙为1 mm,测量温度25 ℃,以1 Pa的恒定应力持续319 s,然后撤去应力维持636 s,记录样品应变恢复数据。
1.3 数据处理
所有测试均平行3次,采用SPSS22软件对试验数据进行方差分析,采用Duncan’s法进行多重比较(P<0.05)。做图采用oringin 9.0软件,蠕变测试数据模型参数计算采用流变仪自带软件 RheoPlus Manual-V 2.0。
2 结果与分析
2.1 应变扫描结果
应变扫描可用于区分线性黏弹区以及对凝胶体系强弱判定等。线性黏弹区指的被测试样品的应力与应变呈线性变化的区域,只有在线性黏弹区的测量才可以获得物质的特性参数。
图1是添加不同浓度盐离子的KGM-XG复配凝胶应变扫描曲线。图1a展示了从0~15 mmol/L的Na+加入KGM-XG复配凝胶体系后,体系储能模量G′随应变的变化。从图中可知线性黏弹区为0.01%~30%,其临界应变值为30%。未添加Na+的凝胶体系的储能模量大于添加了Na+的凝胶体系,并且随着 Na+添加量的增加,G′一直呈下降趋势,说明Na+的加入会破坏原有的空间结构,使得体系的凝胶强度降低。添加10 mmol/L Na+的凝胶体系和添加有15 mmol/L Na+的凝胶体系具有相同的趋势,并且最终的储能模量也相近,可能表明了Na+与凝胶体系的相互作用达到最大值,进一步增加Na+添加量不会造成体系强度降低。
图1b是0~15 mmol/L的Ca2+添加后,体系储能模量随应变的变化趋势。与添加有Na+的凝胶体系类似,添加有Ca2+的凝胶体系线性黏弹区为0.01%~30%。Ca2+的添加同样会削弱凝胶体系的强度,与添加有Na+的凝胶体系相比,添加有 Ca2+的凝胶体系储能模量更低,这可能是跟Ca2+具有更高的价态有关。
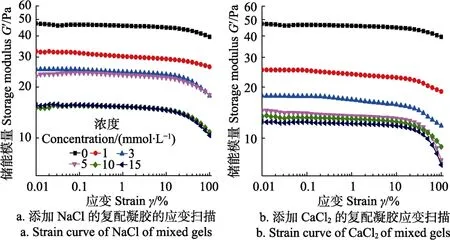
图1 添加不同浓度不同种类盐离子的KGM-XG复配凝胶的应变扫描曲线Fig.1 Strain curve of different concentration of saline ions added KGM and XG mixed gels
2.2 应力扫描结果
应力扫描不同于应变扫描,后者主要测量其线性黏弹区,而前者采用单向作用力测定凝胶体系的应力-应变曲线以及凝胶体系的临界破坏点。
图 2 是添加不同浓度盐离子的 KGM-XG复配凝胶应力-应变曲线。根据胡克定律Kσγ=(σ为应力,K为弹性系数,γ为应变),可知在应力一定的情况下,应变越大,而表征凝胶体系的弹性的K值越小。图2中随着添加盐离子浓度的上升,K值逐渐减小即是凝胶体系的弹性随着盐离子的添加逐渐减小。
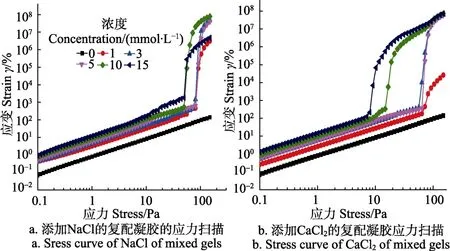
图2 添加不同浓度盐离子的KGM-XG复配凝胶应力扫描曲线Fig.2 Stress sweep curve of different concentration of saline ions added KGM and XG mixed gels
随着剪切应力的不断增加,添加Na+的凝胶体系的应变随着盐离子浓度的增加而增加,添加 Ca2+的复配凝胶也呈现出相似的趋势,但比添加有Na+的凝胶体系应变更大,这可能与Ca2+具有更高的价态有关。
2.3 频率扫描结果
频率扫描是通过测量储能模量G′与损耗模量G″随着角频率增加的变化情况来推测其材料特性,其中储能模量又称弹性模量,表征物质受力之后产生弹性形变的程度,损耗模量又称黏性模量,表示物料在受到外力作用下阻碍物体流动的特性。图3展示了添加不同浓度的Na+和Ca2+的KGM-XG复配凝胶体系的储能模量G′以及损耗因子tanδ随角频率ω的变化曲线。损耗因子tanδ是G″与 G′的比值,该比值越小表明复配体系的弹性越强,反之则说明黏性越强。
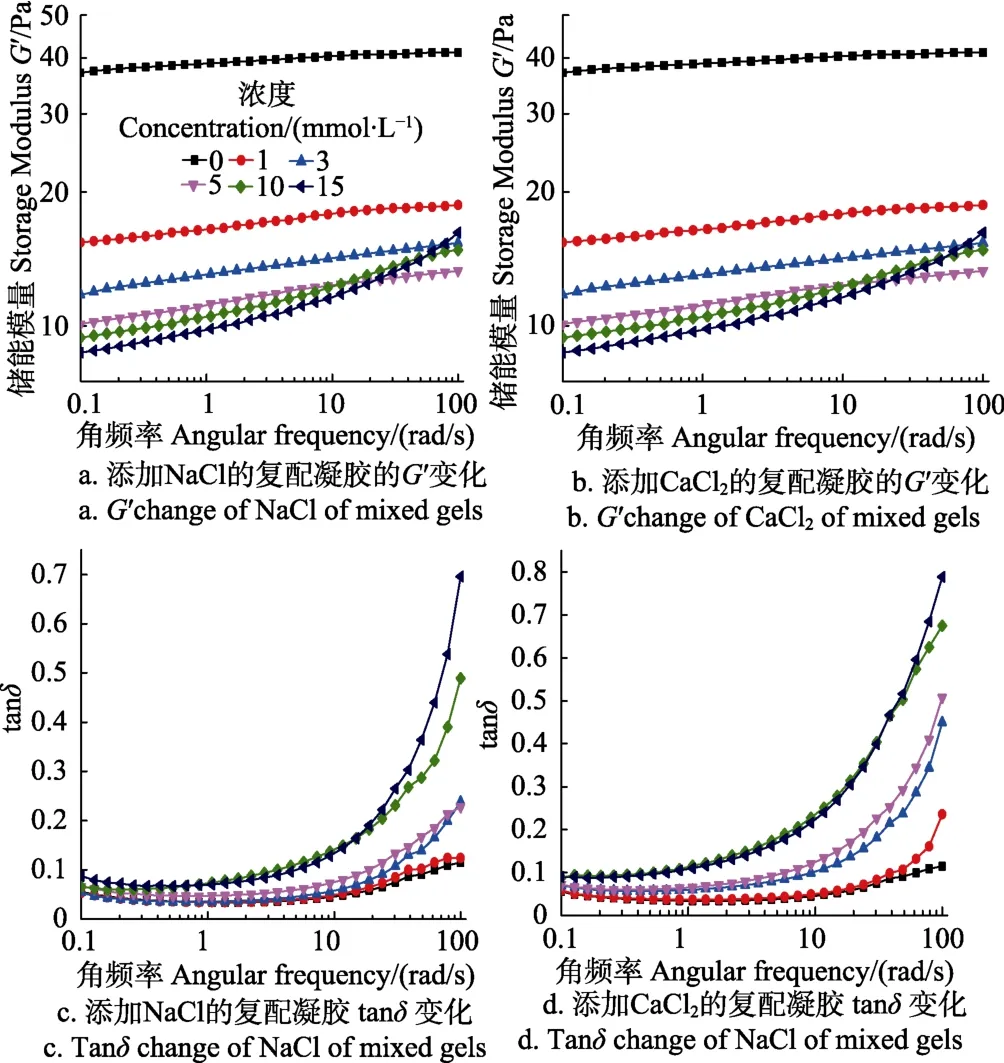
图3 添加不同浓度不同种类盐离子的KGM-XG复配凝胶的频率扫描曲线Fig.3 Frequency sweep curve of different concentration of saline ions added KGM and XG mixed gels
图3a是储能模量G′在不同Na+浓度情况下随角频率ω变化图,从图中可以看出,不添加 Na+的凝胶体系 G′值大大超过添加 Na+的凝胶体系 G′值,这与应变扫描中未添加Na+的凝胶体系的储能模量G′大于添加Na+的凝胶体系结果保持一致,说明盐离子对原有的空间网络结构具有破坏作用。图3a中还显示了随Na+浓度升高,凝胶体系的储能模量 G′值不断下降,表明凝胶体系的弹性特征不断损失。图3c显示了损耗因子tanδ随ω变化的情况,虽然损耗因子tanδ随着ω的增大不断增大,但是其数值仍小于1,表示凝胶体系虽然其弹性在不断减小,但是弹性固体的特征仍然占主导作用。有报道提出Na+的加入可以屏蔽掉XG主侧链上的静电排斥作用,从而使得XG主侧链得以交联,XG分子构象从无序向有序转化[27]。由于KGM一直是以无序状态存在于溶液中,并且是以氢键与XG相连接,所以当XG主侧链交联时,KGM与XG的结合位点减少,KGM与XG的结合程度迅速降低,减弱了KGM与XG之间的协同效应并导致了凝胶强度的降低。
图3b中,储能模量G′随着Ca2+浓度的不断增加也呈现出下降的趋势,图3d中,损耗因子对ω的依赖也在不断增加。添加Ca2+的凝胶体系弹性下降的原理与添加Na+出现的下降趋势相似,但也有不同之处,Ca2+作为二价离子,其屏蔽 XG主侧链静电斥力的能力更强,因而从图3b和图3d中反映出相同离子浓度时,添加Ca2+的凝胶体系储能模量值低于相同浓度时Na+添加时的储能模量。另外,当Ca2+浓度上升到10 mmol/L时,其储能模量G′有所回升,这应该与Ca2+作为二价离子可以促进 XG分子间交联,从而在一定程度上提高弹性特征的性质有关[28]。
未添加盐离子凝胶体系的储能模量值均大于添加了盐离子的凝胶体系,表明盐离子对KGM-XG复配凝胶体系的协同作用具有破坏作用。
2.4 温度扫描结果
材料学上将碳和铁按照不同比例、不同排列方式处理就可以得到具有不同属性的材料,相同的概率其实在凝胶研究体系中也适用。一个复合材料一旦形成,其必定具有一个相转化温度,对于凝胶体系而言,这个相转化温度就体现在凝胶-溶胶转化温度上。图4展示了添加有不同盐离子的总质量分数为0.3%的KGM-XG复配凝胶体系在 25~90 ℃测量温度范围内储能模量 G′的变化,而凝胶和溶胶转化温度则可以通过储能模量的改变观察到。
图4a和图4c反映的是添加Na+的复配凝胶体系在先升温后降温的过程中其储能模量G′变化的情况。以图4a为例,可以将储能模量G′随温度变化的曲线分为3部分:第一部分是温度低于30 ℃时,水分子在吸收热量后开始运动,并且具有带动KGM或是XG随之进行运动的趋势,但是由于KGM与XG之间的紧密缠绕,已有的热运动不足以解开KGM与XG之间的分子缠绕,因此储能模量在这一温度范围内保持稳定;随着温度的升高,KGM 与XG之间的分子交联不足以抵抗水分子的热运动,KGM与XG的空间网络状结构开始受到破坏,体系的弹性开始下降,储能模量不断降低;第三阶段时,温度大于43 ℃时,XG分子构象由有序变为无序,弹性降到最低趋于稳定。在图4c中,随着温度的降低,无序的XG分子开始向有序转变,在溶液中无序状态的KGM分子开始与XG以氢键形式交联稳定下来。在这个键被破坏与重建的过程中,溶胶-凝胶转化的温度随着 Na+的添加而呈现降低的趋势,Na+的加入使得KGM与XG复合形成的结构强度降低,相对低温度的热运动就可以使得形成的结构被破坏,其原理与Na+使得 XG主侧链得以交联从而减少与KGM结合密不可分[22,24]。
图4b和图4d所反映的趋势与图4a和图4c一致,而且在数值上,添加 Ca2+的复配凝胶的储能模量也一直低于添加Na+的,这与之前得到的结论一致。另外,Ca2+在15 mmol/L添加量时出现了回升,这应该与Ca2+促进XG形成分子间交联密不可分。
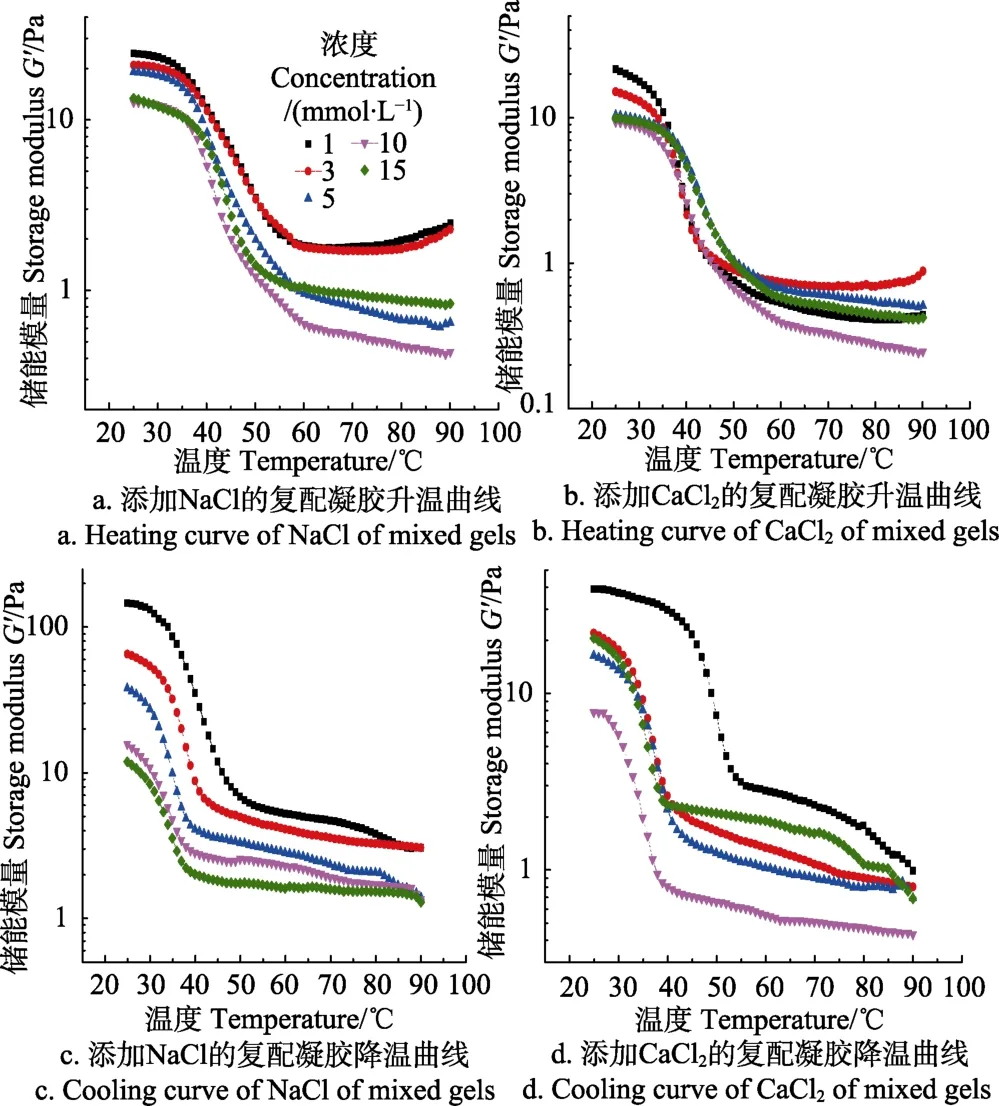
图4 添加不同浓度不同种类盐离子的KGM-XG复配凝胶G′值随温度变化的曲线Fig.4 Different concentration of saline ions of KGM and XG mixed gel’s curve of G′ with temperature
2.5 蠕变测试结果
根据Burger四要素模型蠕变方程拟合可得蠕变参数列在表1,根据拟合所求得的蠕变参数将添加不同盐离子浓度的蠕变曲线见图5。
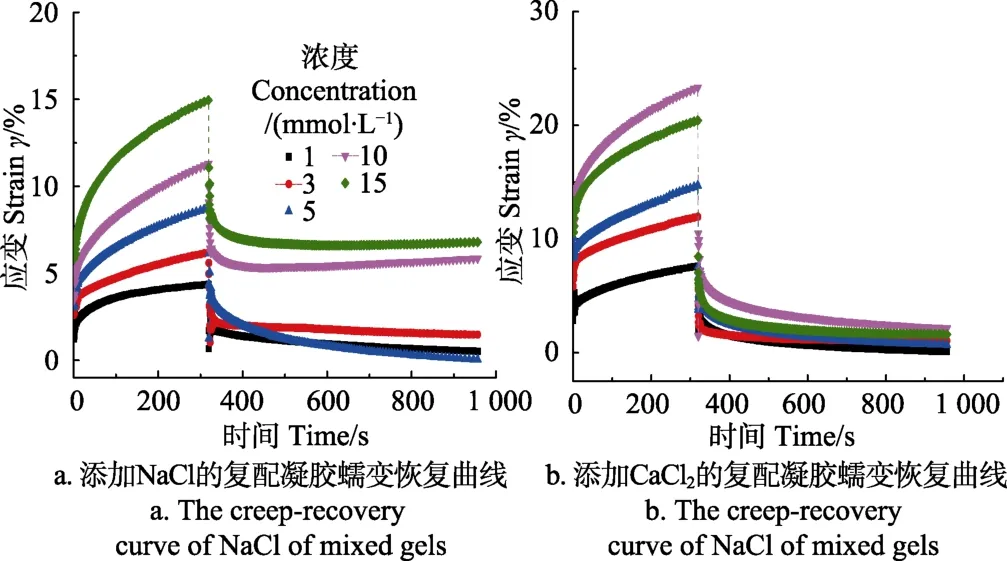
图5 添加不同浓度不同种类盐离子的KGM-XG复配凝胶蠕变恢复曲线(KGM∶XG质量比1∶1,质量分数0.3%)Fig.5 Creep-recovery curve of different concentration of saline ions added KGM and XG mixed gels (KGM∶XG mass ratio is 1∶1, mass fraction is 0.3%)
在表1中,代表胡克体受力瞬时弹性模量的E1是由在外力作用下分子链键长、键角变化引起的,是瞬时完成的,E1越大代表凝胶体系的初始弹性越大。随着 Na+浓度的增加,E1逐渐降低,在蠕变曲线图上可观察到曲线从0点上升至变缓处的应变值越来越大。E1的改变意味着凝胶体系中KGM或是XG的分子链键长或是键角的缩短,这与之前的分析结果相一致,Na+的加入屏蔽了XG分子链上由于乙酰基所引起的静电排斥,导致了XG分子侧链向主链靠拢交联,分子链键长的缩短。有报道显示[29],进一步提高Na+浓度,会使得胶体粒子的双电层被压缩、Zeta电位下降并进一步导致 XG分子的紧缩,这也与E1持续降低的趋势一致。Ca2+的加入也出现E1持续下降的现象。
η1作为阻尼体黏度,其值代表着初始黏度值,也表征着物料内部分子的联系是否紧密,η1越大则意味着分子链段之间的联系更紧密。在表 1中,η1随着 Na+或是Ca2+浓度的不断升高而减小表明凝胶体系中的分子链段的联系越松散,分子链之间的转移更为容易,层流内层的摩擦力在不断减小。
在恢复测试部分试验的结果也呈现在图 5中,KGM-XG复配凝胶在外加应力撤去后,其应变都随时间经先急剧下降,后缓慢下降至稳定的过程。其中急剧下降过程是黏弹体分子构象的改变,与时间呈指数关系,在图中则表示了KGM-XG分子链的舒张;而缓慢下降至稳定的过程反映临近分子链的相互运动,是凝胶体系黏性的体现。添加有Ca2+的复配凝胶呈现相似趋势。
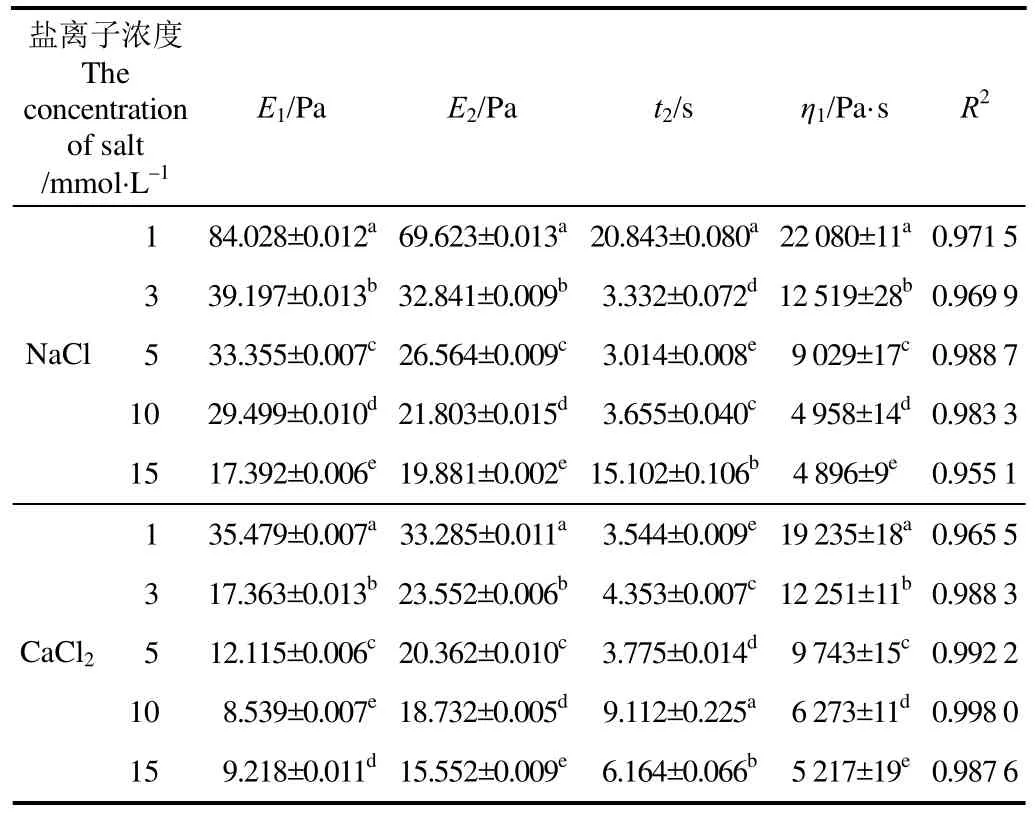
表1 蠕变-恢复测试中含有不同浓度盐离子的KGM-XG复配凝胶的Burger四要素模型参数Table1 Parameters of Burger’s model of different concentration of saline ions added KGM-XG mixed gels in creep-recovery test
3 结 论
本文分析了盐离子对魔芋葡甘聚糖-黄原胶(KGM-XG)复配凝胶体系的动态流变学性能的影响,研究得到以下结论:
1)应变扫描、应力扫描显示 KGM-XG复配凝胶体系线性黏弹区为0.01%~30%,临界剪切应变值为30%。盐离子浓度越高,对凝胶体系的破坏就越强。Ca2+相比Na+对凝胶体系的破坏更大,可能与它具有更高的价态有关。
2)频率扫描表明随盐离子浓度增加,凝胶体系储能模量G′不断下降且损耗因子tanδ对ω的依赖增强,表明凝胶体系的结构受到了破坏。钙离子在低浓度时降低了KGM-XG复配凝胶体系的凝胶强度,但在高浓度时又能在一定程度上提升凝胶强度。温度扫描显示复配凝胶的溶胶-凝胶转化温度不断降低。
3)蠕变-恢复测试通过定量关系揭示了在蠕变和恢复阶段KGM-XG复配凝胶体系所产生的弹性模量E1,阻尼体黏度η1等。E1的持续减小表明凝胶中的分子链结构不断减小,说明盐离子的添加确实缩短了XG或者KGM的分子链。阻尼体黏度η1的不断减小表明分子间的联系随离子强度增加而不断减弱。
通过盐离子调控 KGM-XG复配凝胶体系的动态流变学特性研究可以对 KGM 相关产品的加工特性及质构设计提供指导。为近一步促进魔芋在食品、医药、化工等产业的开发利用,对改性KGM与多糖的协同作用研究都具有较大意义。
[1] Fang W, Wu P. Variations of konjac glucomannan (kgm)from amorphophallus konjac and its refined powder in China[J]. Food Hydrocolloids, 2004, 18(1): 167-170.
[2] Bin L I, Xie B J. Study on gel formation mechanism of konjac glucomannan[J]. Journal of Integrative Agriculture,2003, 2(4): 424-428.
[3] Li B, Xie B J. Single molecular chain geometry of konjac glucomannan as a high quality dietary fiber in East Asia[J].Food Research International, 2006, 39(2): 127-132.
[4] Shi C, Pei Z, Na C, et al. Preparation and sustainable release of modified konjac glucomannan/chitosan nanospheres[J].International Journal of Biological Macromolecules, 2016,91(6) : 9-14.
[5] Wen X, Wang T, Wang Z, et al. Preparation of konjac glucomannan hydrogels as DNA-controlled release matrix[J].International Journal of Biological Macromolecules, 2008,42(3): 256-263.
[6] Shang X, Qin C, Niu W, et al. Studies and applications on konjac glucomannan as a new type of functional material[J].Materials Review, 2009, 23(19): 32-36.
[7] Alvarez-Mancenido F, Landin M, I, Martinez-Pacheco R.Konjac glucomannan and konjac glucomannan/xanthan gum mixtures as excipients for controlled drug delivery systems.Diffusion of small drugs[J]. Int J Pharm, 2008, 349(1-2):11.
[8] Charoenrein S, Tatirat O, Rengsutthi K, et al. Effect of konjac glucomannan on syneresis, textural properties and the microstructure of frozen rice starch gels[J]. Carbohydrate Polymers, 2011, 83(1): 291-296.
[9] Fan J, Wang K, Liu M, et al. In vitro evaluations of konjac glucomannan and xanthan gum mixture as the sustained release material of matrix tablet[J]. Carbohydrate Polymers,2008, 73(2): 241-247.
[10] Goycoolea F M, Richardson R K, Morris E R, et al.Stoichiometry and conformation of xanthan in synergistic gelation with locust bean gum or konjac glucomannan:evidence for heterotypic binding[J]. Macromolecules, 1995,28(24): 8308-8320.
[11] Abbaszadeh A, MacNaughtan W, Sworn G, et al. New insights into xanthan synergistic interactions with konjac glucomannan: A novel interaction mechanism proposal[J].Carbohydr Polymers, 2016(144):168-177.
[12] Brenner T, Tuvikene R, Fang Y, et al. Rheology of highly elasticiota-carrageenan/kappa-carrageenan/xanthan/konjac glucomannan gels[J]. Food Hydrocolloids, 2015(44): 136-144.
[13] Harding S E, Smith I H, Lawson C J, et al. Studies on macromolecular interactions in ternary mixtures of konjac glucomannan, xanthan gum and sodium alginate[J].Carbohydrate Polymers, 2011, 83(2): 329-338.
[14] Jin W, Song R, Xu W, et al. Analysis of deacetylated konjac glucomannan and xanthan gum phase separation by film forming[J]. Food Hydrocolloids, 2015(48): 320-326.
[15] Mao C F, Klinthong W, Zeng Y C, et al. On the interaction between konjac glucomannan and xanthan in mixed gels: an analysis based on the cascade model[J]. Carbohydrate Polymers, 2012, 89(1): 98-103.
[16] Saleh H M, Msm A, Simarani K. Ultrasound degradation of xanthan polymer in aqueous solution: Its scission mechanism and the effect of NaCl incorporation[J]. Ultrasonics Sonochemistry, 2017(39): 250-261.
[17] Alvarezmance Ido F, Landin M, Mart Nezpacheco R. Konjac glucomannan/xanthan gum enzyme sensitive binary mixtures for colonic drug delivery[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2008, 69(2): 573-581.
[18] 范江洋. 魔芋葡甘聚糖-黄原胶共混多糖作为释药载体的研究[D]. 天津:天津大学,2007.Fan Jiangyang. Study on Konjac Glucomannan-Xanthan Gum Polysaccharides Mixtures as Drug Delivery Carrier[D].Tianjin: Tianjin University, 2007. (in Chinese with English abstract)
[19] Sinead M Fitzsimons, John T Tobin, Edwin R Morris.Synergistic binding of konjac glucomannan to xanthan on mixing at room temperature[J]. Food Hydrocolloids, 2008 ,22(1): 36-46.
[20] 许东颖,王婴,孟巨光,等. pH敏感魔芋葡甘聚糖复合凝胶的制备及其缓释性能研究[J]. 日用化学工业,2014,44(11):631-634.Xu Dongyin, Wang Ying, Meng Juguang, et al. Preparation and controlled releasing behavior of pH-sensitive konjac glucomannan complex gel[J]. China Surfactant Detergent &Cosmetics, 2014,11(44),631-634.(in Chinese with English abstract)
[21] Casas J, Garc A-Ochoa F. Viscosity of solutions of xanthan/locust bean gum mixtures[J]. Journal of the Science of Food and Agriculture, 1999, 79(1): 25-31.
[22] Annable P, Williams P A, Nishinari K. Interaction in xanthan-glucomannan mixtures and the influence of electrolyte[J]. Youth Violence & Juvenile Justice, 2008, 6(2):178-194.
[23] Alvarez Mancenido F, Braeckmans K, De Smedt S C, et al.Characterization of diffusion of macromolecules in konjac glucomannan solutions and gels by fluorescence recovery after photobleaching technique[J]. Int J Pharm, 2006, 316(1-2): 37-46.
[24] Huang J, Zeng S, Xiong S, et al. Steady, dynamic, and creep-recovery rheological properties of myofibrillar protein from grass carp muscle[J]. Food Hydrocolloids, 2016(61):48-56.
[25] Rosalina I, Bhattacharya M. Dynamic rheological measurements and analysis of starch gels[J]. Carbohydrate Polymers, 2002, 48(2): 191-202.
[26] Yilmaz M T, Tatlisu N B, Toker O S, et al. Steady, dynamic and creep rheological analysis as a novel approach to detect honey adulteration by fructose and saccharose syrups:Correlations with HPLC-RID results[J]. Food Research International, 2014(64): 634-646.
[27] Higiro J, Herald T J S. Rheological study of xanthan and locust bean gum interaction in dilute solution[J]. Food Research International, 2006, 39(2): 165-175.
[28] 汤晓智,尹方平,扈战强,等. 乳清蛋白-大米淀粉混合体系动态流变学特性研究[J]. 中国粮油学报,2016,31(2):28-32.Tang Xiaozhi, Yin Fangping, Hu Zhanqiang, et al.Study on dynamic rheological properties of whey protein-rice starch hybrid system[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(2): 28-32. (in Chinese with English abstract)
[29] 庄远红,潘裕添,刘静娜,等. 盐离子对魔芋多糖-蛋白复配体系凝胶特性及色泽的影响[J]. 食品科学技术学报,2014,32(6):19-23.Zhuang Yuanhong, Pan Yutian, Liu Jingna, et al. Effects of salt ions on gel properties and color of konjac polysaccharide and soybean protein isolate complex systems[J]. Journal of Food Science and Technology, 2014, 32(6): 19-23. (in Chinese with English abstract)
