补肾化瘀方对多囊卵巢大鼠子宫内膜降钙素表达的影响※
2018-01-18侯丽莹邓丽玲杨正望胡齐欣余曦明
● 侯丽莹 邓丽玲 罗 佩 杨正望 熊 芬 胡齐欣 余曦明▲
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是一种极为复杂的疾病,涉及内分泌、生殖、代谢疾病等多个方面,随着其发病率的日益增加,越来越受到人们的重视。由于其稀发排卵或者无排卵、卵子质量差等多种因素导致不孕,困扰了大多数有生育期望的PCOS患者。既往对于PCOS患者不孕问题的研究主要重点在于如何促进排卵、降低雄激素水平,相关实验研究PCO大鼠也多集中在观察卵巢、外周血的变化。虽然取得了一定的疗效,但早期研究就已经发现,经过药物治疗、纠正不排卵的因素后,排卵率确实得到提升可达至80%,但最终妊娠率维持在40%~50%之间,失败率可高达50%[1]。随着研究的深入,越来越多的学者认为除了卵巢排卵方面的异常导致PCOS患者不孕,子宫内膜容受性降低也是其不孕和妊娠成功率较低的重要原因。子宫内膜发育及胚胎容受性障碍,是影响PCOS患者生育力低下,且妊娠结局不良的因素之一。因此,如何提高子宫内膜容受性成为妇产科相关的研究热点和重点之一。
PCOS的中医药治疗以补肾化瘀为主要目标进行攻关,既往实验研究发现补肾化瘀方对PCOS患者卵巢局部微环境有改善作用[2]。随着认识的深入,我们前期临床研究表明补肾化瘀方可提高着床期子宫内膜的容受性[3],而且研究表明CT参与子宫内膜容受性形成,且以多种机制参与胚胎着床[4]。为进一步探讨动物实验相关机制,本实验通过观察补肾化瘀方对子宫内膜CT表达的影响,进一步研究其可能改善子宫内膜容受性的作用机制。
1 材料与仪器
1.1动物选用21 d 健康雌性SD大鼠,SPF级,共100只,体量为(75±15)g,由湖南斯莱克景达实验动物有限公司提供,许可证号为SCXK(湘)2011-0003。饲养于湖南中医药大学动物实验中心SPF级动物实验室,许可证号为SYXK(湘)2013-0005。室温20~26℃,相对湿度为40%~60%,保持通风干燥,维持昼夜节律,每天光照10小时,架式分笼,常规颗粒饲料喂养,自由饮水。
1.2药物、试剂与仪器补肾化瘀方:紫石英15g,补骨脂8g,菟丝子8g,桑寄生8g,茺蔚子5g,泽兰8g,泽泻8g,土鳖虫8g,三七3g,覆盆子8g,莲子心3g,甘草3g,由湖南中医药大学第一附属医院提供。取生药85 g,浸泡于水中30 min,加热沸腾后小火微沸30 min,分取药液,滤渣再次加水煎30 min,两次药液合并,纱布过滤,置入水浴锅中,浓缩后药液浓度为生药含量0.9 g/ mL,分装无菌小瓶,4℃冰箱保存。
炔雌醇环丙孕酮片(商品名:达英-35)拜耳医药保健公司广州分公司提供,批准文号:国药准字J201401114,21片/盒,生产批号:20100003。 DHEA粉末:纯度99.16%,购自湖北芳通药业有限公司,生产批号为:20120518。注射用大豆油:购自苏州捷易龙贸易有限公司,生产批号:Y12080204-3-07。
托盘式天平(上海精密仪器仪表有限公司YPN60)、低温高速离心机(长沙平凡仪器仪表有限公司TD6-WS),恒温水浴锅(上海跃进医疗器械有限公司)、轮转石蜡切片机(德国LEIKA仪器有限公司RM2235)、脱水机及包埋机(武汉俊杰电子有限公司)、生物组织摊片机(浙江金华市金迪医疗设备厂金迪YD-A)、海尔电冰箱(青岛海尔股份有限公司BCD-226SKA)、电热恒温培养箱(上海新苗医疗器械制造商有限公司一恒DNP-9162)、扫描电子显微镜(日本日立公司)、离子溅射仪(日本日立公司)、冻干机(日本日立公司)、Motic BA410研究型显微镜(厦门麦克迪奥集团公司)、Motic Images Plus6.0计算机图像分析系统(厦门麦克迪奥集团公司)。
2 方法
2.1 PCO大鼠模型的制备与评价参照张晓薇、李燕等[5-6]造模方法,由于每天每只大鼠均需称量不等的DHEA单独配制不同浓度的注射液,在此基础上对DHEA注射液的配制进行调整,按DHEA6mg/(100g体重·d)+0.2mL注射油剂(大豆油)来换算,100g体重大鼠应配制注射液浓度为6mg/0.2mL,即30mg/mL,将此作为DHEA注射液的标准浓度,注射量按0.2mL/100g体重来计算,保持注射液浓度恒定,配制DHEA溶液酒精灯加热溶解均匀后,按不同大鼠重量抽吸不同体积的注射液。空白对照组30只,予颈背部皮下注射2mL/kg注射用大豆油剂,并轻轻揉按促进吸收。模型制备组70只予DHEA 0.06g/(kg·d)+0.2mL注射用大豆油剂,配制溶液方法如前所述,颈背部皮下注射,并轻轻揉按促进吸收,两组给药于每日上午十点同期进行。经测量,从23~43d,SD雌性大鼠体重约为60~210g,注射量在0.12~0.42mL之间浮动。定期观察摄食、毛发及精神、一般活动情况,注射10d后开始每天下午4时进行1次阴道脱落细胞学检查,用光滑吸管吸取少量生理盐水,冲入大鼠阴道内,吸取少量阴道液,涂于载玻片上直接光镜观察,观察其动情周期变化。依照文献中阴道脱落细胞学特征,确定动情周期,大鼠动情周期可分为前期、间期、动情期、后期,主要取决于白细胞和核上皮细胞的多少以及有无角化细胞的形成来判别,间期白细胞(大量)>后期(约1/3)>动情期(无),而前期主要为核上皮细胞,动情期角化细胞数目增多[7]。注射10d后每天下午4时进行1次阴道脱落细胞学检查,模型制备组镜下可见大量白细胞,动情间期时间变长,打破了周期的规律性,提示构建模型后,由于病理的改变影响到PCO大鼠,从而出现卵巢功能的异常,进一步表现为间期为主的变化;空白对照组可出现正常的周期次序。注射第20d当晚20时禁食,第21d晨起各组随机抽取10只大鼠,称重后颈椎脱臼法处死,颈动脉采血,抗凝采血管采集,离心后用移液器取上清液,用放免法检测血清激素LH、FSH、T、P、E2,按放免试剂盒说明操作,采血后解剖双侧卵巢,以卵巢最大平面作为待检平面石蜡包埋,HE染色后显微镜下观察卵巢形态学变化,判定造模是否成功。
2.2给药干预方法判定造模成功后,模型制备组大鼠按随机数字表法随机分为三组,分别是模型对照组、补肾化瘀方组、达英-35组各20只,加上空白对照组20只,共80只。补肾化瘀方组每日按时予补肾化瘀汤剂灌胃,1次/ d,给药剂量[8-9]按成人女性平均体重60kg体表面积换算,折合到大鼠用药剂量8.8 g/(kg·d),结合“1.2”所述中药汤剂浓度即10mL/(kg·d);达英-35组每天灌服达英-35溶液,人用药量为1片/d,折合大鼠约为0.101片/(kg·d),即0.00023g/(kg·d),将1片达英-35溶于100mL蒸馏水中,约为10mL/(kg·d);空白对照组以与模型对照组同等量的蒸馏水灌胃。连续灌胃21d,停药7d为1个周期,共给药3个周期。停药5天后按雌雄鼠1∶1的比例交配,次日清晨检查大鼠阴道栓,发现阴道栓日记为妊娠第1日。
2.3标本采集与指标测定妊娠第四天清晨以颈椎脱臼法处死大鼠,剖取大鼠子宫及双侧卵巢,将其表面脂肪去除干净后,均以4%多聚甲醛固定,卵巢HE染色后在显微镜下形态学观察。子宫内膜行免疫组化法检测CT表达。按照试剂盒说明书进行,工作浓度为1:100,以细胞质中有棕黄色或者棕褐色颗粒出现为阳性表达。切片置于400倍高倍镜下观察,每张切片随机选择观察5个高倍镜视野,对每张照片进行分析,采用Motic Images Plus 6.0计算机图像分析系统对结果进行分析,以切片背景的灰度值作背底校正,测定平均光密度值(average optical density,AOD)。

3 结果
3.1大鼠卵巢形态组织学空白对照组大鼠肉眼观见卵巢色泽较红润,HE染色光镜下可见多个处于不同生长层次的卵泡,且细胞排列整齐,多层次的变化,可多达8~9层。模型制备组大鼠肉眼观见卵巢表面苍白,包膜增厚,隐约可见扩张的囊泡,光镜下可见囊状卵泡,水泡样改变,空腔增大,卵泡内可见卵母细胞及放射冠消失,颗粒细胞层数减少,排列较为疏松,提示PCO大鼠卵巢组织结构病理改变与患者PCOS临床表现一致,结合“2.1”动情周期变化结果以动情间期为主,失去规律性,提示PCO大鼠模型造模成功。见图1。

A.空白对照组 B.模型制备组
3.2大鼠血清性激素水平比较造模后对两组血清性激素水平进行统计分析,单因素方差分析出的结果表明:空白对照组大鼠血清T水平明显低于模型制备组(P<0.01),E2水平高于模型制备组(P<0.01),两组在FSH、LH、P水平上结果提示无显著差异(P>0.05)。提示造模成功。见表1。

表1 两组大鼠血清性激素水平比较
注:与空白对照组比较,△P<0.01。
3.3各组大鼠子宫内膜CT表达的结果与空白对照组比较,补肾化瘀组、模型对照组、达英-35组CT表达强度降低(P<0.01);与模型对照组比较,补肾化瘀组、达英-35组CT表达强度增高(P<0.01)。见表2。


组 别nCT平均光密度值空白对照组200.557±0.695模型对照组200.278±0.120△补肾化瘀组200.390±0.059△★达英-35组200.332±0.058△★
注:与空白对照组比较,△P<0.01;与模型对照组比较,★P<0.01。
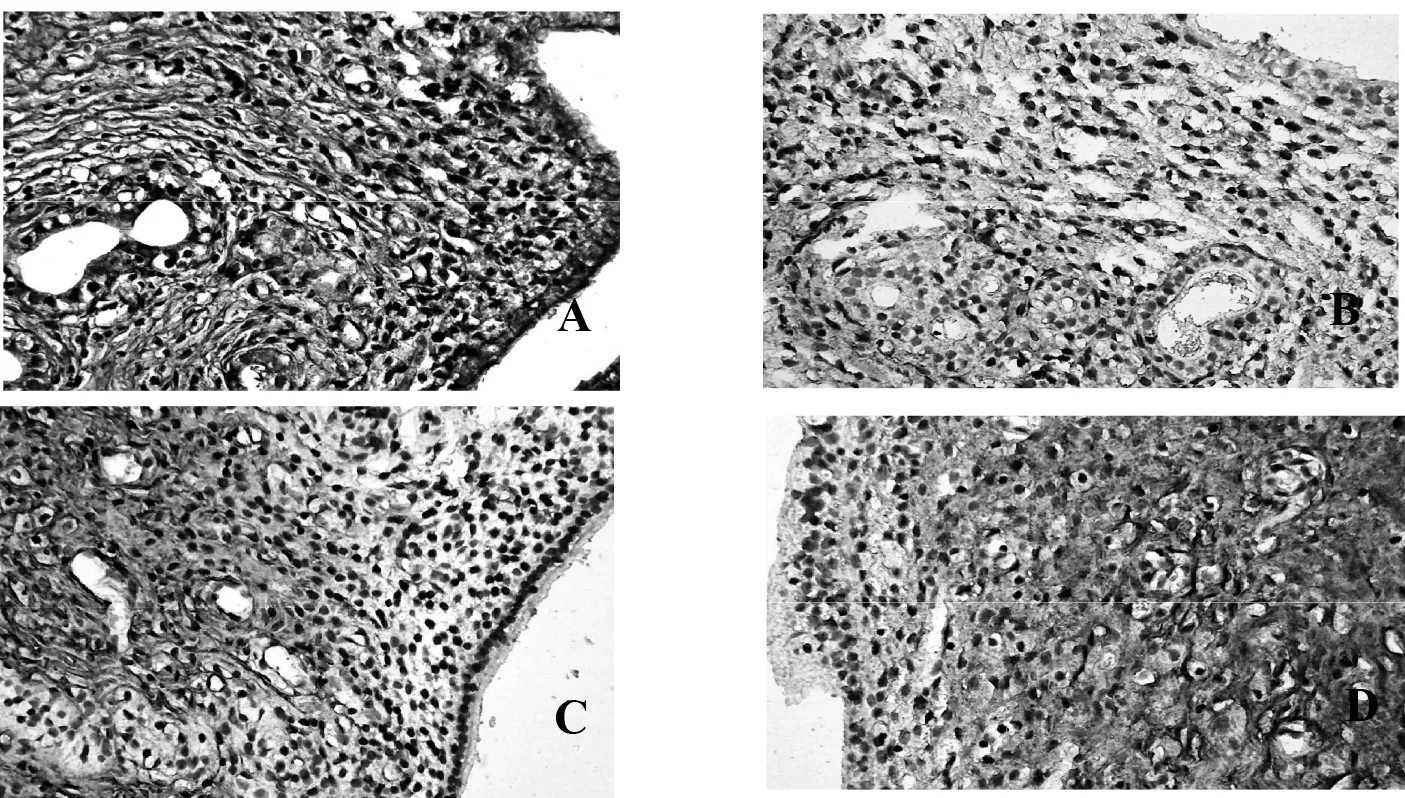
A.空白对照组;B.模型对照组;.C.补肾化瘀方组;D.达英-35组
图2各组大鼠子宫内膜种植窗期CT的表达(免疫组织化学法×400)
4 讨论
PCOS的模型建立有多种,既往实验研究报道[5-6],运用DHEA造模方法成功诱导在内分泌及卵巢形态学方面与人类PCOS患者相似的大鼠模型,并且发现模型大鼠同时伴有空腹血糖增高及高胰岛素血症,认为此种动物模型下丘脑-垂体-卵巢轴保持完整,是一种研究PCOS内分泌及卵巢病理改变的理想模型。因此本实验采用较为经典的DHEA诱导PCO模型的建立。
前期预实验提示DHEA诱导PCO大鼠模型可行。本研究在预实验基础上,以DHEA构建的PCO大鼠模型作为研究对象,观察大鼠动情周期、卵巢颗粒细胞形态转变以及PCO大鼠血清性激素水平的变化,结果显示:造模后,模型制备组肉眼观颜色较为苍白,镜下存在多个呈囊样扩张的形态不规则的空卵泡,卵巢颗粒细胞排列紊乱且呈多囊样改变,动情周期失去规律变化,血清T水平明显较高,血清E2水平明显较低,符合人类PCOS血清性激素变化。因此本模型无论是从卵巢形态学变化还是从内分泌改变进行评价,都是一种较为理想的PCOS动物模型。DHEA诱导的PCO大鼠模型更符合我们的实验要求。
精子与卵子的结合促使了胚胎的发生,在人类胚胎着床成功是一个复杂的程序化过程,任何一个环节异常都可能导致胚胎丢失或者着床失败[10]。胚胎的质量及发育潜能、子宫内膜容受性及子宫内膜局部微环境等都可影响生殖过程。其中子宫内膜容受性是指子宫内膜的一种状态或者可以称之为接受能力,子宫内膜容许胚胎定位、黏附并植入其中,达到能够准备接受胚胎植入的状态。其受到严格的时空限制,这个短暂特定的敏感时期,常称作“种植窗口期”,大约在排卵后的6~9d,或者月经周期的第20~24d[11]。这个关键时期,若内膜与胚泡发育同步才能达到子宫内膜容受性较为良好的状态,才能够顺利着床,否则就会着床障碍。因此,如何提高子宫内膜容受性,促进子宫内膜与受精卵的发育同步性,成为妇产科领域研究的焦点。随着PCOS发病率日益上升,其生殖问题也是研究焦点中重点关注方面之一。PCOS患者的突出问题是生殖障碍,与其他症候群相互影响,内分泌紊乱、胚胎发育潜能受损、子宫内膜容受性的降低都可能导致其生殖障碍[12]。促排卵是一直以来的重点之一,而如何改善PCOS患者子宫内膜容受性是近年的热点方向,中西医都为此进行不断地探索。
早在1994年,就有学者发现CT在子宫内膜“种植窗”的形成中起着重要作用[13]。随着研究方法和技术手段的更新,降钙素多机制调节子宫内膜容受性,促进胚胎的植入与发育,为不孕不育的治疗提供新的靶点。降钙素是一种肽类激素,主要是通过甲状腺滤泡旁细胞合成和分泌。研究发现子宫能够合成极少量的降钙素,虽然低于甲状腺合成的CT,但是子宫通过自分泌、旁分泌两种途径控制钙离子的平衡从而调节植入时子宫容受状态[14]。降钙素能够特异性表达于种植窗期子宫内膜,被认为是在这段敏感的短暂时期最有价值的生化标志物[15],本研究显示CT主要表达于子宫内膜腺上皮细胞中,与空白对照组比较,模型制备组CT表达下降,提示子宫内膜容受性下降可能与CT表达异常有关。
中医认为“肾为先天之本”,主生殖,肾精充盛可促进精卵的发育、内膜的长养。若肾气不足,或后天失于养护,精血匮乏,血海无以盈溢,则天癸泌至及冲任通盛受到影响,导致月经量少、闭经、不孕等。若肾阴不足,癸水不充则精卵、内膜失滋致精卵不能发育或发育不全;若肾阳不足,气化无力则精卵发育长养动力不足。肾虚引发肾阴肾阳的失调,从而导致肾阴失滋,肾阳失化致无排卵、排卵障碍。PCOS的病因病机复杂,变化多端,以肾虚为本,可兼见脾虚、肝郁、痰湿、血瘀等,故补肾乃为治法之根本。PCOS由于肾虚涉肝及脾而生痰浊、瘀血,同源互衍,相互影响。元代朱丹溪首次提出:“痰挟瘀血,遂成窠囊。”由此可以看出“瘀”的病理变化与PCOS病理结局类似。本研究采用导师多年来治疗PCOS的基础方补肾化瘀方,从补肾化瘀的角度出发,取得了一定的疗效。方中由紫石英、补骨脂、菟丝子、桑寄生、茺蔚子、泽兰、泽泻、土鳖虫、三七、覆盆子、莲子心、甘草组成。其中紫石英,取甘温之性温补肝肾,暖宫助孕,正如《神农版本草经》谓其可“补不足,女子风寒在子宫,绝孕十年无子”;补骨脂以滋补肾阳为主,具有雌激素样作用,《本草疏经》谓其:“暖水脏,阴中生阳,壮火益土之要药也。”二者合用,养肾阴,化肾阳,阴阳互根,肾精充足,共为君药。菟丝子能够补肾精,性偏平和,阴阳双补,阴中有阳,守而能走;桑寄生滋补精血,覆盆子具补益肾中元阳之能,滋养阴精之效,二者均归肝肾二经;莲子能够交通心肾,清心安神,可防温燥之弊,茺蔚子具活血化瘀调经功效。上均为臣药。泽兰、泽泻破瘀血,活血利水;三七止血化瘀,祛瘀补正;土鳖虫加强破血逐瘀之功;茺蔚子具活血化瘀调经功效。上均为佐药。甘草调和诸药为使药。全方补肾活血,化瘀调经,对改善子宫内膜局部微环境有促进作用。现代研究结果表明,补肾活血化瘀可能增加内膜厚度,改善子宫内膜血流状态[16]。本研究中,与模型对照组比较,补肾化瘀方组子宫内膜的CT 表达上调,因此我们认为补肾化瘀方可上调子宫内膜上CT表达,可能是补肾化瘀方改善子宫内膜容受性的机制之一。
综上所述,补肾化瘀方可在改善子宫内膜容受性方面产生积极作用,提示作用机制可能与上调子宫内膜CT表达有关。但影响子宫内膜容受性的相关生物活性因子及其他因素十分复杂,目前有部分研究较为深入的指标只能作为辅助,且中药作用于子宫内膜容受性的机制尚不完全清楚,亟待进一步拓展更为深入的研究,为中医药在治疗PCOS方面提供合理的科学依据。
[1]Balen A H,Tan S L,Macdougall J,et al.Miscarriage rates following in-vitro fertilization are increased in women with polycystic ovaries and reduced by pituitary,desensitization with buserelin[J].Human Reproduction,1993,8(6):959.
[2]余曦明.补肾化瘀方对PCO大鼠卵巢颗粒细胞上ER和AR基因表达的影响[D].湖南中医药大学,2011.
[3]刘利红.补肾化瘀方对PCOS肾虚血瘀证患者整合素α_Vβ_3表达的影响[D].湖南中医药大学,2013.
[4]Wang J,Rout U K,Bagchi I C,et al.Expression of calcitonin receptors in mous-e preimplantation embryos and their function in the regulation of blastocyst differentiation by calcitonin[J].DEVELOPMENT-CAMBRIDGE-,1998,125:4293-4302.
[5]张晓薇,邝健全,曾爱群,等.脱氢表雄酮诱导多囊卵巢综合征动物模型的研究[J].广州医学院学报,2000,28(3):14-17.
[6]李 燕,张庆文,王红彬.脱氢表雄酮诱导SD大鼠多囊卵巢综合征模型的实验研究[J].中国医药科学,2013,3(7):35-37.
[7]Monies G S,Luque E H.Effects of ovarian steroids on vaginal smears in the rat[J].Cells Tissues Organs,1988,133(3):192-199.
[8]徐叔云,卞如镰,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2006:1861.
[9]贺石林,王 健,王净净.中医科研设计与统计学[M].湖南:湖南科学技术出版社,2007:48-49.
[10]Potlog-Nahari C,Catherino W H,Mckeeby J L,et al.A suboptimal endometrial pattern is associated with a reduced likelihood of pregnancy after a day 5 embryo transfer[J].Fertility and sterility,2005,83(1):235-7.
[11]Singh M,Chaudhry P,Asselin E.Bridging endometrial receptivity and implantation: network of hormones,cytokines,and growth factors[J].Journal of Endocrinology,2011,210(1):5-14.
[12]李 予,苏圣梅,杨冬梓.多囊卵巢综合征患者子宫内膜容受性的特点[J].生殖与避孕,2014,34(7):571-575.
[13]Ding Y Q,Zhu L J,Bagchi M K,et al.Progesterone stimulates calcitonin gene expression in the uterus during implantation[J].Endocrinology,1994,135(5):2265-2274.
[14]Zhu L J,Bagchi M K,Bagchi I C.Attenuation of calcitonin gene expression in pregnant rat uterus leads to a block in embryonic implantation 1[J].Endocrinology,1998,139(1):330-339.
[15]Diao H L,Li S J,Wang H B,et al.Calcitonin immunostaining in monkey uterus during menstrual cycle and early pregnancy[J].Endocrine,2002,18(1):75-78.
[16]徐春芳,苗 苗,刘文燕.调经助孕丸对子宫内膜容受性影响的临床研究[J].山东中医杂志,2011,30(8):547-548.
