黄连素通过ROS/ERK1/2通路抗幽门螺旋杆菌相关性胃炎的实验研究※
2018-01-18闫平慧张锋利
● 田 华 闫平慧 张锋利
幽门螺旋杆菌(Helicobacter pylori,HP)是一种能感染人类胃部的革兰阴性微需氧菌,是最常见的传染性病原菌之一[1],全球有超过50%的人群感染,我国的平均感染率高达56%[2]。幽门螺旋杆菌相关性胃炎是指与HP感染相关的胃黏膜急慢性炎症或萎缩性病变[3]。目前研究证明,HP感染后可激发机体发生氧化应激(ROS)反应,生成的超氧化物(Superoxide,O2-)、一氧化氮(Nitric Oxide,NO)等是造成胃黏膜持续性损伤,导致胃炎甚至癌症发生的重要因素[4-5]。ERK1/2是一类丝/苏氨酸蛋白激酶,是促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中成员之一。它磷酸化后激活,激活的ERK1/2介导多种生物学反应[6-7]。大量研究证明,ROS是导致ERK1/2磷酸化的重要激活剂[8],而ERK1/2激活后又加剧了ROS对胃黏膜的损伤,抑制了胃黏膜的修复,引起急慢性胃炎,甚至出现细胞的过度增殖分化[9]。
黄连素(berberine,[C20H18NO4]+,又称小檗碱,BBR)是从毛莨科植物黄连、黄柏根茎中提取出的一种异喹啉类生物碱。它外观呈黄色的针状结晶或粉末,无臭、味极苦,由于它具有抑制炎症反应、调节脂质代谢、抗氧化应激损伤等多种药理作用而被广泛应用于临床[10-11]。
该实验建立大鼠HP相关性胃炎模型,观察黄连素对HP相关性胃炎胃黏膜的保护作用,并从抗氧化应激、调节ERK1/2表达方面探讨黄连素抗HP相关性胃炎胃黏膜的损伤、保护胃黏膜的作用机制,为黄连素防治HP相关性胃炎的临床应用提供实验依据。
1 材料与仪器
1.1动物成年雄性SD大鼠(220~240g)48只,购自西安交通大学实验动物中心[许可证号:SCXK(陕)2012-003]。实验室饲养温度(20±2)℃,所有动物适应性喂养1周。
1.2药品与试剂黄连素(B3251 Sigma)、快速尿素酶试验试剂盒(安信生物技术有限公司,批号:141196)、NOX2(sc-5827)、NOX4(sc-21860)、SOD(sc-17767)、ERK1/2(sc-16982)和iNOS(sc-5302)抗体均购自美国的Santa Cruz Biotechnology。
1.3仪器光学显微镜(尼康DXM1200F),倒置显微镜(尼康TS100),低温恒冷切片机(KD2800),台式高速离心机(GENIUS 16K),脱水机(TP1020),烘片机(ZMN200),石蜡切片染色机(5010型),微波炉,高压锅,恒温水浴箱,WB机(Bio-Rad,USA)。
2 方法
2.1造模48只大鼠随机分成正常组、正常+黄连素组、模型组、模型+黄连素组,每组各12只。参考文献[12]对模型组及模型+黄连素组大鼠进行造模。造模大鼠禁食12小时后以NaHCO3+消炎痛溶液0.5ml/只灌胃,接着禁食6小时后以HP菌液(含量109ml-1)1.5ml/只灌胃,再禁食禁水4h后常规饲养,隔天一次,连续10天,之后继续常规喂养;正常组及正常+黄连素组大鼠常规喂养。4周后,每组随机处死2只大鼠,取出鼠胃并沿胃大弯剪开,取一半胃黏膜组织做快速尿素酶实验、黏膜涂片革兰染色,以判断胃窦黏膜HP定植情况;取另一半胃黏膜组织,用4%多聚甲醛固定24 h后进行病理组织学检查。造模组大鼠胃黏膜均出现不同程度炎性改变,正常组的大鼠胃黏膜切片未见胃炎的病理改变。
2.2给药正常+黄连素组与模型+黄连素组将黄连素用0.5%羧甲基纤维素钠溶液制成浓度为100mg/ml的混悬液,正常组和模型组用0.5%的羧甲基纤维素钠溶液,四组均于每天上午9~10时按2ml/(kg·d)体积灌胃,连续给药4周。
2.3 Wester Blot检测取胃组织匀浆后测定蛋白含量,制备SDS-PAGE胶,蛋白变性、上样、电泳、转膜、封闭加一抗过夜,TBST洗膜,二抗封闭,TBST洗膜,发光。分别测定总ERK1/2、磷酸化ERK1/2、NOX2、NOX4、SOD蛋白的含量。以β-actin作为内参,使用Image J分析软件,计算每一样本蛋白的相对表达量。
3 结果
3.1各组大鼠胃黏膜NOX2含量情况模型组大鼠NOX2的含量明显高于正常组及正常+黄连素组大鼠(P<0.05);模型+黄连素组的NOX2含量明显低于模型组(P<0.05),而与正常组及正常+黄连素组之间无统计学差异(P>0.05)。见图1、表1。
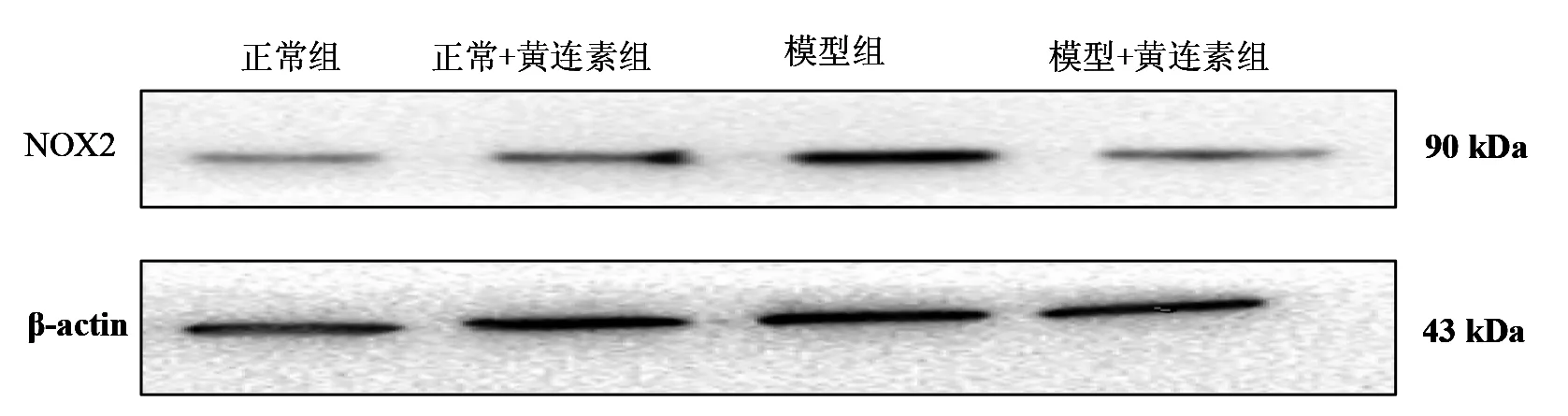
图1 大鼠胃黏膜NOX2含量
3.2各组大鼠胃黏膜NOX4含量情况模型组大鼠NOX4的含量明显高于正常组及正常+黄连素组大鼠(P<0.05);模型+黄连素组NOX4含量明显低于模型组(P<0.05),而与正常组及正常+黄连素组之间无统计学差异(P>0.05)。见图2、表1。
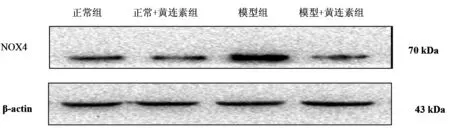
图2 大鼠胃黏膜NOX4含量
3.3各组大鼠胃黏膜iNOS含量情况模型组大鼠iNOS的含量明显高于正常组及正常+黄连素组大鼠(P<0.05);模型+黄连素组的iNOS含量明显低于模型组(P<0.05),而与正常组及正常+黄连素组之间无统计学差异(P>0.05)。见图3、表1。
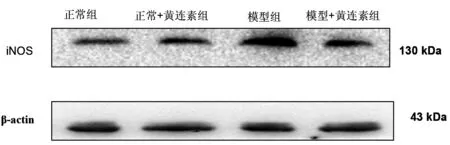
图3 大鼠胃黏膜iNOS含量
3.4各组大鼠胃黏膜SOD含量情况模型组大鼠SOD的含量明显低于正常组及正常+黄连素组大鼠(P<0.05);模型+黄连素组的SOD含量明显高于模型组(P<0.05),而与正常组及正常+黄连素组之间无统计学差异(P>0.05)。见图4、表1。
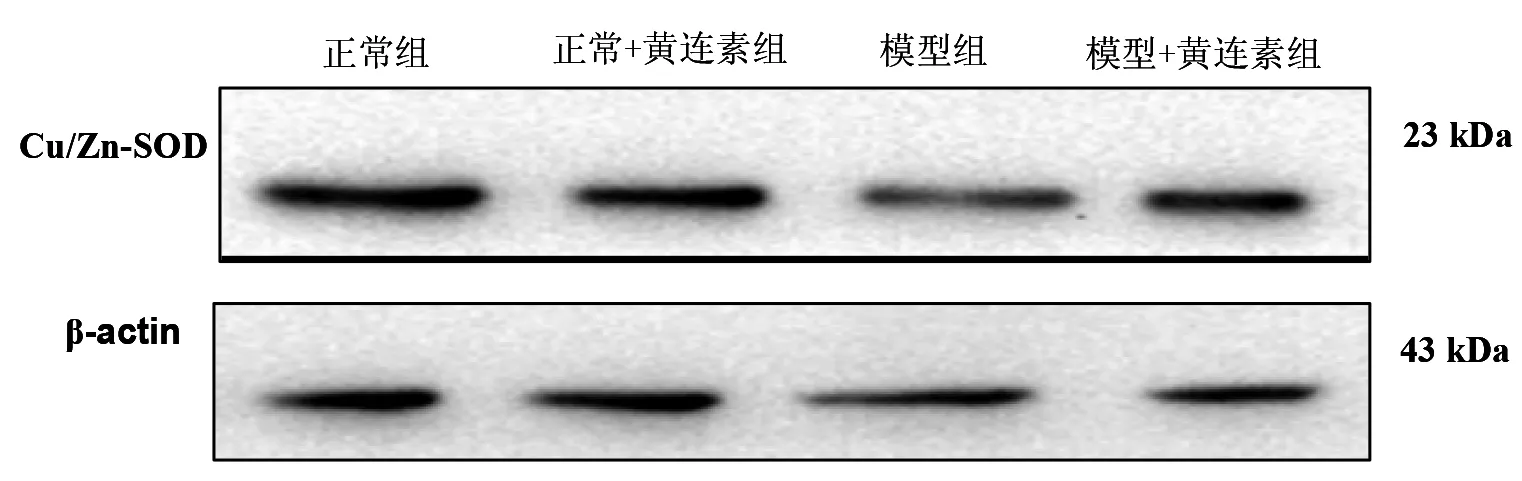
图4 大鼠胃黏膜SOD含量
3.5各组大鼠胃黏膜的磷酸化ERK1/2含量及总ERK1/2含量情况模型组大鼠磷酸化ERK1/2的含量明显高于正常组及正常+黄连素组大鼠(P<0.05);模型+黄连素组的磷酸化ERK1/2含量明显低于模型组(P<0.05),而与正常组及正常+黄连素组之间无统计学差异(P>0.05)。各组间总ERK1/2的含量没有统计学差异(P>0.05)。见图5、表1。
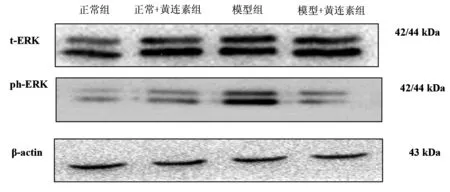
图5 大鼠胃黏膜t-ERK、ph-ERK含量
表1 各组大鼠胃黏膜NOX2、NOX4、iNOS、SOD、t-ERK、ph-ERK蛋白的表达
注:与正常组比较,△P<0.05;与模型组比较,*P<0.05。
3 讨论
幽门螺杆菌是最常见的传染性病原菌之一,在我国的感染率呈逐年上升的趋势[2]。HP在胃黏膜上皮细胞表面和胃粘液底层定植,导致胃黏膜细胞发生变性、坏死并伴有炎症细胞浸润,引起急性胃黏膜炎症,并发展为慢性胃炎;甚至出现胃黏膜的萎缩、化生,最终导致腺癌形成[13]。研究表明,在HP引起的胃黏膜损伤中,氧化应激起了十分重要的作用,感染HP的胃黏膜ROS明显增加[14]。首先,氧自由基通过与细胞膜内不饱和脂肪酸的结合,形成了大量的脂质过氧化物,损害细胞内线粒体和溶酶体,引发胃黏膜血流障碍,导致胃黏膜损伤。其次,氧自由基也可与相关氨基酸中的巯基结合使酶失活,从而破坏上皮间质透明质酸酶和胶原纤维网而进一步损害胃黏膜[9]。超氧化物歧化酶和NAD(P)H氧化酶是常用的反映氧化应激反应的指标。超氧化物歧化酶(Superoxide dismutase,SOD)是生物体内氧自由基清除的首要防线,它可降低氧化应激对细胞膜脂的损害并且修复受损细胞。因此,常用于考察清除氧自由基能力和胃黏膜保护作用[14]。NAD(P)H氧化酶则是一个多亚基的氧化还原酶,它的激活是组织内活性氧簇产生的重要原因之一,其结构中比较重要的有膜成分细胞色素gp91phox(NOX-2)和存在于细胞质中水溶性蛋白p47phox(NOX-4)。当HP进入机体后被中性粒细胞迅速吞噬,形成吞噬体,通过NAD(P)H氧化酶系统,增加过氧化物(Superoxide,O2-)、一氧化氮(Nitric Oxide,NO)等产物致使胃黏膜进一步受损[15]。
在氧化应激的作用下过多产生的NO,它的生成依赖于一氧化氮合酶,其中诱导型NO合酶(iNOS)被证明在被诱导激活后可产生大量NO,并与过氧阴离子反应形成过氧化亚硝酸盐,引起和加重消化道黏膜的损伤[16]。MAPK信号通路是调控HP相关性胃炎发生的重要通路,ERK作为MAPK下游主要通路,是将细胞外信号转导到细胞内部的重要物质,可在氧化应激、炎症等多种因素下被激活,活化后移位至细胞核,促进多种核内转录因子磷酸化,从而调控基因表达,促进细胞增殖分化。已有研究证明,ERK通路活性增高不仅可促进胃黏膜细胞的增殖,而且该通路的激活对于胃黏膜的修复也具有重要意义[8-9]。HP定植胃黏膜后,胃黏膜ROS明显增加。首先,氧自由基通过与细胞膜内不饱和脂肪酸的结合,形成了大量的脂质过氧化物,引发胃黏膜血流障碍,导致胃黏膜损伤。其次它也激活了ERK通路,将细胞外信号转导到细胞内部,促进多种核内转录因子磷酸化,从而调控基因表达,这又加剧了ROS对胃黏膜的损伤,抑制了胃黏膜的修复,引起急慢性胃炎,甚至出现细胞的过度增殖分化。
目前,临床上HP相关性胃炎的一线治疗方案存在毒副作用明显、疗效不稳定、易复发、病人依从性差、费用高等问题,其中,抗生素的广泛使用,不但引起胃肠道菌群失调及功能紊乱等不良反应,而且致使HP的耐药问题日趋严重[17]。黄连素由于其具有抗炎、抗氧化、降糖、调脂、降压、神经保护等多种药理作用而备受关注。本试验结果表明,黄连素能够明显减少HP相关胃炎大鼠的NOX2、NOX4、iNOS和ph-ERK1/2的表达,提高SOD的表达,从而抑制HP引起的氧化应激对胃黏膜的损伤,这为其作为该疾病的防治药物提供了新的理论和实验依据。
[1]Graham DY.Helicobacter pylori Update:Gastric Cancer,Reliable Therapy,and Possible Benefits [J].Gastroenterology,2015,148(4):719-731.
[2]Kusters J G,van Vliet A H,Kuipers E J.Pathogenesis of Helicobacter pylori infection [J].Clinical Microbiology Reviews, 2006,19(3):449-490.
[3]Salama NR,Hartung ML,Mu ller A.Life in the human stomach:persistence strategies of the bacterial pathogen Helicobacter pylori[J].Nature Reviews Microbiology,2013,11(6):385-399.
[4]Kuehler T C,Fryklund J,Bergman N-k,et al.Structure-activity relationship of omeprazole and analogs as Helicobacter pylori urease inhibitors[J].Journal of medicinal chemistry,1995,38(25):451-480.
[5]赖小平,苏子仁,陈建南,等.广藿香醇在制备抗幽门螺杆菌的药物中的应用[P].中国,ZL 201110249038.9.2013-01-28.
[6]Lin Y W,Lee L M,Lee W J,et al.Melatonin inhibits MMP-9 transactivation and renal cell carcinoma metastasis by suppressing Akt-MAPKs pathway and NF-kB DNA-binding activity[J].Pineal Res,2016,60(3):277.
[7] Martinez-Salgado, C.,Fuentes-Calvo, I.,Garcia-Cenador,B.,Santos, E. and Lopez-Novoa, J. M. Involvement of H- and N-Ras isoforms in transforming growth factor-β1-induced proliferation and in collagen and fibronectin synthesis[J]. Exp.Cell Res.2006,312:2093-2106.
[8]Liu S,Mizu H,Yamauchi H.Photoinflammatory responses to UV-irradiated ketoprofen mediated by the induction of ROS generation,enhancement of cyclooxygenase-2 expression,and regulation of multiple signaling pathways[J].Free radical biology & medicine 2010,48:772-800.
[9]蔡泳锋,连大卫,苏 锐,等.氧化应激与幽门螺杆菌感染相关性胃炎[J].现代生物医学进展2016,16(27):5397-5399.
[10]王洪建,王维新,张翠莲,黄连素的药理作用和临床应用进展[J].社会医学杂志,2006,4(4):36-38.
[11]郭丽坤,王志荣,岑 戎. 黄连素治疗幽门螺杆菌感染的临床研究[J].中国中西医结合消化杂志,2013,23(3):149-151.
[12]姚希贤,姚金锋.“疗胃煎剂”胃黏膜保护作用的实验研究[J].中国中西医结合脾胃杂志,2000,8(3):330-333.
[13]张 爽,刘海峰,张成岗.应激性胃黏膜损伤发病机制的研究进展.世界华人消化杂志,2009,17(17) :1697-1701.
[14]Lu T C,Liao J C,Huang T H,et al.Analgesic and Anti-Inflammatory Activities of the Methanol Extract from Pogostemon cablin [J]. Evidence-Based Complementary and Alternative Medicine, Volume 2011, Article ID 671741, 9 pages.
[15]Nam HJ,Park YY,Yoon G,et al.Co-treatment with hepatocyte growth factor and TGF-beta1 enhances migration of HaCaT cells through NADPH oxidase-dependent ROS generation.Experimental [J].Molecular Medicine 2010,42:270-279.
[16]Cherdantseva LA,Potapova OV,Sharkova TV,et al.Association of Helicobacter pylori and iNOS production by macrophages and lymphocytes in the gastric mucosa in chronic gastritis [J].Journal of Immunology research,2014,18:762-766.
[17]张万伤.中西医结合提高幽门螺杆菌根除率的探讨[J].医学与哲学,2012,33(5B):12-13.
