间隙灌溉和控释肥施用对稻田土壤产甲烷微生物的影响①
2018-01-17于海洋CONRADRalf
纪 洋,于海洋,CONRAD Ralf ,徐 华*
(1 南京信息工程大学应用气象学院,南京 210044;2 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;3 Max Planck Institute for Terrestrial Microbiology, Marburg 35043)
稻田是大气 CH4排放的重要来源,其 CH4排放量达25.6 Tg/a[1]。我国水稻种植面积占世界总种植面积的20%,其水稻产量占世界总量的32%~35%[2]。稻田CH4排放包括 CH4产生、再氧化和传输3个过程[3],其中前两个过程与土壤中产甲烷菌和甲烷氧化菌的数量及活性密切相关。产甲烷菌功能基因mcrA控制甲烷化的最后一步反应,将辅酶M连接的甲基催化还原为CH4[4],甲烷氧化菌功能基因pmoA编码利用甲烷的第一个关键酶,将甲烷氧化为甲醇[5]。因而稻田土壤中含有上述基因的功能微生物种群丰度结构及其演变规律受到广泛关注。
以前期淹水、中期烤田和后期干湿交替为特征的间隙灌溉是我国稻田主要的水分管理措施[1]。大量研究表明,相对于持续淹水,稻田烤田可显著抑制水稻生长期 CH4排放。水稻生长季持续淹水造成稻田极端厌氧,有利于 CH4的产生排放;相反,间隙灌溉模式下烤田增加土壤通透性,土壤中原有的还原状态被破坏,土壤Eh迅速增加,土壤CH4的生成受到限制[6];烤田期间土壤氧化CH4能力的提高是导致CH4排放减少的另一个原因[7-8]。然而有关间隙灌溉抑制稻田 CH4排放的微生物机理尚不清楚。控释肥是既适应作物全生长季不同生育阶段氮素营养的需求,而又不使土壤中剩余无机氮浓度过高的一种可控释放氮肥。目前有关控释肥对稻田 CH4排放影响的研究结果不一致。李方敏等[9]大田试验研究表明,稻季控释肥处理CH4排放量是尿素处理的2~3倍;林匡飞等[10]两季稻试验表明控释肥施用均显著降低50% 左右的早、晚稻CH4排放量;笔者前期研究发现稻季尿素处理和控释肥处理 CH4排放量之间无显著差异[11]。然而有关控释肥施用对稻田土壤微生物种群的影响,尤其是对与 CH4排放相关的功能微生物种群的了解很少。罗兰芳等[12]研究表明,短期施用控释氮肥的稻田土壤中细菌、真菌和放线菌数量明显高于不施氮处理;土壤氨化细菌、反硝化细菌的数量比尿素处理低;但控释氮肥处理的周年土壤细菌、放线菌数量明显高于尿素处理,真菌数量略低于尿素处理,说明控释肥能明显增加土壤微生物的数量。刘蕊等[13]发现控释尿素提高了小麦近根区土壤微生物的功能多样性和活性,促进了小麦近根区养分的转化和循环。张怡等[14]研究发现控释肥增加了覆膜栽培稻田土壤细菌数量,提高了土壤微生物生物量氮。以上研究均采用传统的平板培养法,对土壤微生物的认识十分有限。近年来,随着分子生物学技术的迅猛发展,基于16S rDNA基因及其他功能基因的非培养技术,包括聚合酶链式反应(PCR),克隆文库技术(Clone)和核酸定量技术(real-time PCR)的出现为揭示自然环境中微生物群落结构多样性的分子生态学研究开辟了一个全新的研究平台[15]。
本研究通过采集稻季田间原位试验新鲜土样,采用核酸定量技术(qPCR)和末端限制性片段长度多态性技术(T-RFLP),研究间隙灌溉和控释肥施用对与CH4排放相关的土壤微生物群落丰度和结构的影响,探讨不同水肥管理条件下稻田CH4排放的微生物机理,从而为农田系统温室气体减排提供理论和实践依据。
1 材料与方法
1.1 试验方案及样品采集
供试土壤是采自于2011年江苏省句容市行香镇(31°58′N, 119°18′E)水稻生长季田间原位新鲜土。试验地属北亚热带季风气候区,年平均气温15.1℃,年平均降雨量为1 100~1 200 mm。试验土壤为发育于下蜀黄土的爽水性水稻土,其基本理化性质为:pH 6.91,有机碳含量为18.9 g/kg,全N含量为1.2 g/kg,砂粒(2~0.02 mm)14%,粉粒(0.02~0.002 mm)69%,黏粒(<0.002 mm)17%,土壤WHC为 55%。
试验共设3个处理:①对照处理(CK):不施氮肥;②尿素处理(U):稻季尿素施用量为N 240 kg/hm2,麦季尿素施用量为N 200 kg/hm2;③控释肥处理(C):与尿素处理相同施氮量。本试验所施用的控释肥为山东金正大生态工程股份有限公司生产的可降解树脂包膜尿素肥料,含氮量为42%。小区面积均为3 m ×5 m,每个处理3次重复,随机区组排列。
田间管理措施与当地农民的大田管理相同。稻季尿素按基肥∶分蘖肥∶穗肥为 50%∶25%∶25% 施用(施用时间分别为2011年7月2日、7月22日和8月20日);控释肥作为基肥一次性施入。所有处理均施用450 kg/hm2的过磷酸钙和225 kg/hm2的氯化钾,作为基肥一次性施入。水稻品种为华粳3号,
于7月2日移栽(水稻移栽密度为24穴/m),11月6日收割。水分管理参照当地稻田常规管理方式,采用传统的前期淹水(7月1日—8月1日)、中期烤田(8月2日—8月13日)、后期干湿交替(8月14日—10月7日)和末期排水落干(10月8日—11月6日)的管理模式。
稻季土壤样品分别在淹水期(7月23日)、烤田初期(8月3日)、烤田末期(8月11日)和水稻成熟前排水落干期(11月4日)采集。各小区按“S”形多点采样法取表层(0~15 cm)土壤混合。取200 g新鲜土壤用液氮冷冻后-80 ℃ 保存,供分子生物学研究。
1.2 土壤DNA提取
称取 0.5 g 土壤用 Fast DNA SPIN KIT 试剂盒(MP Biomedicals, Eschwege, Germany)提取总DNA,操作按说明书进行。所提 DNA 质量与长度通过 1%凝胶电泳检测。所得 DNA 均稀释 10 倍后再进行下游实验。
1.3 定量PCR
细菌16S rRNA基因、古菌16S rRNA基因、产甲烷菌功能基因mcrA和甲烷氧化菌功能基因pmoA的定量PCR分析均采用SYBR Green染色法。各基因定量PCR所用的引物和参考文献如表1所示。
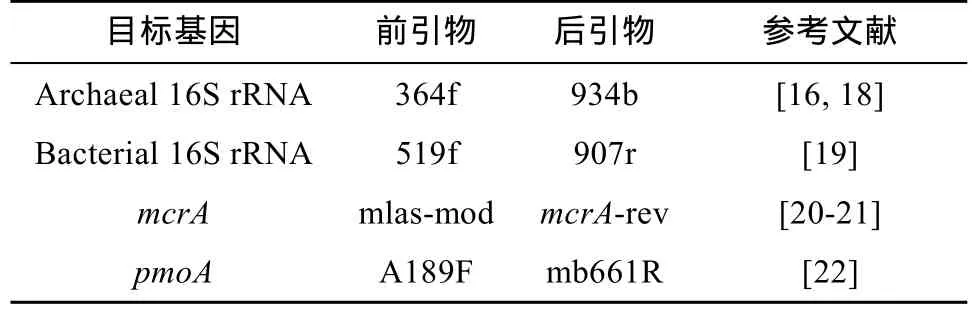
表1 各目标基因定量PCR所用引物及参考文献Table 1 Primers and references used in qPCR
1.4 古菌的T-RFLP分析
根据不同处理下古菌 T-RFLP 图谱的差异研究间隙灌溉和控释肥施用对稻田土壤古菌群落结构的影响。采用正向引物为 109f,反向引物为 915r[16],其中反向引物 5′ 端用 6-羧基二乙酸荧光素(FAM)标记的古菌通用引物扩增古菌 16S rRNA 片段[17]。扩增后的产物用TaqI进行消化酶切,酶切产物用ABI 3130 DNA sequencer(Applied Biosystems, Darmstadt, Germany)进行自动测序分析。T-RFLP图谱中每一个限制性片段(T-RF)作为一个 OTU(operational taxonomic unit),T-RFs片段大小 ±1 bp是同一个OTU。
1.5 数据分析
采用 SPSS 13.0 for Windows(SPSS Inc., USA)软件对不同处理的功能基因数目进行显著性差异分析(One-way ANOVA)。采用R3.0.0软件对不同处理古菌 T-RFs片段结构进行典型相关性分析(canonical correspondence analysis,CCA)。
2 结果与分析
2.1 稻季土壤微生物的群落丰度
图 1表示稻季不同水分管理时期土壤细菌、古菌、产甲烷菌(mcrA)和甲烷氧化菌(pmoA)群落丰度变化。土壤中检测到的细菌数量多于古菌,介于2.1×109~6.0×109copies/g干土之间。随着水稻生长,各处理细菌数量逐渐降低。与不施氮肥的对照处理相比,在水稻生长前期的淹水期、烤田期和烤田末期,施用尿素和控释肥均促进细菌数量增加,其中尿素处理细菌数量高于控释肥处理;而在水稻收获前的落干期,施用尿素降低细菌数量,施用控释肥对细菌数量没有明显影响。检测到的古菌数量在 1.3×108~3.8×108copies/g干土之间,随着水稻生长,各处理古菌数量逐渐增加。与不施氮肥的对照处理相比,施用尿素和控释肥均降低稻季古菌数量;与尿素相比,施用控释肥增加土壤中古菌数量。
产甲烷菌(mcrA)数量分别介于 5.0×106~2.1×107copies/g干土之间。烤田初期和烤田末期的产甲烷菌数量均小于淹水期和收获前的落干期。在淹水期,水稻正处于幼苗期,施用尿素和控释肥均促进产甲烷菌数量增加,随着水稻生长,氮肥施用逐渐抑制产甲烷菌生长。在水稻收获前的落干期期,尿素和控释肥均显著抑制产甲烷菌生长,其中控释肥处理产甲烷菌数量高于尿素处理。甲烷氧化菌(pmoA)数量介于 1.2× 107~4.2×107copies/g干土之间,且随着水稻的生长而增加。在水稻生长前期的淹水期、烤田初期和末期,尿素施用抑制甲烷氧化菌生长,随着水稻的生长,在水稻收获前的落干期,尿素施用促进甲烷氧化菌生长;在整个稻季,控释肥施用抑制甲烷氧化菌生长,但其抑制作用小于尿素处理。
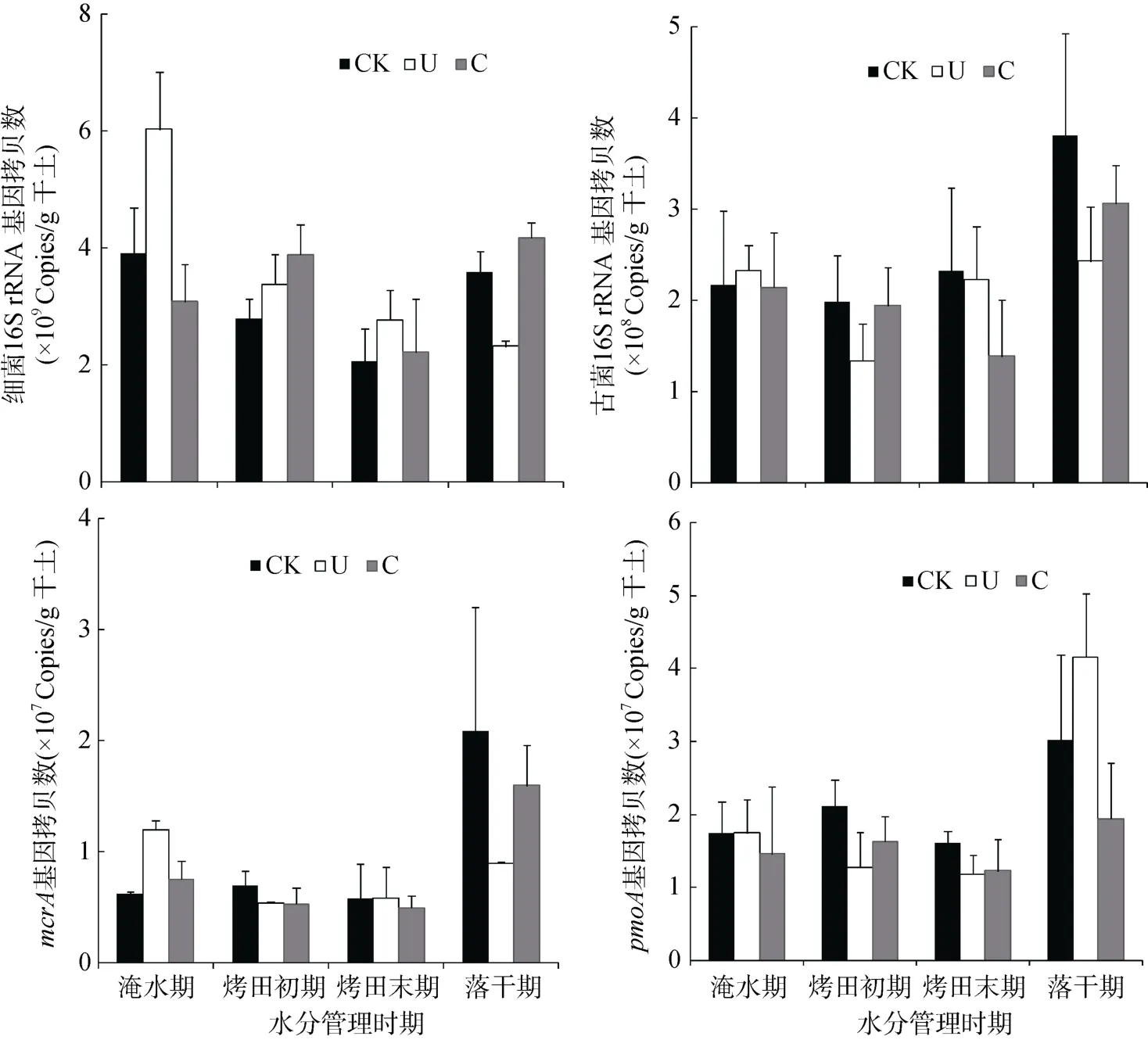
图1 稻季土壤微生物的群落丰度Fig. 1 Abundances of soil microorganisms during the rice growing season
2.2 稻季古菌群落的T-RFLP对比分析
根据毛细管凝胶电泳分离后所得到的有效T-RF数目来确定样品中古菌种群数,每个T-RF所对应峰的面积反映了该种群的丰度,而每个不同长度 T-RF的峰面积在所有T-RF的峰面积总和中的比例可以反映这个片断在酶切产物中的相对丰度,从而间接反映出这个片断所代表的物种在微生物群落中的相对丰度。图2表示水稻不同生长时期古菌群落组成的T-RF相对丰度变化。
由图2可知,整个水稻生长季,土壤古菌群落结构相似性较高,优势T-RFs长度为184 bp和391 bp,相对丰度分别是23%~55% 和11%~26%。184 bp片段在处于水稻生长前期的淹水期和烤田初期相对丰度较高(45%~55%),但随着烤田的进行逐渐下降,在烤田末期和水稻收获前的落干期仅占23%~30%;而391bp片段逐渐增加,其相对丰度由12%~18% 增至23%~26%,说明在水稻生长季,随着间隙灌溉的进行,古菌群落结构处于动态变化中。图3所示为利用典型相关性分析(CCA)研究间隙灌溉和氮肥施用对土壤古菌群落结构的影响。CCA分析表明间隙灌溉显著影响土壤古菌群落结构(P<0.001),其中淹水期和烤田前期、烤田末期、收获前落干期的土壤古菌群落聚集于3个不同区域。而控释肥和尿素施用对土壤古菌群落结构没有明显影响,不施氮处理、尿素处理和控释肥处理土壤古菌群落聚集区域没有明显规律。

图2 稻季土壤古菌的群落组成Fig. 2 Archaeal community composition in the soils during the rice growing season
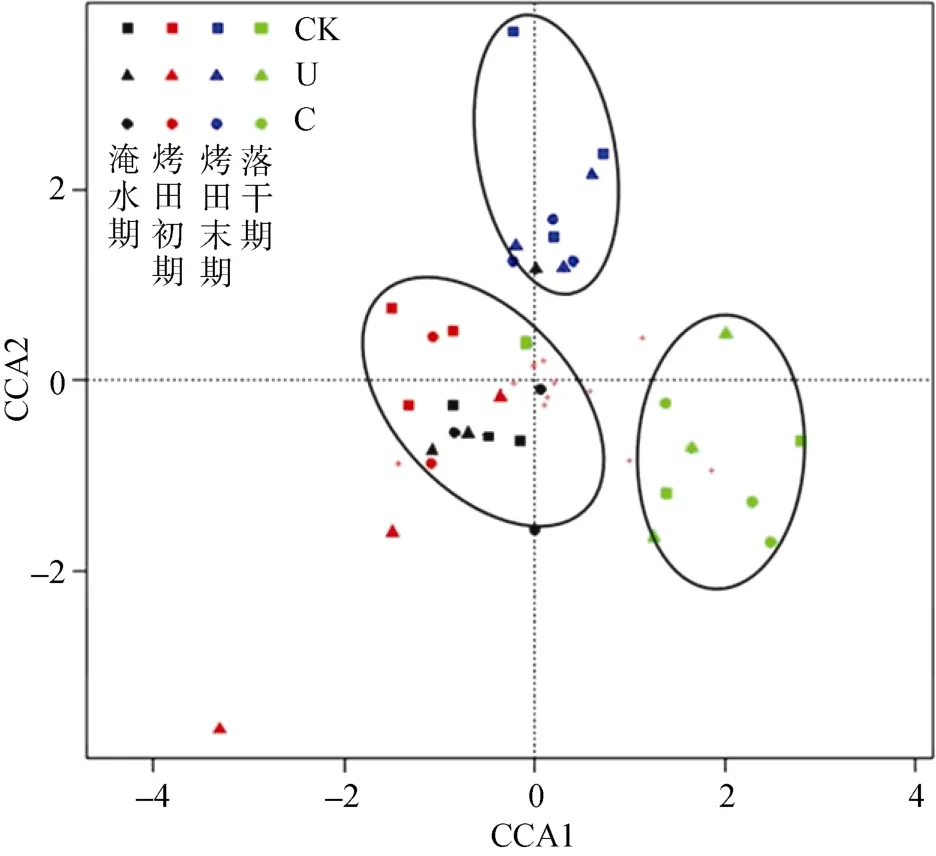
图3 稻季土壤古菌群落结构的典型性对应分析(CCA)Fig. 3 Canonical correspondence analysis (CCA) of archaeal community composition in the soils during the rice growing season
3 讨论
3.1 稻季CH4排放与土壤微生物丰度的关系
土壤微生物在稻田 CH4的产生和排放中发挥着重要作用。稻田 CH4排放包括 CH4产生、再氧化和传输3个过程[3],其中前两个过程都与产甲烷菌和甲烷氧化菌数量及活性密切相关[5]。陈中云等[23]研究发现水稻田土壤的甲烷排放量受到甲烷氧化菌、产甲烷菌种群数量及其活性及土壤理化性状的影响。结合笔者2011年在本原位试验地所测得的稻季CH4排放数据(表2)[11],我们发现稻田CH4排放量与土壤微生物丰度之间存在显著相关性(表 3)。稻季不同生长季CH4排放量与相应阶段的古菌和产甲烷菌数量之间均存在极显著的正相关关系(P<0.01),这与以往研究结果一致[23-25]。因此,控制农田产甲烷菌可以有效减少CH4排放量。
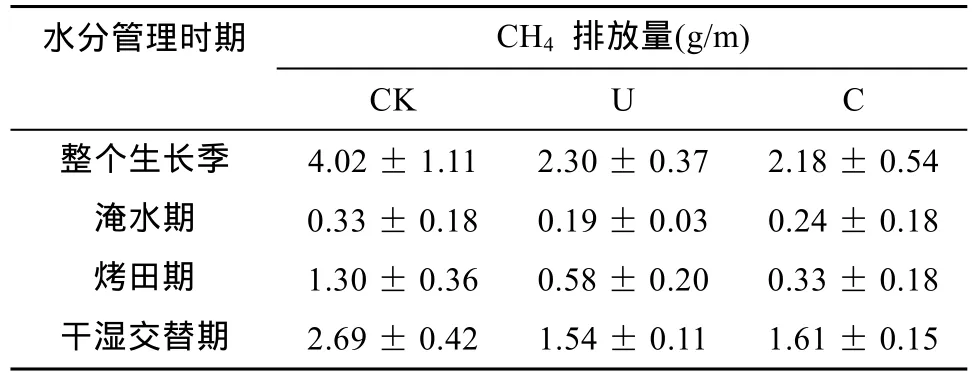
表2 稻季CH4排放量Table 2 CH4 emission during the rice growing season
甲烷氧化菌生长在“通气-厌气”界面,可氧化CH4,消耗大量CH4[26-27]。本研究中稻季CH4排放量与甲烷氧化菌数量呈显著正相关关系(表 3)。以往研究表明,土壤高浓度 CH4会促进甲烷氧化菌的生长和活性[28-29]。Zhang等[6]在本试验地的研究表明,CH4产生潜势对稻田 CH4排放量的影响较大,而 CH4氧化潜势对其影响较小。本研究中,由于产甲烷菌数量的增加促进 CH4产生,而高浓度的CH4含量同时又促进甲烷氧化菌的生长,产甲烷菌数量增加对 CH4产生的促进作用强于甲烷氧化菌数量增加对 CH4氧化的促进作用,因此产甲烷菌与甲烷氧化菌的数量同时与CH4排放呈正相关关系。

表3 稻季CH4排放量与土壤微生物丰度的相关性Table 3 Correlation analysis of CH4 emissions and the abundance of soil microbial communities
3.2 间隙灌溉对稻季土壤产甲烷微生物丰度和结构的影响
随着人们节水意识的提高,各种水稻节水灌溉技术,如“间隙灌溉”、“控制灌溉”“薄浅湿晒”等灌溉模式得到了大面积的推广应用。前期淹水、中期烤田(通常烤田7~10 d)、后期干湿交替(约每周灌溉1 次、期间出现土面落干状态)至水稻收获的间隙灌溉模式是一项广泛推广的农业措施。大量研究表明,相对于持续淹水,稻田烤田可显著抑制水稻生长期CH4排放[6-8],然而有关间隙灌溉模式对稻田土壤产甲烷微生物群落结构和功能影响的研究较少。本研究中土壤细菌、古菌、产甲烷菌和甲烷氧化菌的群落丰度均随着间隙灌溉的进行和水稻的生长而处于动态变化中。Asakawa和Hayano[30]采用MPN法发现产甲烷菌的数量在整个稻麦生长季保持恒定;李大明等[25]研究发现在水稻生长旺盛期(分蘖期)产甲烷菌的数量显著高于其他时期;而 Ma 等[31]通过研究不同水分管理方式对稻田产甲烷菌数量和结构发现,根际土壤中古菌的数量在水稻生长后期有明显的增加,与持续淹水相比,干湿交替水分管理方式显著降低稻田产甲烷菌数量,增加稻田甲烷氧化菌数量。本研究中稻季的水分管理参照当地稻田常规管理方式,采用前期淹水、中期烤田、后期干湿交替和末期排水落干的管理模式,为了有效控制水稻分蘖,烤田在水稻生长的旺期分蘖期进行。在淹水期,水稻正处于幼苗期,厌氧环境有利于产甲烷菌的生长;在烤田期,虽然水稻生长旺盛,但烤田增加了土壤通气性,破坏了产甲烷菌的生存条件,产甲烷菌数量下降,达到最低值;随着后期干湿交替的进行,产甲烷菌所需厌氧环境逐渐恢复,根系分泌物的大量产生又为产甲烷菌的增加提供了充足的反应底物,产甲烷菌数量逐渐增加,在水稻收获前的落干期达到最大值。甲烷氧化菌数量随着水稻生长而逐渐增加,在收获前的落干期达到最大值,烤田对甲烷氧化菌的数量没有显著影响,这可能是由于烤田期土壤铵态氮大部分转化为硝态氮,尽管烤田有利于甲烷氧化菌的生长,但硝态氮对甲烷氧化菌有一定的胁迫作用[32]。
水稻土中的产甲烷古菌群落主要由甲烷微菌科(Methanomicrobiaceae),甲烷八叠球菌科(Methanosarcinaceae),甲烷鬃菌科(Methanosaetaceae),甲烷杆菌科(Methanobacteriaceae)和 RC-I,以及相当一部分在系统发育树上没有确定分类的种群[4]。本研究通过T-RFLP研究稻季土壤古菌群落组成和季节变化,结果表明,水稻生长季古菌群落优势片段是 184bp和391bp。Ma等[31]研究发现,水稻生长季内,水稻土产甲烷古菌群落结构非常稳定,且不受间歇性排水的影响。Watanabe等[33]发现无论是在淹水状况下的水稻种植期,还是干旱的小麦种植期,产甲烷古菌群落结构非常稳定。而本研究CCA分析表明间隙灌溉显著影响整个水稻生长季古菌群落结构,其中处于水稻生长前期的淹水期和烤田前期群落结构相似,但随着烤田的进行和水稻的生长,古菌184bp的T-RF相对丰度逐渐下降,391bp的T-RF相对丰度逐渐上升。根据已有研究中古菌 16S rRNA基因系统发育树[4],184bp的T-RF通常代表乙酸发酵型产甲烷菌(Methanosarcinaceae),391bp的 T-RF通常代表氢营养型产甲烷菌(RC-I),表明水稻生长季内,乙酸型产甲烷菌相对丰度最高,随着间隙灌溉的进行和水稻的生长,乙酸发酵型产甲烷菌相对丰度逐渐增加,而氢营养型产甲烷菌相对丰度逐渐下降。Penning等[34]培养实验结果表明,随着土壤有机质逐渐分解产生丰富的乙酸,则 CH4产生主要由乙酸发酵而来,随着土壤中乙酸被大量消耗,乙酸发酵产甲烷途径逐渐减弱,而H2/CO2还原产甲烷途径逐渐增强。Zhang等[8]在本试验地研究间隙灌溉下稻田CH4产生途径的季节变化,结果表明,随着间隙灌溉的进行,乙酸发酵产甲烷途径由 70% 以上下降到 50% 左右。因此我们可以得到结论,水稻生长季内,乙酸发酵型产甲烷菌和氢营养型产甲烷菌相对丰度的变化决定了 CH4产生途径的变化。
3.3 控释肥施用对稻季土壤产甲烷微生物丰度和结构的影响
控释肥作为一种新型肥料,不仅可以提高肥料利用率,有效防止环境污染,而且具有提高土壤酶活性、增加土壤微生物数量、降低环境污染等优点[35]。孟庆英等[36]研究结果表明,施用肥料的各个处理土壤微生物数量均高于不施肥处理,其中控释肥施用有利于增加土壤细菌、土壤氮素含量及玉米产量;罗兰芳等[13]研究发现,短期施用控释氮肥稻田土壤的细菌数量明显高于不施氮处理,周年土壤细菌明显高于尿素处理,土壤中大多数微生物数量与土壤氮素养分含量呈正相关。氮肥养分释放特性不同,其对土壤中微生物数量及土壤中氮素产生影响不同[37]。本研究表明,与不施氮处理相比,施用尿素降低稻季收获期细菌数量,而施用控释肥增加其数量,这可能是由于尿素施用量过多会导致高浓度氮的胁迫作用和改变土壤pH,从而影响细菌的数量和活性,而控释肥可调节养分释放模式,满足作物全生育期对氮的生理需求,更利于提高土壤氮素含量为微生物创造良好的生存环境,刺激微生物的生长和活性。
氮肥施用对土壤产甲烷菌和甲烷氧化菌的影响较为复杂。Schimel[38]研究表明氮促进植株生长,为CH4产生提供前体基质,从而促进产甲烷菌的生长和活性;而许静等[39]研究表明高氮肥施用在一定程度上会抑制产甲烷菌的生长,降低其数量。本研究中,施用氮肥降低稻季古菌和产甲烷菌丰度,控释肥的抑制作用小于尿素,这可能是由于尿素施用后通过硝化作用产生硝态氮,提升了土壤氧化还原电位,间接抑制产甲烷古菌的生长。铵态氮肥对土壤甲烷氧化菌的影响随NH4+和CH4浓度的不同而变化[40],本研究中,稻季生长前期,氮肥施用降低甲烷氧化菌数量,但稻季收获期,氮肥施用增加其数量,这是由于在稻田高内源 CH4浓度的条件下,施用铵态氮肥对稻田 CH4氧化菌开始表现为抑制作用,随着时间的延长和铵态氮的逐渐消失,高浓度 CH4和铵态氮的存在促进了甲烷氧化菌的生长[41]。以上分析表明稻季施氮处理降低CH4排放量(表2)主要是由于氮肥对产甲烷菌生长的抑制作用及其对水稻生长前期甲烷氧化菌生长的促进作用。水稻生长前期,与尿素相比,施用控释肥对产甲烷菌和甲烷氧化菌数量没有明显影响,表3显示尿素处理和控释肥处理 CH4排放量之间无显著差异,这进一步说明稻田 CH4排放量与产甲烷菌和甲烷氧化菌数量的显著相关性。
研究表明,农业管理措施如施肥等会对土壤微生物产生重要的胁迫作用。长期以来,囿于培养方法,人们对土壤微生物多样性特别是古菌和细菌多样性所知甚少。近年来,国内外学者们结合DGGE和RFLP等分子标记技术研究了长期定位施肥对土壤产甲烷古菌和氨氧化古菌群落结构的影响[42],但尚无关于控释肥施用对稻季古菌群落结构影响的报道。Watanabe等[33]研究发现土壤中的产甲烷古菌主要受土壤类型的影响,而受土壤施肥制度与作物种植方式的影响相对较小,原因可能与产甲烷古菌主要介导了淹水土壤中丙酸盐的厌氧氧化有关。本研究通过采用T-RFLP手段研究氮肥施用对水稻生长季土壤古菌群落结构的影响,得到与上述研究相似的结果,虽然在水稻生长季,古菌群落结构处于动态变化中,但控释肥和尿素施用对土壤古菌群落结构没有明显影响。辜运富等[43]研究表明石灰性紫色土上种植水稻和小麦会对土壤中的古菌群落结构造成明显影响,不同施肥制度对土壤古菌群落结构相似性具有明显影响。目前有关施用无机肥对土壤微生物多样性的影响报道存在矛盾之处,可能与无机肥的种类、施用量和施用时间长短、土壤类型和利用方式等因素有关。以往研究表明,控释肥养分采用缓慢释放的形式,改变了普通速溶肥料养分供应集中的特点,提高养分利用率的同时可减少施肥量,能减轻施肥对环境的污染[44]。本研究中控释肥施用量与尿素施用量相同,在保证作物产量的前提下减少控释肥施用量会对土壤微生物群落,尤其是功能微生物,产生不同的影响吗?因此,有关控释肥施用对土壤微生物群落结构和功能的影响仍需进一步研究。
4 结论
本研究通过采集水稻生长季田间原位试验新鲜土样,采用核酸定量技术和末端限制性片段长度多态性技术,研究间隙灌溉和控释肥施用对稻田土壤产甲烷微生物群落丰度和结构的影响,以探讨间隙灌溉和控释肥施用影响稻田 CH4排放的微生物机理。结果表明,稻季CH4排放量与古菌、产甲烷菌(mcrA基因)和甲烷氧化菌(pmoA基因)数量均呈极显著正相关关系,而与细菌数量无显著相关性。在间隙灌溉水分管理方式下,稻田土壤产甲烷菌和甲烷氧化菌数量呈现明显的季节变化,其中烤田抑制产甲烷菌生长,而对甲烷氧化菌数量没有显著影响。与尿素相比,施用控释肥增加了稻田土壤细菌、古菌和产甲烷菌数量,降低了甲烷氧化菌数量。土壤古菌群落的优势 T-RFs长度为184bp和391bp,其中184bp片段的相对丰度随着间隙灌溉的进行逐渐降低为主,而391bp片段逐渐增加。CCA分析表明间隙灌溉显著影响土壤古菌
群落结构,而控释肥施用对土壤古菌群落结构没有明显影响。
[1] Yan X Y, Yagi K, Akiyama H, et al. Statistical analysis of the major variables controlling methane emission from rice fields[J]. Global Change Biology, 2005, 11: 1131-1141
[2] International Rice Research Institute (IRRI). RiceStat database[DB]. Los Baños, Philippines, 2004, http://www.irri.org/science/ricestat/index.asp
[3] 蔡祖聪, 徐华, 马静. 稻田生态系统CH4和N2O排放[M].合肥: 中国科学技术大学出版社, 2009, 70: 155-160
[4] Conrad R, Klose M, Lu Y, et al. Methanogenic pathway and archaeal communities in three different anoxic soils amended with rice straw and maize straw[J]. Frontiers in Microbiology, 2012, 3: 4-doi: 10.3389/fmicb.2012.00004.[5] Theisen A R, Ali M H, Radajewski S, et al. Regulation of methane oxidation in the facultative methanotrophMethylocella silvestrisBL2[J]. Molecular Microbiology,2005, 58(3): 682-692
[6] Zhang G B, Liu G, Zhang Y, et al. Methanogenic pathway and fraction of CH4oxidized in paddy fields: Seasonal variation and effect of water management in winter fallow season[J]. PLoS ONE, 2013, 8(9): e73982. doi:10.1371/journal.pone.0073982.
[7] Jia Z J, Sugano A, Asari N, et al. Molecular characterrization of methane-oxidizing bacteria associated with rice straw decomposition in a rice field[J]. Soil Science and Plant Nutriention, 2007, 53(6): 729-739
[8] Zhang G B, Ji Y, Ma J, et al. Intermittent irrigation changes production, oxidation, and emission of CH4in paddy fields determined with stable carbon isotope technique[J]. Soil Biology and Biochemistry, 2012, 52: 108-116
[9] 李方敏, 樊小林, 刘芳, 等. 控释肥料对稻田氧化亚氮排放的影响[J]. 应用生态学报, 2004, 15(11): 2170-2174[10] 林匡飞, 项雅玲, 姜达炳, 等. 湖北地区稻田甲烷排放量及控制措施的研究[J]. 农业环境保护, 2000, 19(5):267-270
[11] Ji Y, Liu G, Ma J, et al. Effects of urea and controlled release urea fertilizers on methane emission from paddy fields: A multi-year field study. Pedosphere, 2014, 24(5):662-673
[12] 罗兰芳, 郑圣先, 廖育林, 等. 控释氮肥对稻田土壤微生物的影响及其与土壤氮素肥力的关系[J]. 湖南农业大学学报, 2007, 33(5): 608-613
[13] 刘蕊. 控释尿素对土壤氨挥发、氮素养分和微生物多样性及小麦产量的影响[D]. 泰安: 山东农业大学, 2010
[14] 张怡, 吕世华, 马静, 等. 控释肥料对覆膜栽培稻田N2O排放的影响[J]. 应用生态学报, 2014, 25(3): 769-775
[15] Heid C A, Srevrns J. Real time quantitative PCR[J].Genome Research, 1996, 6: 986-994
[16] Grosskopf R, Janssen P H, Liesack W. Diversity and structure of the methanogenic community in anoxic rice paddy soil microcosms as examined by cultivation and direct 16S rRNA gene sequence retrieval[J]. Applied and Environmental Microbiology, 1998, 64: 960-969
[17] Chin K J, Lukow T, Conrad R. Effect of temperature on structure and function of the methanogenic archaeal community in an anoxic rice field soil[J]. Applied and Environmental Microbiology, 1999, 65: 2341-2349
[18] Burggraf S, Huber H, Stetter K O. Reclassification of the crenarchaeal orders and families in accordance with 16S rRNA sequence data[J]. International Journal of Systematic Bacteriology, 1997, 47(3): 657-660
[19] Lane D J. 16S/23S rRNA sequencing // Stackebrandt E,Goodfellow M. Nucleic acid techniques in bacterial systematics[M]. New York: Wiley, 1991: 115-147
[20] Angel R, Matthies D, Conrad R. Activation of methanogenesis in arid biological soil crusts despite the presence of oxygen[J]. PLoS ONE, 2011, 6: e20453-doi:10.1371/journal. pone.0020453.
[21] Angel R, Claus P, Conrad R. Methanogenic archaea are globally ubiquitous in aerated soils and become active under wet anoxic conditions[J]. ISME Journal, 2012, 6:847-862
[22] Costello A M, Lidstrom M E. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments[J]. Applied and Environmental Microbiology, 1999, 65(11): 5066-5074
[23] 陈中云, 闵航, 陈美慈, 等. 不同水稻土甲烷氧化菌和产甲烷菌数量与甲烷排放量之间相关性的研究[J]. 生态学报, 2001, 21(9): 1499-1504
[24] Conrad R. Soil microbial communities and global climate change-methanotrophic and methanogenic communities as paradigms // VanElsas J D, Jansson J, Trevors J T. Modern soil microbiology[M]. 2 ed. Boca Raton (FL): CRC Press,2007: 263-282
[25] 李大明, 成艳红, 刘满强, 等. 双季稻田甲烷排放与土壤产甲烷菌群落结构和数量关系研究[J]. 农业环境科学学报, 2013, 32(4): 866-873
[26] Bodelier P L E, Frenzel E F. Contribution of methanotrophic and nitrifying bacteria to CH4and NH4+oxidation in the rhizosphere of rice plants as determined by new methods of discrimination[J]. Applied and Environmental Microbiology, 1999, 65(5): 1826-1833
[27] Holmes A J, Costello A. Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related[J]. FEMS Microbiology Letters,1995, 132(3): 203-208
[28] Arif M A S, Houwen F, Verstraete W. Agricultural factors affecting methane oxidation in arable soil[J]. Biology and Fertility of Soils, 1996, 21: 95-102
[29] Bender M, Conrad R. Effect of CH4concentrations and soil conditions on the induction of CH4oxidation activity[J].Soil Biology and Biochemistry, 1995, 27(12): 1517-1527
[30] Asakawa S, Hayano K. Populations of methanogenic bacteria in paddy field soil under double cropping conditions (rice-wheat)[J]. Biology and Fertility of Soils,1995, 20: 113-117
[31] Ma K, Conrad R, Lu Y H. Responses of methanogenmcrAgenes and their transcripts to an alternate dry/wet cycle of paddy field soil[J]. Applied and Environmental Microbiology, 2012; 78(2): 445-450
[32] Boer W D, Duyt S, Laanbrock H J. Autotrophic nitrifycation in a fertilized acid health soil[J]. Soil Biology and Biochemistry, 1988, 20: 845-850
[33] Watanabe T, Kimura M, Asakawa S. Community structure of methanogenic archaea in paddy field soil under double cropping (rice-wheat)[J]. Soil Biology and Biochemistry,2006, 38: 1264-1274
[34] Penning H, Claus P, Casper P, et al. Carbon isotope fractionation during acetoclastic methanogenesis by Methanosaeta conciliiin culture and a lake sediment[J]. Applied and Environmental Microbiology, 2006, 72: 5648-5652
[35] Trenkel M E. Controlled-release and stabilized fertilizers in agriculture[M]. Pairs: Published by international Fertilizer Industry Association, 1997
[36] 孟庆英 , 朱宝国, 王囡囡, 等. 控释尿素与常规尿素不同配施对根际土壤微生物数目、土壤氮素及玉米产量的影响[J]. 土壤通报, 2012, 43(5): 1173-1176
[37] Yuan Q, Liu P F, Lu Y H. Differential responses ofnirK-andnirS-carrying bacteria to denitrifying conditions in the anoxic rice field[J]. Environmental Microbiology Reports,2012, 4(1): 113-122
[38] Schimel J. Global change: Rice, microbes and methane[J].Nature, 2000, 403: 375-377
[39] 许静, 严陈, 林毅, 等. FACE对水稻土产甲烷古菌丰度的影响[J]. 土壤学报, 2012, 49(6): 1248-1251
[40] Oneill J G, Wilkinson J F. Oxidation of ammonia by methane oxidizing bacteria and the effects of ammonia on methane oxidation[J]. Journal of General Microbiology,1977, 100: 407-412
[41] Cai Z C, Xing G X, Yan X Y, et al. Methane and nitrous oxide emissions from rice paddy fields as affected by nitrogen fertilizers and water management[J]. Plant and Soil, 1997, 196(1): 7-14
[42] Peng S Z, Yang S H, Xu J Z, et al. Nitrogen and phosphorus leaching losses from paddy fields with different water and nitrogen managements[J]. Paddy and Water Environment, 2011, 9: 333-342
[43] 辜运富, 张小平, 涂仕华, 等. 长期定位施肥对石灰性紫色水稻土古菌群落结构的影响[J]. 生物多样性, 2011,19(3): 369-376
[44] 樊小林, 刘芳, 廖照源, 等. 我国控释肥料研究的现状和展望[J]. 植物营养与肥料学报, 2009, 15(2): 463-473
