慢性阻塞性肺疾病患者的营养评估及营养支持现况调查
2018-01-17马小陶金江丽
石 劢,陈 杰,陈 禹,马小陶,金江丽
(1中日友好医院营养科,北京 1000292; 2中日友好医院预防保健科,北京 100029;3中日友好医院高干医疗科,北京 100029)
1998年,慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD,简称慢阻肺)全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)启动,目标是根据最佳研究结果制订慢阻肺的推荐管理策略,现已更新GOLD 2015版。早在2011年底,COPD的诊断、处理和预防全球策略就指出营养不良是COPD预后不良的独立因子[1]。门诊COPD患者营养不良的发生率约25%,住院患者高达50%,合并呼吸衰竭的COPD危重病人高达60%,应用机械通气治疗的患者甚至达到71%[2]。无论自主呼吸或机械通气的呼吸疾病患者,营养不良均损害呼吸肌功能、通气动力、肺防卫机制,最终削弱肺功能。营养治疗是COPD治疗中的重要组成部分,患者对热量需求量高,但疾病本身造成患者摄食受限,经口自然进食往往无法满足患者的营养需求。如何联合应用自然进食及肠内营养(enteral nutrition,EN)和肠外营养(parenteral nutrition,PN)以保证热量的适宜摄入及营养素的合理供给,改善患者的营养状况,改善受损的肺功能、促进疾病康复,为此笔者进行了专题研究。
1 对象与方法
1.1 研究对象
我院营养科2016年7月1日—2017年6月30日共会诊和随诊COPD患者197例,年龄50~87岁,平均年龄76.4±12.7岁,男108例,女89例,病程2~52年。患者入院后,测定血清白蛋白(ALB)、测量患者的身高和体重,计算体重指数(BMI)。COPD诊断参照《慢性阻塞性肺疾病诊治指南》(2013修订版)[3]的诊断标准。
1.2 营养评估
(1)营养风险:营养风险筛查2002(Nutritional Risk Screening 2002,NRS2002)[4]进行营养风险筛查,NRS2002评分≥3分即认为存在营养风险。
(2)营养不良:(1)BMI<18.5 kg/m2并伴有一般情况差者。(2)或无准确BMI及肝肾功能明显异常,ALB<30g/ L为营养不良。(3)亦可测量小腿围、三头肌皮褶厚度(triceps skinfold thickness,TSF)和上臂肌围(arm muscle circumference,AMC),小腿围<31 mm、男性TSF<8.3 mm、女性TSF<15.3mm、AMC<20.83 cm为营养不良。
(3)能量及营养素摄入评估:能量达到推荐摄入量±10%,可认为合理;三大营养素摄入比例满足蛋白质、脂肪、碳水化合物的供能比例分别为15%~20%、30%~35%、50%,可视为合理。
1.3 医学营养治疗(medical nutrition treatment,MNT)现况调查
COPD的常规治疗包括抗感染、止咳化痰、平喘治疗、营养支持。营养支持现况调查包括两方面:营养支持途径和营养供给方案。
(1)结合患者的临床情况,选择营养支持的途径。营养支持途径包括经口自然进食、经口营养补充(oral nutritional supplements,ONS)、EN(可管饲)和PN[5]。胃肠功能正常的情况下优选经口自然进食和经口营养补充(ONS),经口摄入不足可EN(管饲)支持。胃肠的耐受性受限,需要PN支持协同治疗,待胃肠功能恢复,EN逐渐取代PN,逐步向经口自然进食过渡。营养摄入可通过饮食日记,数据录入中西医结合营养治疗计算机专家系统MX1.1版,评估进食方式及营养素摄入情况。
(2)经口天然食物不足能量60%时,优先考虑ONS,可选用匀浆、整蛋白营养粉等。如患者胃肠功能正常,但进食时喘憋是干扰进食量的主要因素。建议患者在现在进食的基础上,用EN(鼻饲)途径补充热量,日加餐1~2次(500~1 000kcal),补充乳清蛋白粉10~20g,以实现三大营养素的合理配比。EN包括能全力、百普力、瑞代、安素、匀浆、蛋白粉等。
(3)MNT方案(高脂肪低碳水化合物是基本原则)的制定流程[6]:①每日热量总需求≌静息能量消耗(rest energy expenditure,REE),REE=每日基础热量消耗(basal energy expenditure,BEE)×应激系数,BEE采用Harris-Benedict公式计算;稳定期COPD患者应激系数1.0~1.1,急性期应激系数为1.25~1.3,若合并呼吸衰竭、应用机械通气时应激系数为1.5~1.6。②营养素的配给:经口自然进食、ONS和EN(鼻饲):蛋白质、脂肪、碳水化合物的合理供能比例应为15%~20%、30%~35%、50%,注意维生素B、胡萝卜素、磷、钙、镁的补给。对食欲减退的病人,除了设法刺激食欲外,可采用少食多餐的办法。PN:葡萄糖每日最低供给150g/d,COPD患者非蛋白热能中糖脂比2∶3~1∶1。注意各种维生素、微量元素、谷氨酰胺、精氨酸、ω-3脂肪酸等的补充。
(4)监测和评估:MNT需3~5d时间逐步过渡到推荐量。日常监测患者的胃肠耐受情况(有无腹泻、腹胀、便秘等)热量摄入及营养素摄入达标情况。观察记录体重及握力的变化,以评价整体营养状况和肌肉力量的恢复情况。
1.4 统计学处理
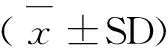
2 结果
2.1 COPD营养风险筛查及营养不良情况
197名COPD患者中,营养风险的发生率为72.59%(143/197),营养不良的发生率为49.75%(98/197),仅有27.42%的患者营养状况尚可。
2.2 入院时COPD患者的营养指标、营养途径及营养摄入情况
表1列出了入院时COPD患者的营养指标、营养途径及营养摄入情况。
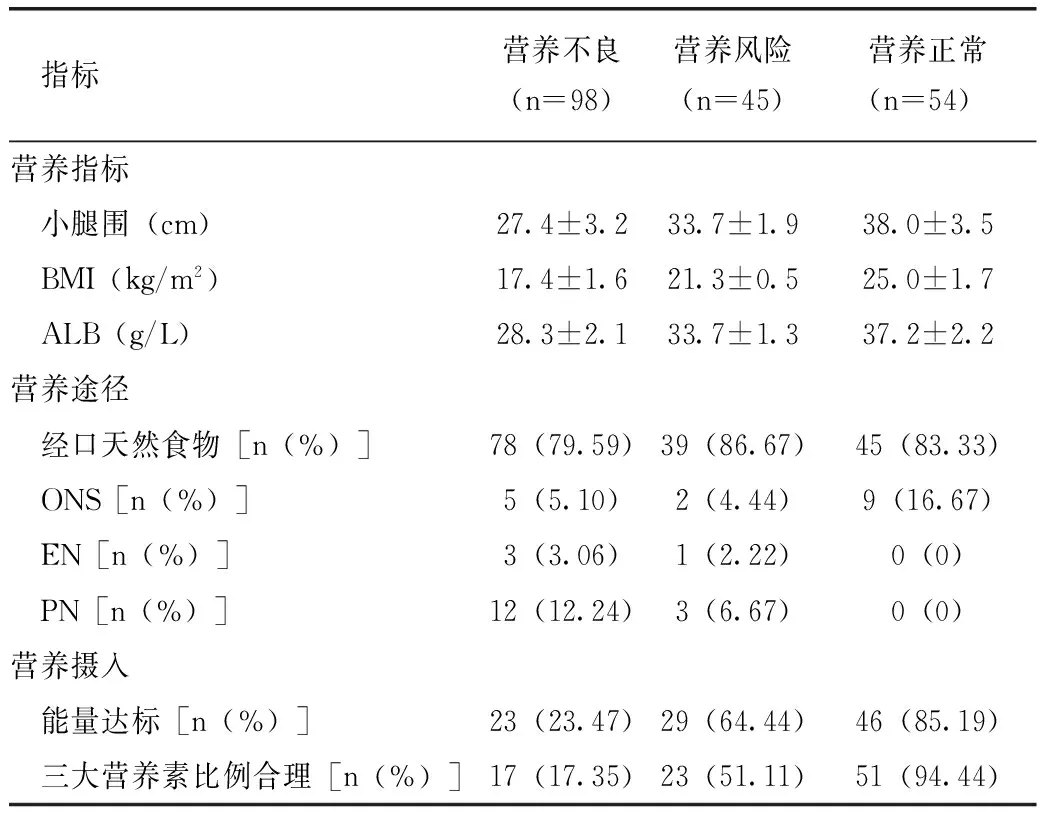
表1 入院时COPD患者的营养指标、营养途径及营养摄入情况
注:营养指标采用方差分析,F值分别为5.86、370.02、117.34,P均<0.001;营养途径采用χ2检验,χ2=15.45,P=0.017;能量达标采用χ2检验,χ2=58.09,P<0.001;营养素比例合理采用χ2检验,χ2=83.83,P<0.001
2.3 营养评估和干预后COPD患者的营养指标、营养途径及营养摄入情况
COPD患者的营养干预包括途径的选择和营养素的合理补充,患者每3d进行一次营养评估,如经口天然食物不足推荐热量的60%,可考虑ONS,必要时采用管饲营养;如前两种营养摄入仍不足推荐热量的60%,可考虑PN。
患者出院前一天重新进行营养风险筛查及营养评估,制定居家营养支持方案。197名COPD患者,仍有82名患者存在营养风险,占41.62%(82/197),其中45名患者存在营养不良,占22.84%(45/197)。表2是COPD患者出院前一天的营养指标、营养途径及营养摄入情况。
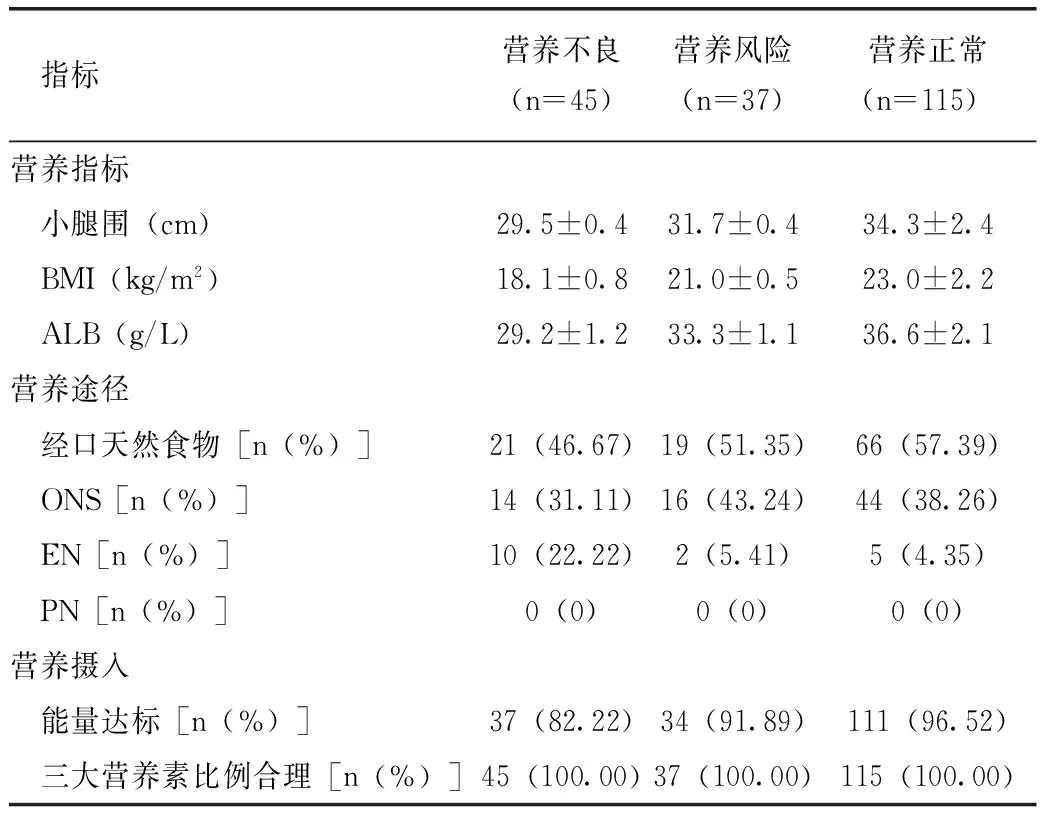
表2 出院前COPD患者的营养指标、 营养途径及营养摄入情况
注:营养指标采用方差分析,F值分别为13.62、10.88、138.95,P均<0.001;营养途径采用χ2检验,χ2=14.10,P=0.007;能量达标采用χ2检验,χ2=9.42,P=0.009
3 分析与结论
3.1 COPD发生营养不良的机制
COPD患者处于高代谢状态,由于气流受限呈进行性发展,持续存在呼吸能耗增加,如果没有增加热量摄入,体重必然会逐步下降。COPD患者运动受限会造成肌肉减少,COPD营养不良患者的蛋白质分解活性增加会加重肌肉萎缩。细胞因子TNF-α可增加细胞内蛋白质分解造成新陈代谢紊乱,增龄性瘦组织群减少,COPD患者普遍存在进食量减少、热量不足,多方面加剧COPD营养不良的进展[7]。
3.2 营养不良对COPD的影响
营养不良是COPD的一种较为多见并发症,表现为体质量减轻、白蛋白减少、免疫功能低下及肺功能进行性损伤,病人住院次数及死亡率增加。肺功能的减退与营养状态的恶化相平行。COPD合并营养不良患者多有体重下降现象,特别是非脂肪组织群的减少比较明显。营养不良能够直接造成患者肺和胸廓出现结构性改变,患者膈肌和肋间肌肉出现结构紊乱,造成额外的代谢压力,患者出现呼吸肌效率下降问题,直接造成肺部弹力纤维及活性物质的减少,导致肺功能下降。患者非脂肪群减少,骨骼肌结构出现变化,直接导致骨骼肌功能发生明显下降,COPD患者的日常活动量大幅度减少,活动能力降低。营养不良患者因免疫系统受损且活动量大幅下降,较易出现反复感染,再住院率较高,有研究认为,超重和肥胖患者预后情况好于营养不良患者[8]。
3.3 MNT多途径联合治疗的要点及意义
补充热量是营养支持的基础,适宜的热量有利于控制病情发展,热量不足不能为机体提供足够的能源用以维持或修复组织器官的结构和功能[9]。应纠正目前普遍存在的“COPD饮食摄入不足是疾病导致的,等疾病恢复后逐步恢复进食量”的错误认识,目前营养支持的途径及EN制剂逐渐增多,特殊医学用途配方食品的兴起,都为COPD早期营养干预提供了保证。由于疾病本身的特点,MNT方案中着重指出,避免过多地摄入碳水化合物,产生过多CO2,加重高碳酸血症,增加呼吸负担;患者多伴有肌肉减少,故应注意优质蛋白质的补充,同时辅以耐力训练,利于患者肌肉量的增长;可选用MCT油保证热量的供给等。COPD患者蛋白质、脂肪、碳水化合物的合理供能比例应为15%~20%、30%~35%、50%,还应关注维生素B、胡萝卜素、磷、钙、镁等对呼吸功能的作用,注意及时补充[6]。COPD患者营养支持的成败在于既能改善呼吸功能,又不增加呼吸肌负担,防止减轻病人体质量和呼吸功能及免疫功能的进一步下降,提高病人的生存质量[10]。
COPD患者如达到营养不良状态,营养干预是必须的,但营养治疗要注意循序渐进,患者已经长时间热量不足,进食量过少,选用食物及制剂时必须注意对胃肠道的耐受性,比如蛋白类食物的胃储留时间,单一制剂或药物对肠道菌群的影响,如发生腹胀、腹泻时如何进行判别、诊断和处理。营养治疗的开展也需要呼吸科、康复科、临床药师等医护人员的配合,多学科联合治疗的重要性,在于发现COPD患者即开始健康教育,预防营养不良的发生,发挥营养治疗提高COPD患者的呼吸肌肌力及耐力、改善呼吸功能,预防急性发作的作用。
综上所述,COPD患者营养不良的发病率较高,多种营养支持途径联合应用的MNT能够改善患者的营养状况,有利于肺功能的恢复。营养不良的发病机制是多方面的,采取综合干预,包括常规治疗、运动训练及营养支持治疗等综合治疗可能会获得更好的临床效果。在今后的临床工作中,不断完善COPD患者的营养评估方法,巩固患者个体化MNT的疗效。◇
[1]Han MK,Muellerova H,Curran-Everett D,et al.GOLD 2011 disrase severity classification in COPD Gene:a prospective cohort study[J]. Lancet Respir Med,2013,1(1):43-50.
[2]Sehgal IS,Dhooria S,Agarwal R. Chronic obstructive pulmonary disease and malnutrition in developing countries[J]. Curr Opin Pulm Med,2017,23(2):139-148.
[3]中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 《慢性阻塞性肺疾病诊治指南》(2013修订版)[J]. 中华结核和呼吸杂志,2013,36(4):255-264.
[4]Arslan M,Soylu M,Kaner G,et al. Evaluation of malnutrition detected with the Nutritional Risk Screening 2002 (NRS-2002)and the quality of life in hospitalized patients with chronic obstructive pulmonary disease[J]. Hippokratia,2016,20(2):147-152.
[5]Benito-Martinez MDP,La-Serna-Infantes JE,Guarro-Riba M,et al. Nutritional and functional state of patients with chronic obstructive pulmonary disease:effects of oral nutritional supplementation (OFOS study)[J]. Nutr Hosp,2017,34(4):776-783.
[6]顾景范主编. 现代临床营养学(第2版)[M]. 北京:科学出版社,2009.
[7]林志勇,梁志科. COPD营养状态模型对呼吸机蛋白质分解代谢的影响[J]. 中国医药科学,2015,5(5):24-26.
[8]崔金波,万群芳,吴小玲. NRS2002预测无创通气治疗慢性阻塞性肺疾病伴Ⅱ型呼吸衰竭患者临床结局的探讨[J]. 中国实用护理杂志,2014,30(19):10-15.
[9]肖安东.早期肠内肠外联合营养与肠内营养支持治疗COPD急性加重期临床对比研究[J]. 中国伤残医学,2014,22(9):163-164.
[10]van de Bool C,Rutten EPA,van Helvoort A,et al. A randomized clinical trial investigation the efficacy of targeted nutrition as adjunct to exercise training in COPD[J]. J Cachexia Sarcopenia Muscle,2017,8(5):748-758.
