浅谈酸碱理论的发展及其意义
2018-01-16于晓洋罗亚楠杨艳艳
于晓洋,罗亚楠,杨艳艳,金 华,任 红
(吉林化工学院,吉林 吉林 132022)
酸和碱是无机化学中最重要的基本概念之一,在人们的日常生活及工农业生产中都占有重要的地位和意义。人们在认识酸和碱的过程中,逐步发展和创立了多种学说理论[1]。
1 早期的酸碱概念
人们最初对酸碱的认识是从反应现象、特征入手的。当时发现有一类物质在水溶液中表现出强烈的"酸味",人们称之为酸。而把另外一类在水溶液中具有肥皂一样滑腻的物质称为"碱"。当把酸碱物质混合时,它们能相互作用生成既没有酸的特征也没有碱的特征的,并具有盐味的产物。
17世纪末,英国的化学家波义耳(R. Boyle)根据大量实验现象第一次总结提出了朴素的酸碱定义:“凡物质的水溶液能溶解某些金属,与碱接触会失去原有特性,而且能使石蕊试液变红的物质叫酸;凡物质的水溶液有苦涩味,能腐蚀皮肤,与酸接触会失去原有特性,而且能使石蕊试液变蓝的物质叫碱”。
18世纪末,法国化学家拉瓦锡(A. L. Lavoisier)根据他的"燃素"的观点提出"酸素"的说法,所有的酸都含有酸素即氧。
1789年,化学的化学家贝托雷确定了氢氰酸的成分,发现氢氰酸并不含有氧,但是其水溶液却有微弱的酸性,据此说明了酸并不一定含有氧。
1815年,英国化学家戴维(H. Davy)注意到构成酸的关键元素是氢,他认为:“判断一种物质是不是酸,要看它是否含有氢”。
1838年,德国化学家李比希(J. Liebig)认为:"所有的酸都是氢的化合物,但其中的氢必须是能够很容易的被金属所置换的"。这个概念弥补了戴维的不足,也可算作第一个比较满意的酸的定义,而且这个定义一直沿用了50多年,直到现在看起来也基本符合酸的特征,但是却无法解释酸的强弱问题。
到19世纪80年代瑞典化学家阿累尼乌斯(S. A. Arrhenius)提出电离理论,在此基础上,人们才从化学观点认识到酸碱的特征,建立了近代酸碱理论的概念。
2 近代酸碱理论
2.1 酸碱电离理论
1887年,瑞典化学家阿累尼乌斯提出酸碱的电离理论:凡是在水溶液中产生H+的物质叫做酸,在水溶液中产生OH-的物质叫做碱。酸碱中和反应实质就是H+和OH-结合生成中性水分子的过程。该理论是建立在电离理论基础之上的。它从定量的角度描写了酸碱的性质和它们在化学反应中的行为,并由此引出了酸碱强度,电离度,pH等一系列的化学概念,对生产实际和科学研究都有着广泛的应用,在酸碱理论发展史上具有里程碑的意义,使人们对酸碱的认识步入了科学的轨道。
但是该理论的缺陷:只承认提供水溶性OH-的物质是碱,而不承认像Ac-、F-、以及NH3那样的物质也是碱,不能说明HCl和NH3之间的酸碱反应。在解释氨水的碱性时,错误的认为氨水中存在着弱电解质“氢氧化铵”。也不能解释非水质子溶剂和非质子溶剂中的酸碱反应,更不能阐明根本不存在溶剂的酸碱反应体系。比如固态的BaO和液态或者气态的SO3反应生成BaSO4。另外,我们现在也知道,酸在水溶液中也不能产生游离的H+。因为H+是一个半径极小,电荷密度很大的裸核,在水中不可能稳定的存在,以H3O+离子形式存在。
2.2 酸碱溶剂体系理论
1905年,英国化学家富兰克林(E. C. Franklin)提出了酸碱的溶剂理论。该理论认为:凡是能产生该溶剂的特征阳离子的物质是酸,产生该溶剂的特征阴离子的物质是碱。酸碱反应的实质是溶剂的特征阳离子和特征阴离子结合生成溶剂分子。
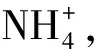
CsSO3和SOCl2在液态SO2中分别按下式解离:

因此CsSO3是碱,而SOCl2是酸,二者可以进行酸碱中和反应和滴定:

该理论的最大缺陷是只能适用于那些可以发生自电离的溶剂体系中。对于发生在烃类和醚类等溶剂中的酸碱反应,溶剂体系理论无法解释,这就可以借助于更具有普遍意义的路易斯酸碱电子理论来说明。
2.3 酸碱质子理论

通过比较酸碱的电离理论,溶剂体系理论和酸碱质子理论可以看出,电离理论只是水作为溶剂时的溶剂体系理论的特例。而质子理论可看做是质子溶剂的溶剂体系理论。而溶剂体系理论可看成是电离理论在其他溶剂中的扩展。溶剂体系理论可以把酸碱概念扩展到完全不涉及质子的溶剂体系中。
2.4 酸碱电子理论

与酸碱电离理论,溶剂体系理论和质子理论相比较,酸碱电子理论有了更大的完善,酸碱摆脱了某种元素的限制,不受溶剂的限制,从结构角度出发,以电子对的授受关系来说明酸碱反应,更能体现物质的本质属性,具有重要的化学价值。然而,由于电子理论定义的酸碱范围过于宽泛,除了氧化还原反应以外,几乎所有的化学反应都能归属到酸碱反应范围内,造成酸碱的特征过于笼统而不易掌握,而且酸碱的强弱没有一个统一的标准,导致纯粹的酸碱电子理论的实际应用反而不方便。

一般说来,软酸和软碱之间的相互作用可以理解为形成共价键。离子的极化能力和变形性越强,形成的共价键越强,化合物越稳定。硬酸和硬碱之间的相互作用可以理解为是形成离子键。由于正负离子之间的静电能与离子间的距离成反比,因此,正负离子的体积越小,硬酸硬碱的相互作用越大,化合物越稳定。而对于软酸和硬碱(或者硬酸和软碱)结合,因为酸和碱各自的键和倾向性不同,不相互匹配,所以作用力弱,化合物的稳定性就小。
2.5 正负离子理论
1938年,前苏联的化学家乌兹洛维奇提出了正负离子理论:任何能中和碱形成盐并放出阳离子或结合阴离子(电子)的物质为酸,任何能中和酸放出阴离子(电子)或结合阳离子的物质为碱。如:

Cl2得到电子,所以是碱,而Na给出电子,所以是酸。
该理论的优点是包含设计任意数目的电子转移反应,不必局限于一对电子的接受反应。它也可包括涉及单电子,三电子转移的氧化还原反应反应。
2.6 氧负离子理论
根据Lux的定义,酸是氧负离子的接受体,碱是氧负离子的给予体,酸碱中和反应为氧负离子的传递过程。
如:

CaO给出O2-,所以是碱,而SO3接受O2-,所以是酸。
Lux的氧负离子理论的定义特别适用于高温下氧化物之间的反应,它在冶金、玻璃陶瓷和硅酸盐领域中有着重要应用。而在其他方面并无用处。
2.7 酸碱理论的共同点
从以上酸碱理论对酸碱的定义中我们可以看出(表1),酸是某种指定的正电荷物种的给予者,或者是某种指定的负电荷物种的接受者;碱是某种指定的负电荷物种的给予者,或者是某种正电荷物种的接受者。

表1 酸碱理论的共同点
3 总结
长期的生产生活实践和科学研究中,随着人们对物质结构的认识不断的深入,人们对酸碱的认识也不断的发展完善,酸碱的定义范围也不断的变化。然而,并非对酸碱所下的定义越广就越有用。每种酸碱理论都有其长处,但也都存在着缺陷。在实际工作中往往必须用不同的酸碱理论来处理不同的问题。人们对于科学的探索是永不止步的,随着科学的不断进步,在酸碱的领域内也必将会产生新的问题和新的理论。
[1] 胡庆莲.酸碱理论的发展[J].山西广播电视大学学报,2006 , 11 (4) :41-42.
[2] 黄一珂,邱晓航.软硬酸碱理论的发展和应用[J].大学化学,2016,31(11),45-50.
[3] 宋天佑,程 鹏,王杏乔,等.无机化学[M]. 北京:高等教育出版社,2014.
