基于分光光度法痕量重金属传感模型和影响因素的研究∗
2018-01-16毕卫红陈俊刚2张胜于腾飞张燕君侯旭涛
毕卫红 陈俊刚2) 张胜 于腾飞 张燕君 侯旭涛
1 引 言
近年来,重金属污染已成为突出的环境问题[1].随着科学技术的发展,海水痕量重金属检测方法与传感技术有了很大的进展.现在常用的检测方法主要包括分光光度法[2]、电感耦合等离子体原子发射光谱法[3]、阳极溶出伏安法[4]、原子吸收光谱法[5]、发光分析法[6]等,每种检测方法在测量时只能测一种金属,且没有考虑环境参数变化与测量条件变化对测量结果的影响.为此,我们对多种重金属同时测量方法进行了多年的研究.本文主要以四种重金属镉(Cd2+)、铜(Cu2+)、锌(Zn2+)、镍(Ni2+)离子溶液为例,研究四种参量单独作用时其光谱特性和特征峰吸光度的变化规律;在此基础上研究四种参量共同作用时其光谱特性、各特征峰总吸光度与被测量间的变化规律;以及在使用显色试剂情况下,不同pH值、温度、时间、显色剂量对吸光度的影响[7],为提高痕量重金属传感器的精度奠定基础.
2 水体重金属传感机理与传感模型
本文采用分光光度法实现对水体中的可溶态重金属镉(Cd2+)、铜(Cu2+)、锌(Zn2+)、镍(Ni2+)测量.由于金属水合离子本身的吸光系数值都很小,故测量时选择加入一定量的显色试剂,与待测离子进行显色反应,再测量反应后的混合液体的吸光度,进而分析待测溶液的重金属离子的浓度.依据朗伯-比尔定律,即一束平行单色光通过均匀的有色溶液时,溶液的吸光度与溶液中有色物质的浓度及透过溶液光程的乘积成正比,其数学表达式为

(1)式中,A为吸光度,I为入射光强度,It为透射光强度;K为摩尔吸光系数(L·mol−1·cm−1),b为液层厚度(cm),c为溶液浓度(mol·L−1).对于不相互作用的多组分体系,吸光度具有加和性,即总的吸光度等于各组分吸光度之和,其数学表达式为[8]
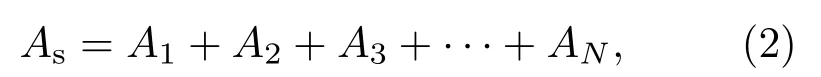
(2)式中As是总的吸光度,A1,A2,A3,···,AN是各组分吸光度.由(2)式可知,依据吸光度的加和性可进行多组分分析与多参数测量.
为确定四种金属离子浓度的特征谱并分析其浓度与吸光度的关系,搭建了实验平台,如图1所示,其中卤素光源波长范围为200—1100 nm.
通过实验测得了四种重金属离子Cd2+,Cu2+,Zn2+,Ni2+在不同波长的吸光度,显色后的Cd2+,Cu2+,Zn2+,Ni2+吸光光谱如图2所示.
从图2可得四种离子峰值波长分别出现在579.67,604.53,626.21和656.16 nm处,但光谱重叠较严重,且各自吸光光谱相互干扰.因此,本文通过实验确定不同重金属离子间的相互影响规律.实验中,分别取Cd2+,Cu2+,Zn2+,Ni2+金属离子溶液各自最大吸收波长580.81,604.31,626.00和658.24 nm,对应中心波长为575,605,620和650 nm的特征波长进行吸光度测量,测得不同重金属离子在不同波长处的吸光度如图3所示.

图1 实验原理图Fig.1.Experimental schematics.

图2 Cd2+,Cu2+,Zn2+,Ni2+显色溶液的吸光光谱Fig.2.Absorption spectrum of coloring solution of Cd2+,Cu2+,Zn2+,Ni2+.
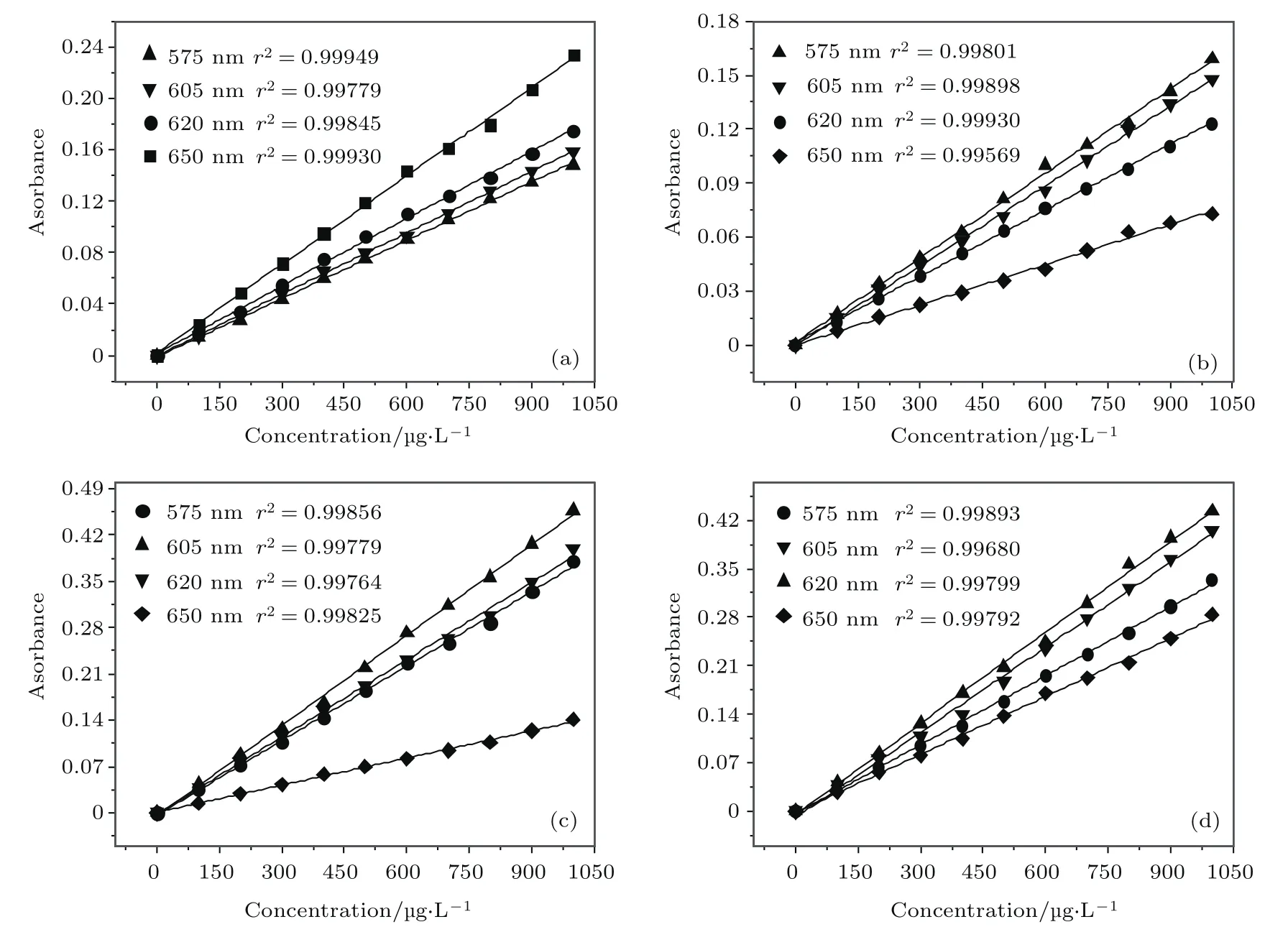
图3 四种离子在不同波长下的吸光度拟合 (a)Cd2+四波长吸光度拟合曲线;(b)Ni2+四波长吸光度拟合曲线;(c)Cu2+四波长吸光度拟合曲线;(d)Zn2+四波长吸光度拟合曲线Fig.3.Absorbance fitting of four kinds of ions at different wavelengths:(a)Four-wavelength absorbance curve of Cd2+;(b)four-wavelength absorbance curve of Ni2+;(c)four-wavelength absorbance curve of Cu2+;(d)fourwavelength absorbance curve of Zn2+.
由图3可知,各种离子浓度与吸光度间是线性关系.采用多元线性回归与偏最小二乘法相结合进行建模,得其回归方程为:

方程(3)中y1,y2,y3,y4分别为混合溶液中Cd2+,Cu2+,Zn2+,Ni2+的浓度,单位为µg/L;x1,x2,x3,x4分别代表Cd2+,Cu2+,Zn2+,Ni2+共存显色后的溶液在575,605,620和650 nm四个中心波长的总吸光度.利用此方程,通过测得的各特征波长的总吸光度计算得到水体中所含Cd2+,Cu2+,Zn2+,Ni2+离子的浓度.
3 环境参数与测量条件对重金属测量值的影响
在实际应用中,被测水样的pH值、温度、显色时间、盐度以及显色剂量等因素变化可能对离子吸光度的产生不容忽略的影响.因此,本文重点研究Cd2+,Cu2+,Zn2+,Ni2+四种重金属离子溶液在不同pH、温度、显色时间以及显色剂量下的吸光度的变化规律,以探索基于分光光度法的环境参数与测量条件对重金属痕量传感器的影响规律.
3.1 实验平台与实验溶液配制
实验平台继续使用图1所示系统.由于显色后的Cd2+,Cu2+,Zn2+,Ni2+吸光光谱的吸收峰出现在550—650 nm之间,因此选用光谱范围200—1100 nm的卤素光源,并分别选用中心波长为575,605,620和650 nm的滤光片对光源滤光得到含特征波长的检测光进行吸光度测量;实验所用的Cd2+,Cu2+,Zn2+,Ni2+重金属离子的标准溶液来自于国家标准物质中心,浓度为100µg/mL.取上述四种重金属离子溶液各10 mL,与显色剂、缓冲剂,按10:2:5的比例混匀后静置待测.其中,显色剂选用邻2-(2-羟基-5-磺基苯偶氮)亚苄基肼基苯甲酸,缓冲剂选用硼酸氯化钾氢氧化钠溶液.
3.2 实验步骤
将3.1节中本制好的待测溶液分别放入比色皿中,依次改变Cd2+,Cu2+,Zn2+,Ni2+溶液的pH值、温度、时间、显色剂量等参量;让检测光经过比色皿溶液形成透谢光,将透射光送入光谱仪,再通过计算机软件分析透射光谱的变化,从而分析出Cd2+,Cu2+,Zn2+,Ni2+在不同条件下吸光度发生的变化.
3.3 影响因素
3.3.1 pH值对吸光度的影响
本文对溶液中金属离子浓度的测量是基于朗伯-比尔定律,通过测量溶液中的金属离子与显色剂生成络合物对光的吸收实现重金属离子浓度的测量.由于被测溶液在酸性环境或碱性环境下,络合反应的程度不同,使得同一金属离子浓度在不同pH值条件下测得的吸光度不同,从而实现金属离子浓度的准确测量.因此,本节通过实验研究pH值对吸光度影响.
实验1设定Cd2+光程为2 cm,其他离子光程为1 cm;在25 mL容量瓶中分别加入5 mL缓冲液,2 mL显色液,然后再分别加入10 mL浓度为0,200,400,600,800,1000µg/L的Cd2+,Cu2+,Zn2+,Ni2+金属离子溶液.分别取中心波长为575,605,620和650 nm的滤光片进行吸光度测量,Zn2+,Cu2+,Ni2+,Cd2+浓度-吸光度各点对应值及拟合曲线如图4所示.
由图4可得Zn2+,Cu2+,Ni2+,Cd2+四种离子浓度与吸光度的关系是线性的.设Zn2+,Cu2+,Ni2+,Cd2+四种离子的浓度分别为y5,y6,y7,y8,单位为µg/L,其对应的特征吸光度为x5,x6,x7,x8,则由图4曲线得:


图4 四种离子浓度与吸光度的关系Fig.4.Relationship between four kinds of ion concentration and absorbance.
实验2取浓度为500µg/L的Cd2+,Cu2+,Zn2+,Ni2+溶液若干份,每份体积为10 mL,与显色剂、缓冲剂按比例混匀,配置9份pH值均匀分布在5—9之间的各重金属溶液.在Cd2+,Cu2+,Zn2+,Ni2+重金属离子的最佳吸收波长,得到pH值与吸光度数据关系如图5所示.
实验结果表明:对于不同的重金属离子,显色剂显色性能的最佳状态出现在不同pH值区间,对应吸光度达到峰值,其中Zn2+吸光度在pH=7.0—8.5时吸光度达到峰值,Cu2+吸光度在pH=6.5—7.5时吸光度达到峰值,Ni2+吸光度在pH=7.0—8.0时吸光度达到峰值,Cd2+吸光度在pH=7.5—8.5时吸光度达到峰值.

图5 Zn2+,Cu2+,Ni2+,Cd2+的pH与吸光度的关系Fig.5.The relationship between pH and absorbance of Zn2+,Cu2+,Ni2+,Cd2+.

图6 四种离子浓度随pH值变化Fig.6.pH value changes caused by the four kinds of ion concentration changes in the relationship.
分析相同金属离子浓度在不同pH条件下吸光度出现峰的主要原因是测量过程的物理化学反应.以铜为例,当pH较低时,主要受H+离子的影响而使得产生的络合物浓度变低;而当pH较高时,OH−离子与Cd2+生成的Cu(OH)2会沉淀,也会使络合物浓度变低[9].
通过上述实验可知重金属离子的吸光度随着pH的改变而改变,导致直接测量得离子浓度值并不是真实值.因此在海水痕量重金属测量时,可以根据海水的pH值对测得的离子浓度值进行校正,使之更加接近真实值,提高测量精度.下面研究针对pH值影响的校正模型.
根据(4)式可计算出随着pH值变化溶液中所含的离子浓度,从而得到pH值变化时对应的溶液浓度的变化量,如图6所示.
设Zn2+,Cu2+,Ni2+,Cd2+四种离子浓度变化量分别为y9,y10,y11,y12,单位为µg/L,对应的pH值变量为xpH,则由图6所示曲线得到多项式拟合方程(pH值影响的校正模型)为

根据方程(5)对pH值的影响进行补偿,补偿后的效果如图7所示.

图7 pH补偿结果Fig.7.pH compensation results.
3.3.2 温度、时间对吸光度的影响
对金属离子测量过程中络合反应生成的络合物并不稳定,故需研究测量条件(温度与时间)对测量结果的影响.实验中,分别在常温(14°C)和低温(4°C)两种条件下,连续3 d、每次间隔8 h,对Cd2+,Cu2+,Zn2+,Ni2+显色溶液的吸光值进行测定,其结果如图8所示.
从图8可知,若在短时间内完成溶液的测定,则可以忽略温度和时间对吸光度的影响.若将溶液长时间存放,则由于显色剂失效,溶液颜色逐渐消失.实验表明:在加显色剂2 h内进行测量,其温度和时间的变化不会造成测量结果的误差.
3.3.3 显色剂量对吸光度的影响
由于溶液的吸光度与溶液中显色物质的浓度有关,显色剂用量是影响显色反应的重要因素,故本节通过实验研究在显色剂用量不同时吸光度的变化规律,以确定最佳显色剂量.实验中,取配制好的浓度为500µg/L的溶液若干份,加入缓冲剂,以0.5 mL为单位逐渐向溶液中添加显色剂至4.0 mL,在最佳吸收波长处测量吸光度.得到显色剂量与吸光度的关系如图9所示.
由图9实验结果可知,各金属离子的吸光度随显色剂的增加而先增加,随后到达一相对稳定区间,之后开始下降,其中Zn2+吸光度在显色液用量1.5—2.5 mL范围较稳定,Cu2+吸光度在显色液用量1.5—2.5 mL范围较稳定,Ni2+吸光度在显色液用量1.5—3.0 mL范围较稳定,Cd2+吸光度在显色液用量2—2.5 mL范围较稳定.而产生这种变化规律的原因在于:随着开始时显色剂剂量的增加,络合反应在增加,使显色加强效果不断加大,被测溶液的吸光度不断增加,而显色剂与缓冲剂中的OH−离子与Cd2+生成的Cu(OH)2沉淀物很少,对显色消减效果影响较小;再增加显色剂量,两者将进入平衡状态使吸光度到达稳定区;若再进一步增加显色剂量,显色消减效果大于增强效果,吸光度反而随剂量的增加而减少,显色剂本底颜色将干扰实验结果.综合考虑实验结果,选显色剂为2.0 mL时测量效果最佳.
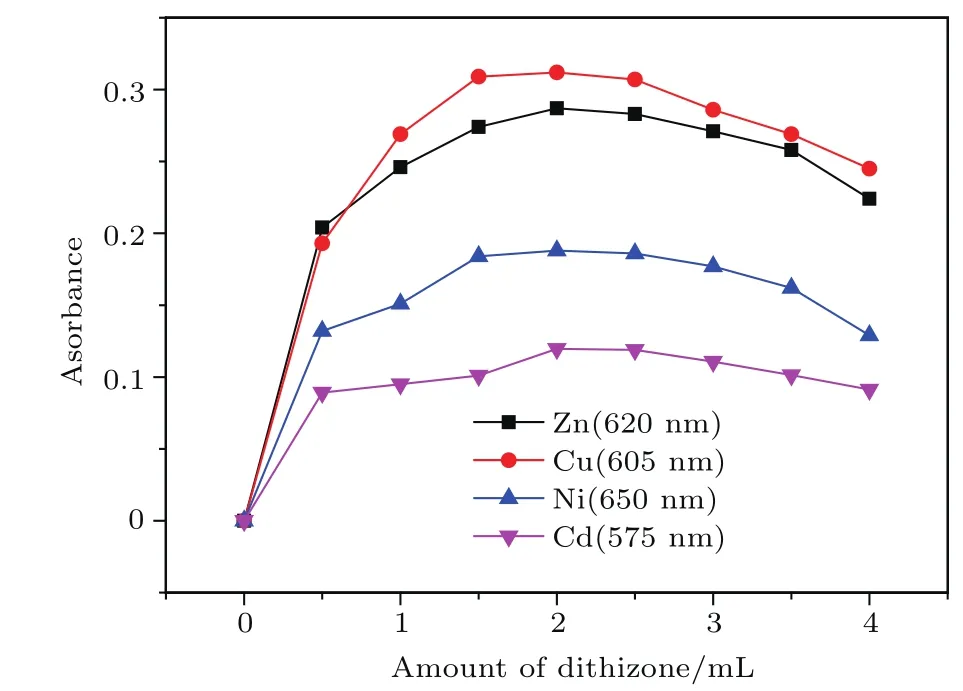
图9 显色剂量与Cu2+,Zn2+,Ni2+,Cd2+吸光度的关系Fig.9.The relationship between the color-developing dose and the absorbance of Cu2+,Zn2+,Ni2+and Cd2+.
4 结 论
本文在建立基于分光光度法痕量重金属(Cu2+,Zn2+,Ni2+,Cd2+)传感模型的基础上,重点对其测量的环境条件与测量影响因素的条件进行研究.采用分光光度法,选择特征波长为575,605,620和650 nm可以同时测量Cu2+,Zn2+,Ni2+,Cd2+的浓度;在测量重金属离子浓度时,温度与反应时间中短时间内的测量影响较小,可忽略不计;pH=7时测量结果最佳,随着pH变大或变小,络合物浓度均变小,溶液的吸光度则随之变小,从而导致测得溶液离子浓度的灵敏度变差;通过实验给出校正方程,利用此方程可以对测量的浓度值进行补偿,使测量结果接近真实值,提高测量精度;显色剂量的影响研究表明,Zn2+吸光度在显色剂剂量为2 mL附近达到最大,Cu2+吸光度在显色剂剂量为1.5—2.5 mL范围达到最大,Ni2+吸光度在显色液用量1.5—3.0 mL范围达到最大,Cd2+吸光度在显色液用量2—2.5 mL范围达到最大.四种离子同时测量时,显色剂量为2 mL时测量结果最佳;总体而言,测量不同的重金属离子时,在先用最佳显色剂量的同时还需测定pH值,以获得稳定的、理想的吸光度,并对所得值进行适当修正,达到水中痕量重金属的精确测量.
[1]Mao T Y,Dai M X,Peng S T,Li G L 2009Trans.Tianjin Univ.42817(in Chinese)[毛天宇,戴明新,彭士涛,李广楼2009天津大学学报42817]
[2]Wang Y R,Xing X T,RenH Q,Yu Y,Fei B H 2012Spectrosc.Spectral Anal.321685(in Chinese)[王玉荣,邢新婷,任海青,余雁,费本华 2012光谱学与光谱分析321685]
[3]Tagle M V,Pozebon D,García R H,Piñar F C,Alfonso M P 2011Spectrosc.Lett.42138
[4]Fan Q J,Du G R,Tu J R 2005Trans.Tianjin Univ.46145(in Chinese)(in Chinese)[范清杰,杜国荣,涂家润2013天津大学学报46145]
[5]Lin J M,Yao J X,Zhao W Y 2013Spectrosc.Spectral Anal.331357(in Chinese)[林建梅,姚俊学,赵文岩2013光谱学与光谱分析331357]
[6]Su Q M,Qin W 2009Marine Sci.33105(in Chinese)[苏庆梅,秦伟 2009海洋科学 33105]
[7]Bi W H,Li J G,Wu G Q,Fu X H,Fu G W 2014Spectrosc.Spectral Anal.341(in Chinese)[毕卫红,李建国,吴国庆,付兴虎,付广伟2014光谱学与光谱分析341]
[8]Yu T F,Zhang Y J,Bi W H,Fu X H,Fu G W,Gao M M 2015Opto-Electron.Engineer.4288(in Chinese)[于腾飞,张燕君,毕卫红,付兴虎,付广伟,高明明 2015光电工程4288]
[9]Lu F S,Zhang C G,Wang G T 1989J.Shandong Univ.2441(in Chinese)[路福绥,张春光,王果庭 1989山东大学学报2441]
