腹腔镜与开腹全结肠系膜切除术在右半结肠癌中的临床疗效分析
2018-01-16张剑波重庆医科大学附属第二医院胃肠肛肠外科重庆400010
于 军,朱 鹏,张剑波(重庆医科大学附属第二医院胃肠肛肠外科,重庆400010)
20世纪80年代,全直肠系膜切除术的提出及广泛应用使直肠癌患者,尤其是中低位直肠癌患者的术后局部复发率及生存率明显提高,已成为直肠癌手术治疗的“金标准”。而结肠癌由于缺乏规范化及标准化手术方式,术后复发率及生存率一直未明显改善。2009年,德国学者HOHENBERGER等[1]根据全直肠系膜切除术的胚胎发育解剖学理论,率先提出了全结肠系膜切除术(CME)的手术理念,并逐渐被国内外胃肠外科医生所接受,并有可能成为结肠癌手术治疗的质量控制标准化术式。在结肠癌患者中,由于右半结肠供应血管变异较多,淋巴结清扫相对于其他部位的肿瘤难度大,对主刀医生的技术要求更高。本研究选取本院收治的行CME的右半结肠癌患者90例,分别采用腹腔镜与开腹CME治疗,旨在比较腹腔镜与开腹CME治疗右半结肠癌的临床疗效。
1 资料与方法
1.1 资料
1.1.1 一般资料 选取2012年1月至2014年1月本院收治的行CME的右半结肠癌患者90例。所有患者术前均经电子结肠镜检查证实为右半结肠恶性肿瘤,肠镜病理检查结果为结肠腺癌;且患者术前影像学、肿瘤标志物、临床生化检查均符合结肠癌临床表现,未见远处转移。术前充分告知患者及家属手术风险并签署知情同意书,根据患者及家属意愿选择手术方式,其中腹腔镜组45例,开腹组45例。所有手术均为同一组医生主刀。本研究已上报本院伦理委员会并得到批准。两组患者性别、年龄、肿瘤部位、病理类型等一般资料比较,差异均无统计学意义(P>0.05)。见表 1。

表1 两组患者一般资料比较
1.1.2 排除标准 (1)右半结肠癌合并出血、梗阻等需急诊手术者;(2)多源性结肠癌、远处转移及腹腔广泛转移者;(3)既往有腹腔手术史且腹腔粘连严重者;(4)术前经麻醉医师评估不能耐受手术者。
1.2 方法
1.2.1 手术方法 (1)腹腔镜组。术前进行常规手术准备,采用气管插管全身麻醉。患者取仰卧位,双腿分开呈“大”字形。术者位于患者左侧,第一助手位于患者右侧,扶镜手位于患者两腿之间。脐上缘置10 mm戳卡并置入观察镜,左侧锁骨中线肋缘下5 cm置入12 mm戳卡作为主操作孔,左下腹反麦氏点处置入5 mm戳卡作为辅助操作孔,右侧对应位置置入5 mm戳卡作为辅助操作孔。患者取头低脚高位,向左侧稍倾斜。通过腹腔镜旋转,观察盆腔、肝脏、大网膜及肠系膜有无转移病灶,探查肿瘤位置及大小。将小肠拨向左上腹,暴露术野,辨别回结肠血管位置。自回结肠血管下方自然褶皱处切开肠系膜,进入融合筋膜。分离至回结肠血管根部,找到肠系膜上静脉及其表面腹膜,打开血管鞘,清扫周围淋巴组织及脂肪,向头侧分离。进入胰腺十二指肠前筋膜,到达胰腺上缘横结肠系膜根部。显露回结肠动静脉、右结肠动静脉(如果存在)、中结肠动静脉右侧分支(肿瘤位于肝曲,需于根部结扎)、胃肠静脉干副右结肠静脉等,清扫根部淋巴组织,于根部高位结扎并离断。于横结肠系膜根部切断右半侧,进入网膜囊。于胃网膜血管弓下方的右侧胃结肠韧带、右侧大网膜及肝结肠韧带等向右侧分离。对肝曲肿瘤,需于根部离断胃网膜右动静脉,清扫幽门下淋巴组织,并切除肿瘤远端10~15 cm大网膜。自回盲部外侧黄白交界线向肝曲游离,于上述操作汇合,完成腹腔镜操作。于上腹部作一5 cm左右切口,置入切割保护套,取出已游离肠管,切除病变肠管,行横结肠、回肠侧侧吻合或端侧吻合。检查腹腔无活动性出血后于吻合口处放置引流管一根,逐层关闭腹腔,术毕。(2)开腹组。开腹组取腹部正中切口15 cm,置入切割保护套,其余操作与腹腔镜组相同。
1.2.2 观察指标 (1)术中观察指标:观察两组患者手术时间、术中出血量等。(2)病理观察指标:观察两组患者清扫淋巴结数目。(3)术后观察指标:观察两组患者术后排气及排便时间、住院时间、并发症发生情况等。
1.2.3 随访 术后每3个月随访1次,随访方法为电话、门诊及入院复查,随访内容为体格检查,以及消化道肿瘤标志物、腹部彩色多普勒超声或胸腹联合CT检查等。发现患者肿瘤复发、转移或死亡则终止随访。随访3年。其中腹腔镜组失访2例,开腹组失访3例。随访率为94.44%(85/90)。比较两组患者局部复发、生存率等。
1.3 统计学处理 应用SPSS 21.0统计软件进行数据分析,计量资料以±s表示,组间比较采用独立样本t检验;计数资料以率或构成比表示,采用χ2检验、Kaplan-Meier法、Log-rank法等。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术中、病理、术后观察指标比较 两组患者手术时间比较,差异无统计学意义(P>0.05);腹腔镜组患者术中出血量明显少于开腹,术后排气及排便时间、住院时间均明显短于开腹组,差异均有统计学意义(P<0.05)。两组患者清扫淋巴结数目比较,差异无统计学意义(P>0.05)。见表 2。
表2 两组患者术中、病理、术后观察指标比较(±s)
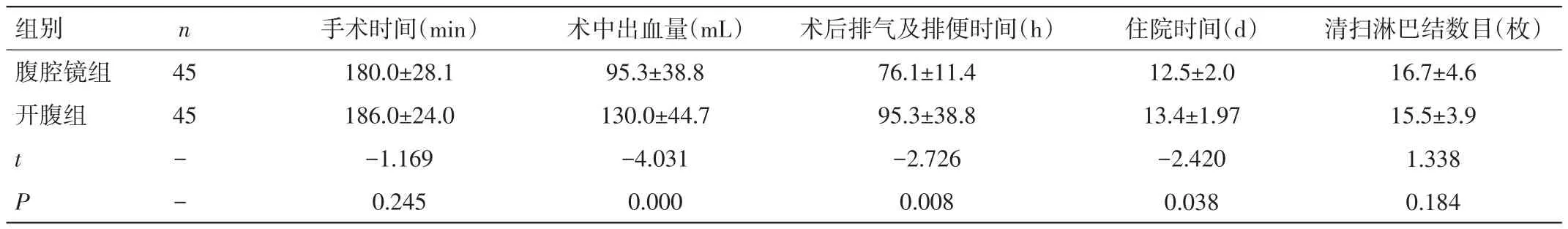
表2 两组患者术中、病理、术后观察指标比较(±s)
注:-表示无此项
组别 n腹腔镜组 45开腹组 45 t-P-手术时间(min)180.0±28.1 186.0±24.0-1.169 0.245术中出血量(mL)95.3±38.8 130.0±44.7-4.031 0.000术后排气及排便时间(h)76.1±11.4 95.3±38.8-2.726 0.008住院时间(d)12.5±2.0 13.4±1.97-2.420 0.038清扫淋巴结数目(枚)16.7±4.6 15.5±3.9 1.338 0.184
2.2 两组患者术后并发症发生情况比较 腹腔镜组患者中发生并发症7例(15.56%),其中切口感染2例,腹泻2例,肠梗阻1例,淋巴漏2例;开腹组患者中发生并发症9例(20.00%),其中切口感染4例,腹泻1例,吻合口漏1例,肠梗阻2例,淋巴漏1例。两组患者术后并发症发生率比较,差异无统计学意义(χ2=0.304,P=0.581)。
2.3 两组患者术后3年局部复发及生存率比较 腹腔镜组患者中3年局部复发2例(4.44%);开腹组患者中3年局部复发3例(6.67%)。腹腔镜组患者3年生存率为88.89%(40/45),开腹组患者3年生存率为84.44%(38/45),两组患者3年局部复发及生存率比较,差异均无统计学意义(P>0.05)。
3 讨 论
在我国,随着经济、社会的快速发展,人们饮食结构改变、生活节奏加快、环境污染及家族遗传等各种原因导致结直肠癌发病率明显上升,且呈年轻化趋势。CHEN等[2]通过对中国癌症中心肿瘤登记数据库中2009—2011年相关数据分析发现,国内结直肠癌发病率男性居恶性肿瘤的第5位,女性居恶性肿瘤的第4位,病死率在所有癌症中居第5位。手术仍是治疗结直肠癌的主要方式。
随着腹腔镜技术的日益成熟,已广泛于胃肠外科。腹腔镜手术相对传统开腹手术具有独特的优势,通过腹腔镜30°镜头的放大及旋转作用,一方面可明确各结构的位置,做到更加精细的解剖,减少术中出血及副损伤;另一方面有利于寻找Todlt间隙,完整切除系膜,避免造成癌细胞残留。另外,腹腔镜手术不需要取长切口暴露手术视野,仅需作一5 cm左右切口,取出肠管完整吻合,不损伤腹壁肌肉、血管等组织,切口小,疼痛轻,有利于患者术后较早下床活动,加快术后恢复。云文耀等[3]研究发现,腹腔镜CME组患者术中出血量、术后胃肠道恢复时间、住院时间均明显优于开腹CME组,且两组患者术后并发症发生率比较,差异无统计学意义(P>0.05)。
结肠系膜与直肠系膜相似,其系膜中包含了脂肪组织、血管和淋巴等[4]。CME要求在结肠脏层筋膜与壁层筋膜之间锐性分离,完整切除结肠系膜,于血管根部进行高位结扎,最大限度地清扫区域淋巴组织,减少肿瘤细胞扩散,降低肿瘤复发、转移率[5]。在腹腔镜作用下,主刀医生可更容易辨别筋膜的层次结构,使手术操作层面在升结肠系膜后叶-肾前筋膜间隙、升结肠系膜后叶-胰头十二指肠前叶间隙与右半横结肠系膜后叶-右侧胃背系膜间隙中,保护了系膜完整性。另外,血管鞘是包裹在动静脉外与血管外膜隔着少许稀疏组织的一层致密结缔组织,其内包含毛细血管、毛细淋巴管和神经纤维。血管鞘内的淋巴可能有部分肿瘤细胞存在。血管鞘内淋巴组织清扫易损伤血管,对主刀医生技术要求更高,难度更大。腹腔镜放大了组织结构,更易清扫血管鞘内淋巴组织,且不损伤血管,更彻底地清除癌细胞。
BAE等[6]对265例行右半结肠癌根治术患者进行了研究,结果显示,腹腔镜CME组患者清扫淋巴结数目(27枚)与开腹CME组(28枚)比较,差异无统计学意义(P=0.337)。2015年,HUANG 等[7]对 102例分别行腹腔镜CME和开腹CME手术的患者进行了研究,结果显示,腹腔镜CME组患者清扫淋巴结数目[(14.0±6.0)枚]与开腹CME组[(13.0±5.0)枚]比较,差异无统计学意义(P=0.313)。然而,殷放等[8]报道,腹腔镜CME组患者清扫淋巴结数目[(23.6±5.8)枚]明显多于开腹CME组[(17.5±4.6)枚],差异有统计学意义(P=0.000)。杨卫华等[9]研究同样提示,腹腔镜CME组患者清扫淋巴结数目[(22.1±7.8)枚]明显多于开腹CME组[(18.6±4.3)枚],差异有统计学意义(P=0.017)。作者认为,上述结果出现差异的原因可能与不同术者及病理医生检查结果有关。总之,在清扫淋巴结方面,腹腔镜CME手术不劣于开腹CME。
局部复发及生存率是评价CME远期疗效的指标。HOHENBERGER等[1]通过回顾性分析大量病例资料发现,患者5年局部复发率由开腹CME的6.50%下降至腹腔镜CME的3.60%,5年生存率由开腹CME的82.10%上升至腹腔镜CME的89.10%。2012年,国内孙艳武等[10]报道,腹腔镜CME与开腹CME结肠癌患者局部复发率分别为 6.10%、7.90%。KILLEEN等[11]报道,腹腔镜CME结肠癌患者局部复发率为4.50%。XIAO等[12]报道,在右半结肠癌中腹腔镜CME联合D3淋巴结清扫的3年无病生存率为86.50%,3年总体生存率为93.70%。云文耀等[3]报道,腹腔镜CME组患者3年生存率为80.20%,开腹CME组为75.00%,但两组比较,差异无统计学意义(P>0.05)。
本研究结果显示,腹腔镜组患者术中出血量、术后排气及排便时间、住院时间均明显优于开腹组,差异均有统计学意义(P<0.05);两组患者手术时间、清扫淋巴结数目、术后并发症发生率、3年局部复发及生存率比较,差异均无统计学意义(P>0.05)。
综上所述,腹腔镜CME在治疗右半结肠癌中的根治效果基本等同于开腹手术,且具有创伤小、出血少、恢复快等优点。但本研究病例尚少,尚需多中心、前瞻性、随机、对照试验进一步验证。
[1]HOHENBERGER W,WEBER K,MATZEL K,et al.Standardized surgery for coloniccancer:completemesocolicexcisionandcentralligation--technical notes and outcome[J].Colorectal Dis,2009,11(4):354-364.
[2]CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3]云文耀,湛文龙,吴礼武,等.腹腔镜联合全结肠系膜切除术在右半结肠癌根治术中的临床应用[J].中华普通外科学文献,2016,10(6):424-427.
[4]叶颖江,王杉.从腹盆腔系膜,筋膜,间隙解剖谈结直肠癌规范化外科治疗[J].中国实用外科杂志,2012,32(9):706-708.
[5]金留根,谢立飞,费伯健,等.腹腔镜完整结肠系膜切除在右半结肠癌根治术的应用[J].江苏医药,2016,42(3):351-352.
[6]BAE SU,SAKLANI AP,LIM DR,et al.Laparoscopic-assisted versus open complete mesocolic excision and central vascular ligation for rightsided colon cancer[J].Ann Surg Oncol,2014,21(7):2288-2294.
[7]HUANG JL,WEI HB,FANG JF,et al.Comparison of laparoscopic versus open complete mesocolic excision for right colon cancer[J].Int J Surg,2015,23(Pt A):12-17.
[8]殷放,翁泽滨,岑宏,等.腹腔镜右半结肠癌根治术中完整结肠系膜切除的应用[J].中华腔镜外科杂志,2015,8(3):19-22.
[9]杨卫华,高愫,张松柏.全结肠系膜切除术在腹腔镜辅助右半结肠癌根治术中的应用[J].中国微创外科杂志,2015,15(4):318-320.
[10]孙艳武,池畔,林惠铭,等.腹腔镜与开腹完整结肠系膜切除术的疗效比较[J].中华胃肠外科杂志,2012,15(1):24-27.
[11]KILLEEN S,MANNION M,DEVANEY A,et al.Complete mesocolic resection and extended lymphadenectomy for colon cancer:a systematic review[J].Colorectal Dis,2014,16(8):577-594.
[12]XIAO Y,QIU H,WU B,et al.Outcome of laparoscopic radical right hemicolectomy with complete mesocolic resection and D3 lymphadenectomy[J].Zhonghua Wai Ke Za Zhi,2014,52(4):249-253.
