肺部纯磨玻璃样病变的诊断与病理分型
2018-01-16易和强
易和强,茅 腾
肺癌是我国影响健康的几大恶性肿瘤之一,由于其临床表现无特异性、诊疗技术的相对落后,导致早期诊断、早期治疗很难得到实施,绝大多数患者就诊时已经失去最佳治疗时机,故5年生存率极低,死亡率高。随着医疗技术的发展及人们健康意识的提高,特别是高分辨CT的问世,越来越多的早期肺癌患者被发现,同时得到了及时治疗,取得了很好的疗效。早期肺癌在高分辨螺旋CT上主要表现为GGO,而根据有无实性成分,将其分为纯GGO(pGGO)和混合性GGO(mGGO)。同时根据国际肺癌研究学会(IASLC)、美国胸科学会(ATS) 和欧洲呼吸学会、(ERS)公布的肺腺癌国际学科病理分类[1],将肺部GGO分为原位腺癌(AIS)、微浸润腺癌(MIA)、浸润性腺癌(IAC)及目前被认为癌前病变的不典型性腺瘤样增生(AAH);本文通过对92例病例的回顾性研究,了解pGGO的影像学表现与病理分型之间的关系及临床治疗方式的选择。
1 一般资料和方法
1.1 一般资料 根据国际肺癌研究学会(IASLC)、美国胸科学会(ATS) 和欧洲呼吸学会(ERS)公布的肺腺癌国际学科分类对纯磨玻璃样病灶的定义,收集2016年1月至2017年7月,上海胸科医院某位带组教授19个月所收治的经过术前严格筛选考虑恶性肿瘤可能性较大的72例肺部纯磨玻璃样病灶患者行胸腔镜手术治疗,共切除pGGO病灶92个,术后病理提示均为癌前病变及恶性肿瘤;不典型腺瘤样增生(AAH)6例;恶性肿瘤86例,其中原位癌(AIS)33例、微浸润性腺癌(MIA)35例、浸润性腺癌18例。术前均行高分辨率CT薄层扫描胸部,病灶在肺窗上最大直径应用CT系统上直径测量系统进行测量,以厘米作为单位;病灶在肺窗上的平均CT值,均应用CT上图片处理系统中的CT值测量系统进行测量,对于每一个病灶,在3~4个不同部位测量不同的CT值,取其平均值作为该病灶的记录CT值,以HU作为单位,显示:病灶均为周围型;位于左肺34例(左上肺18例,左下肺16例),右肺38例(右上肺18例,右下肺8例,右中叶12例);多发性pGGO 17例,单发55例。病灶直径≤0.5 cm 9例,病灶直径0.5~1 cm 46例,病灶直径1-1.5 cm 28例,病灶直径1.5-2 cm 4例,病灶直径2.5-3 cm 5例;病灶CT值<-600HU 33例,病灶CT值-600~ -400 45例,病灶CT值-400~ -200 14例,男23例,女49例;年龄34~75岁,平均54岁。吸烟者18例。7例有咳嗽、咳痰、胸闷等症状,65例体检发现无明显症状。
1.2统计学方法 统计资料采用SPSS 13.0统计软件进行统计处理。成组设计两样本比较的秩和检验,P <0.05为差异有统计学意义;2×2列联表资料的卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 将收集的92例pGGO的统计分析,6例病理提示为AAH的pGGO直径总和为3.1 cm,平均直径为0.52 cm;33例病理提示为AIS的pGGO直径总和为27.2 cm,平均直径为0.82 cm;35例病理提示为MIA的pGGO直径总和为29 cm,平均直径为0.83 cm;18例病理提示为IAC的pGGO直径总和为27.8 cm,平均直径为1.54 cm。对92例pGGO的直径进行秩和检验可知四组平均直径不全相等(P<0.05),再将四组直径分别通过秩和检验进行两两比较,AAH平均直径与AIS、MIA、IAC均存在差异(P均小于0.05),由此可知,AAH平均直径明显小于其他三组平均直径;AIS与MIA的平均直径没有明显差异(P<0.05);IAC的平均直径均大于AIS和MIA(P<0.05),见图1。
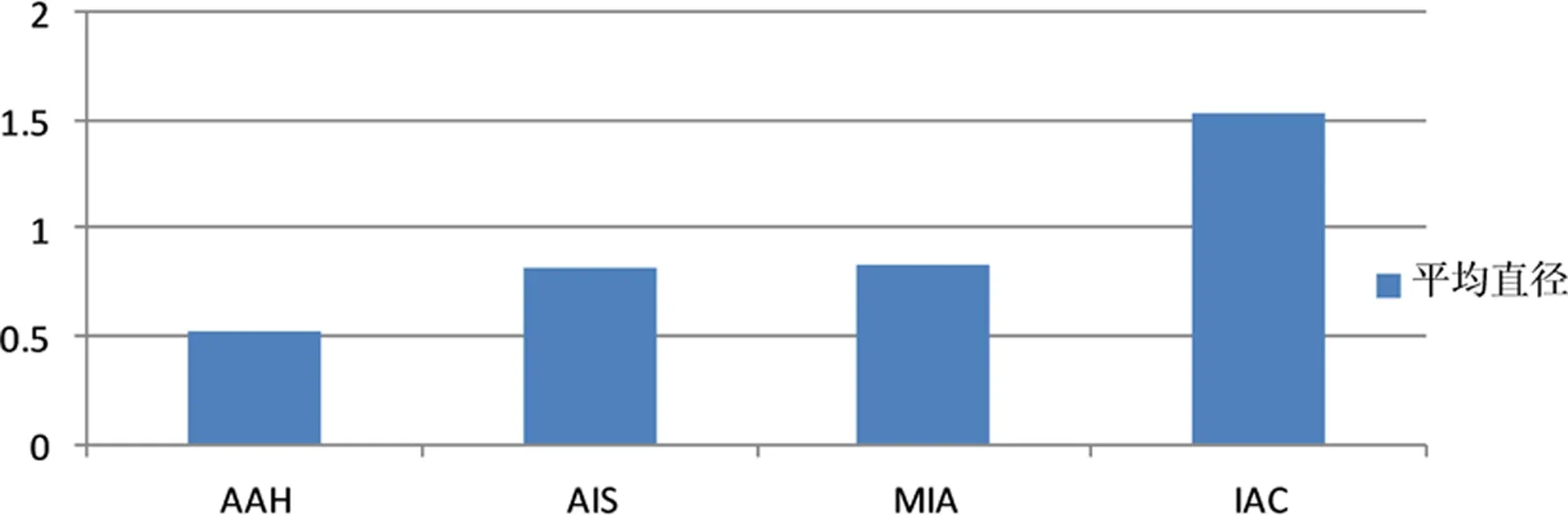
图1平均直径(cm)
2.2 同时对每一组病例求95%参考范围,AAH的参考范围为 <0.9 cm; AIC的参考范围为0.92cm~2.91 cm;由于AIS和MIA无明显差异,故统一求95%参考值范围为0.43 cm~1.30 cm,见图2。
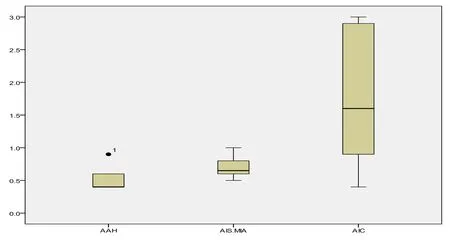
图295%参考范围
2.3 将收集的92例pGGO的CT值进行统计分析,6例病理提示为AAH的pGGO CT值总和为 -4031Hu,平均直径为 -671.8Hu;33例病理提示为AIS的pGGO CT值总和为-17211Hu,平均直径为-521.5Hu;35例病理提示为MIA的pGGO CT值总和为-18266Hu,平均直径为-521.9Hu;18例病理提示为IAC的pGGO CT值总和为-9271Hu,平均直径为-515.1Hu。对92例pGGO的CT值进行秩和检验,AAH的CT值分别与AIS、MIA、IAC的CT值进行比较(P均小于0.05),具有统计学意义,说明AAH的CT值均小于AIS、MIA、IAC;将AIS、MIA、IAC进行比较(P均大于0.05),不具有统计学意义,故考虑三者之间不存在明显差异。求AAH CT值的95%的参考值为<-600Hu,见图3。
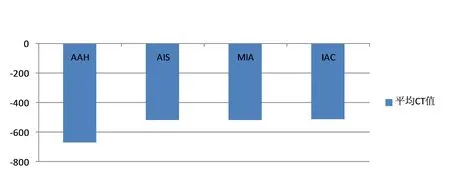
图3平均CT值(Hu)
2.4
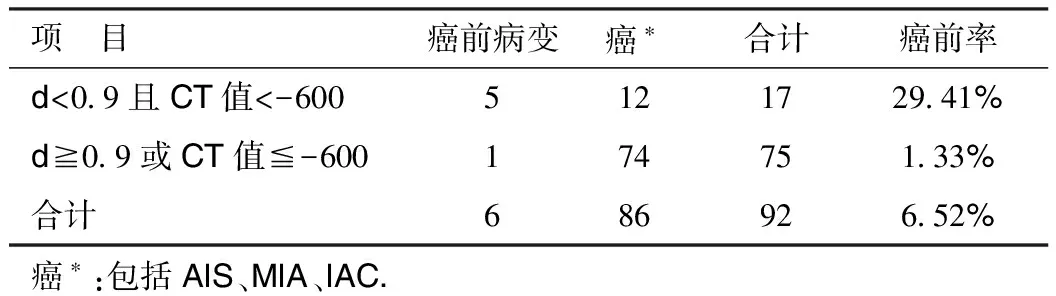
表1 影像表现与病理类型
由上表可以看出:d<0.9且CT值<-600的癌前病变所占的比率明显高于d≥0.9或CT值≤-600的癌前病变所占的比率;通过2×2列联表资料的卡方检验(P<0.05),差异具有统计学意义。
3 讨 论
pGGO为纯磨玻璃样肺部病变,主要表现为局灶性的肺组织衰减,血管的边缘轮廓等正常结构仍然清晰可见,是纯磨玻璃样病变分类的其中一种,是早期腺癌临床表现之一,根据据相关研究发现,pGGO具有发展成为异质性GGO和部分实质性GGO可能[2],恶性程度越高,浸润性越强;Henschke等[3]在临床研究过程中发现,纯GGO即非实性GGO中18%为恶性;HeoEY[4]教授团队及Lee[5]教授团队分别在各自的研究中得出纯GGO的恶性程度分别为70%及40%,由此可以看出纯GGO中恶性率发生较高,应该得以重点关注。因此对pGGO进行积极的正确的得当的进一步诊治具有重要意义。
就目前而言,高分辨螺旋CT仍是肺部GGO筛选的主要手术,但是仍无法在术前尽可能去明确预判病变的良、恶性及病理分型。通过本次对92例纯GGO病例进行了回顾性研究,我们从中可以发现,高分辨CT提示的纯GGO的病理类型中不仅仅是AAH、AIS,而且也存在微浸润性腺癌及浸润性腺癌,只是所占的比例有所差异,而有研究报告提示单纯型磨玻璃密度影多见于AAH[6];GooJM等[7]报道称纯GGO的恶性率为18%,均与本回顾性研究有差异,可能由于在术前反复阅读CT片及结合相关病史筛查排除了良性病变及AAH可能性,导致纯磨玻璃样病变恶性率较高,因此无论恶性比例高与低,但总体来说都有相对一部分恶性肿瘤存在于纯GGO;且通过本次回顾性研究可以看出,还存在一部分具有侵袭的恶性肿瘤,因而在手术治疗的时候应充分考虑这一点,必要时需进一步扩大手术范围,而不是仅仅行楔形切除,必要时可行肺段切除或肺叶切除,避免延误对疾病的治疗。
同时我们也发现,不同病理类型的pGGO在高分辨螺旋CT的表现上还存在一定的差异,特别是在病灶大小方面,首先AAH平均直径均小于AIS、MIA、IAC的直径,AIS、MIA比较平均直径没有明显差异,但较IAC直径小,由此可以看出随着pGGO直径的增大,病理类型也随之由癌前病变过度到浸润性癌,浸润性明显增加,恶性明显升高。Matsuguma等[8]通过对174例GGO的临床观察后指出当d>10cm时可以作为pGGO进展的预测因素;我们通过回顾性研究发现,与之前的相关研究基本相符合;其次,也进一步发现AAH直径范围一般小于0.9cm,平均直径为0.51cm;AIS、MAI的直径大小范围主要在0.43cm~1.30cm之间,平均直径为0.8cm;IAC的直径大小范围主要在0.92cm~2.91cm,平均直径为1.54cm。由此可以看出d<0.51cm的pGGO病理为AAH的可能性大,直径在0.51cm~0.9cm的pGGO病理为AAH的概率较前一阶段降低,同时AIS和MIA的概率相应增加,而在直径在0.9cm~1.54cm时IAC可能性明显增高,AIS和MIA的概率相应降低,且不存在AAH所占比例;当直径大于1.54cm时IAC占绝对高的比例。由此笔者认为有一定的证据可以证明,在pGGO中可以通过大小来初步判断不同的病理类型,为临床治疗提过参考。
而关于CT值在不同病理类型中研究,Kitami等[9]指出不同病理类型的GGO存在CT值的不同,平均值为(-609±45)Hu时提示AAH可能性较大;平均值为(-450±147)Hu时提示BAC可能性较大;而平均值为(-319±97)Hu时提示腺癌可能性较大;同样,Ikeda等[10]通过的局限性GGO的研究也得出了几乎类似的结论,AAH的CT值为(-682±64)Hu、BAC的CT值为(-544±179)Hu、侵袭性腺癌CT值为(-371±142)Hu。而通过本组实验数据的研究我们发现,AAH的CT值平均为671.8Hu,通过统计分析明显小于AIS、MIA、IAC的CT值平均值,而AIS、MIA、IAC的CT值平均值无明显差异,这可能与本次实验仅仅研究pGGO所致,但也不排除其他可能。由此可以看出CT值在鉴别良、恶性pGGO有一定性作用,而鉴别不同病理类型的GGO尚需进一步研究。
为了进一步在术前鉴别清楚pGGO的良、恶性,我们将直径和CT值联合进行统计分析,由上述统计分析发现pGGO直径小于0.9cm或CT值小于-600时考虑癌前病变可能性较大,故将研究数据以d<0.9且CT值<-600为一组,以d≥0.9或CT值≥-600Hu为另一组,通过统计分析发现,前一组癌前病变率为29.41%,后一组癌前病变率为1.33%,前一组明显高于后一组(P<0.05);与AkihikoKitami等[9]通过相关研究也得出了相似的结果。
在pGGO手术指针的选择方面,目前尚无明确的共识和指南,但经过相关临床经验认为经过抗感染、随访之后若出现相关变化,可采取进一步诊治。Masafumi等[11]认为若在随访过程中出现体积明显增大、密度明显增高是积极进行干预的重要指针,结合上述统计数据,笔者认为以d≥0.9cm、或CT值≥-600考虑早期恶性肿瘤可能性较高,同时结合相关患者自身的危险因素,且通过不同时间段的随访,可考虑行手术治疗;对于手术方式的选择,Tsutani等[12]通过对239例GGO行手术治疗后报道肺叶切除、肺亚段切除及肺部楔形切除3年复发率没有明显差异;麻成方等[13]对32例肺部磨玻璃样病变行肺亚段切除后指出:无论其为良性或恶性病变,亚段肺切除均可获得满意的效果,可行性良好,安全微创。同样华西医院韦诗友等[14]通过回顾性研究663例GGO病例,也得到了相似的结论,故结合既往相关研究及本组数据的分析,认为pGGO直径d≤1.6cm可行楔形切除、d>1.6cm行肺亚段切除方可达到根治性切除病变,且手术创伤相比较小、并发症少、术后恢复快。
4 结 论
综上所述,纯磨玻璃样病变的病理类型不仅仅是不典型腺瘤样变,也存在原位癌、微浸润性癌和浸润性癌,只是所占比例不同;不同病理类型之间密度没有明显差异,不能作为术前初步鉴别病理类型的依据,但可以初步区别良恶性病变;而病变大小却明显随着病理类型的变化不断增大,因此病变直径可以在一定程度上鉴别不同的病理类型,为手术方式及病变切除的范围提供相关的依据。促进纯磨玻璃病变的诊断及质量。
[1]TRAVISWD,BRAMBILLAE,NOGUCHIM,etal.Internationalassociationforthestudyoflungcancer/Americanthoracicsociety/Europeanrespiratorysocietyinternationalmultidisciplinaryclassificationoflungadenocarcinoma[J].JThoracOncol, 2011, 6(2): 244-285.
[2]KAKINUMAR,NOGUCHIM,ASHIZAWAK,etal.Naturalhistoryofpulmonarysubsolidnodules:aprospectivemulticenterstudy[J].JThoracOncol, 2016, 11 (7) :1012.
[3]HENSCHKECI,YANKELEVITZDF,MIRTCHEVAR,etal.CTscreeningforlungcancer:frequencyandsignificanceofpartsolidandnonsolidnodules[J].AmericanJournalofRoent‐genology, 2002,178(5):1053-1057.
[4]HEOEY,LEEKW,JHEONS,etal.Surgicalresectionofhighlysuspiciouspulmonarynoduleswithoutatissuediagnosis[J].JpnJClinOncol, 2011, 41(8):1017-1022.
[5]LEEHJ,GOOJM,LEECH,etal.Nodularground-glassopacitiesonthin-sectionCT:sizechangeduringfollow-upandpathologicalresults[J].KoreanJRadiol, 2007,8(1):22-31.
[6]LEESW,LEEMCS,KIMTJ,etal.Thelong-termcourseofgroundglassopacitiesdetectedonthin-sectioncomputedtomography[J].RespirMed, 2013,107(6):904-910.
[7]GOOJM,PARKCM,LEEHJ.Ground-glassnodulesonchestCTasinagingbiomarkersinthemanagementoflungadenocarcinoma[J].AJRAmJRoentgenol, 2011,196(3):533-543.
[8]MATSUGUMAH,MORIK,NAKAHARAR,etal.Characteristicsofsubsolidpulmonarynodulesshowinggrowthduringfollow-upwithCTscanning[J].Chest,2013,143:436-443.
[9]KITAMIA,KAMIOY,HAYASHIS,etal.One-dimensionalmeancomputedtomographyvalueevaluationofground-glassopacityonhigh-resolutionimages[J].GenThoracCardiovascSurg, 2012,60(7):425-430.
[10]IKEDAK,AWAIK,MORIT,etal.Differentialdiagnosisofground-glassopacitynodules:CTnumberanalysisbythree-dimensionalcomputerizedquantification[J].Chest, 2007,132(3):984-990.
[11]MASAFUMIY,AKIOF,MAKOTOE,etal.Howshouldwemanagesmallfocalpureground-glassopacitynodulesonhigh-resolutioncomputedtomography?Asingleinstituteexperience[J].SurgOncol, 2015,24( 3) : 258-263.
[12]TSUTANIY,MIYATAY,NAKAYAMAH,etal.AppropriatesublobarresectionchoiceforgroundglassopacitydominantclinicalstageIalungadenocarcionma:wedgeresectionorsegmentectomy[J].Chest,2014,145(1):66-71.
[13]麻成方,李绍鹏,李志华,等.全胸腔镜下解剖性肺段切除术在GGO中的应用[J]. 临床肺科杂志, 2015, 20(6): 1088-1091.
[14]韦诗友,赵珂嘉,郭成林,等.肺磨玻璃结节的外科诊断和治疗分析—附663例报告[J].四川大学学报(医学版),2017,48(3):359-362.
