胶州湾夜光藻种群动态及其大量繁殖的生态机制*
2018-01-12田达玮宋书群陈田田梁俊华李才文4
田达玮 宋书群 陈田田 李 照 刘 云 梁俊华 李才文4①
(1. 中国科学院海洋生态与环境科学重点实验室 中国科学院海洋研究所 青岛 266071; 2. 中国科学院大学 北京 100049;3. 山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071; 4. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266237)
夜光藻是全球主要的赤潮生物之一(Elbrächter et al, 1998; 钱树本等, 2005), 广泛分布于近岸水域和上升流海区(Harrison et al, 2011)。夜光藻赤潮20世纪80、90年代曾在我国近岸水域频繁暴发(陈汉辉等,1991; 钱宏林等, 1994), 近年来又呈旺发态势,2008—2015年间《中国海洋环境质量公报》记录的夜光藻赤潮多达 79次。夜光藻赤潮暴发时, 大量细胞黏附在鱼类鳃上使其窒息死亡, 释放的大量铵也对鱼类有害; 赤潮消亡阶段, 细胞降解消耗大量溶解氧, 并释放硫化氢等有毒物质, 破坏水体环境(Smayda, 1997)。夜光藻偏好摄食硅藻, 其大量增殖会影响水体中硅/甲藻比例, 改变浮游植物群落结构(Kiφrboe et al, 1998; Baek et al, 2009); 另外, 夜光藻对鱼卵的摄食会造成渔业产量下降(Enomoto, 1956)。
夜光藻的种群动态受环境、生物及自身种群结构等多种因素影响。Miyaguchi等(2005)发现风速和降水会显著影响夜光藻丰度; 在韩国长木湾(Jangmok Bay)的研究表明夜光藻丰度会随水温波动, 在水温大于28°C时丰度急剧下降(Jang et al, 2010)。Harrison等(2011)认为食物能影响夜光藻的分布; 由于存在竞争关系, 浮游动物数量也会影响夜光藻种群数量(Jang et al, 2010)。夜光藻可通过营养细胞二分裂进行无性繁殖, 也可通过形成配子母细胞产生配子进行有性繁殖(Fukuda et al, 2006), 普遍认为夜光藻的种群增长方式为二分裂(周成旭等, 1994a), 有性繁殖的作用尚不明确(宋书群等, 2016)。Miyaguchi等(2005)发现有性繁殖细胞大量出现是夜光藻赤潮发生的必要条件之一; Sriwoon等(2008)发现绿色夜光藻(green Noctiluca scintillans)有性繁殖引起的种群增长率与二分裂引起的种群增长率相同, 说明二分裂和有性繁殖均可对种群增长起贡献作用。
胶州湾是我国北方重要的海湾, 受到人类活动影响较大, 部分海区出现了较为严重的富营养化现象(Shen, 2001), 国家海洋局统计数据显示,2012—2014年胶州湾海域连续三年发生了夜光藻赤潮。胶州湾地区夜光藻的相关研究主要集中于20世纪 90年代, 周成旭、吴玉霖等研究了胶州湾夜光藻的种群动态、繁殖方式及营养动力学(周成旭等,1994a, 1994b, 1999); 2000年以后, 仅见张天文等(2009)对胶州湾2006年夜光藻季节动态的研究报道。本文通过月度多学科综合性调查和密集采样, 系统研究了夜光藻种群的周年动态变化及其影响因素,探讨了胶州湾夜光藻大量增殖的生态机制, 以期为深入揭示胶州湾海洋环境演变及其生态效应提供数据支撑。
1 材料与方法
1.1 航次信息
于2015年1月至12月间, 搭载“创新”号科学考察船逐月在胶州湾开展多学科综合性调查, 从湾内到湾外共布设 12个站位(图 1), A3、A5、B2、C1、C3为湾内站位, C4、D1、D3、D5为湾口站位, D6、D7、D8为湾外站位。每次调查于2—3日内完成。
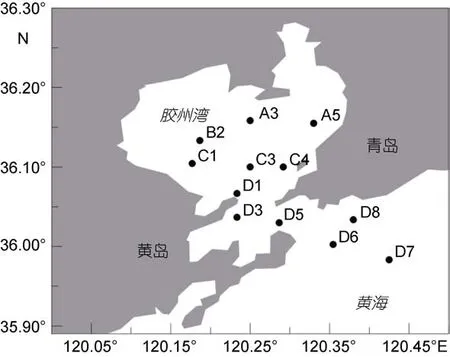
图1 胶州湾调查站位Fig.1 Deployment of stations in the Jiaozhou Bay
1.2 样品采集及分析方法
各站位由底到表垂直拖曳中型浮游生物网采集夜光藻样品, 将样品置入500mL聚丙烯瓶中, 加中性福尔马林溶液至最终浓度 5%固定保存。实验室内将现场采集的样品浓缩至 100mL, 取 5—10mL亚样品置于 Hydro-Bios的浮游动物计数框内, 使用体视显微镜计数夜光藻营养细胞、二分裂细胞和有性繁殖细胞(图 2)。
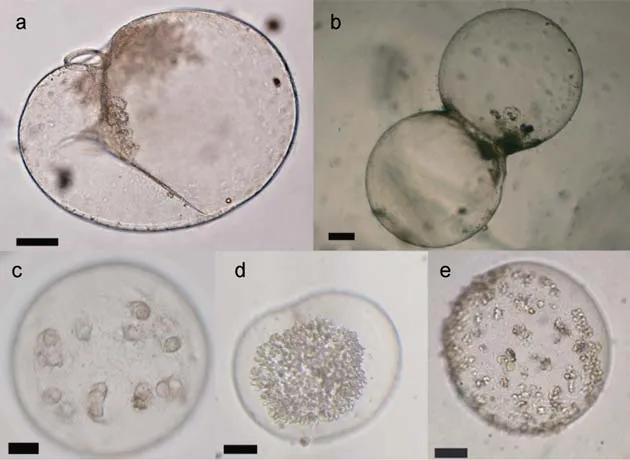
图2 夜光藻细胞的形态Fig.2 Different morphology of Noctiluca scintillans
使用 CTD(AAQ-1183)获取温度和盐度剖面, 使用MILOS-52自动气象站记录气象数据, 使用Niskin采水瓶分层采集水样。按照《海洋调查规范》(GB/T 12763.3-2007和 12763.3-2007)采集、保存营养盐(氨氮、硝氮、亚硝氮、磷酸盐和硅酸盐)和叶绿素 a样品, 营养盐样品使用 SKALAR营养盐自动分析仪测量, 叶绿素 a样品使用 Turner Trilogy荧光计测量(Strickland et al, 1972)。
1.3 数据分析
采用SPSS 16.0软件对夜光藻丰度、繁殖个体比例及环境参数进行 Spearman秩相关分析; 夜光藻月平均丰度、繁殖个体比例、环境参数数据作图采用Origin8.6软件绘制; 站位图和夜光藻平面分布图采用Surfer 12软件绘制。
2 结果与分析
2.1 环境特征
各站位水温和盐度的周年变化示于图 3a。月平均水温变化范围为3.89—25.68°C, 2月水温整体低于其他月份, 8、9月水温整体较高。全年水温最高值为28.48°C, 出现在 8月的 B2站位; 最低值为 2.39°C,出现在2月的B2站位。湾外水温在1—3月和10—12月比湾内高, 而在 4—9月比湾内低。月平均盐度变化范围为 30.03—31.71, 全年盐度变化较小, 均在夜光藻的最适盐度范围内(Elbrächter et al, 1998); 由于墨水河、李村河和娄山河的淡水输入, 湾内水体的盐度年平均值(30.76)低于湾口(30.89)及湾外(30.96)。
各站位气象参数的周年变化示于图 3b。月平均风速变化范围为2.12—3.85m/s, 春、秋季月平均风速较大, 夏季月平均风速最低; 冬季以西北风为主, 其他季节以东南风为主。总辐射量变化范围为372.90—1289.53μmol/(m2·s), 夏季光照较强, 总辐射量最大;冬季最低。
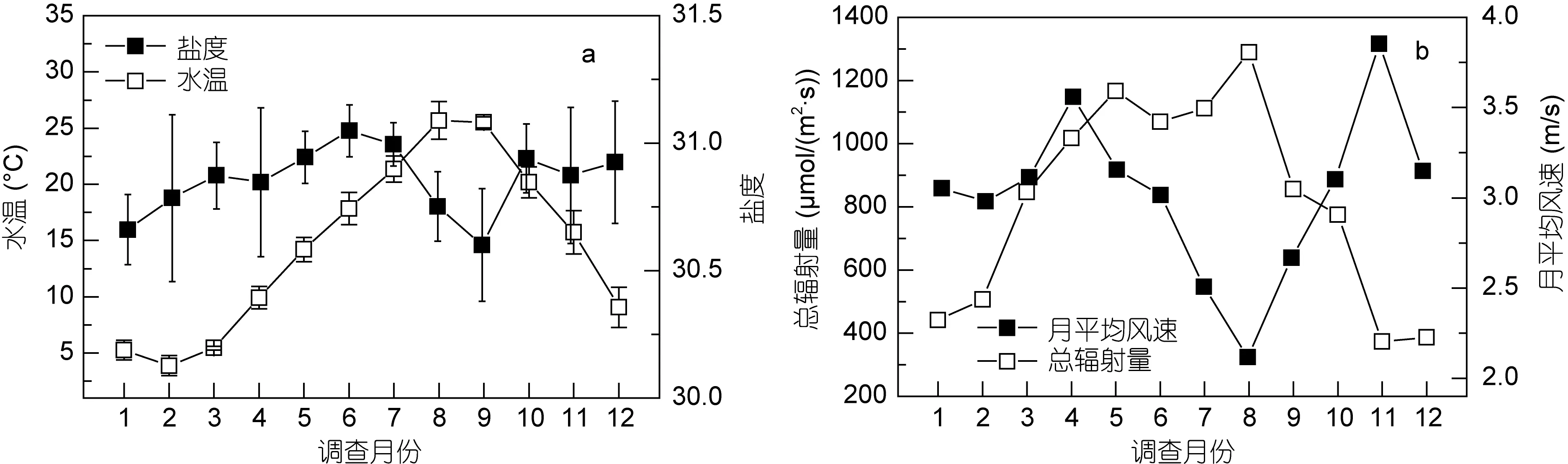
图3 水文和气象参数的周年变化Fig.3 Annual variations of hydrographic and meteorological parameters
氨氮月平均浓度变化范围为 1.77—12.50μmol/L(图4a), 除5月和9月氨氮浓度分别出现显著升高或降低外, 全年氨氮浓度在 3.00—5.00μmol/L之间波动。湾内站位氨氮年平均浓度(6.92μmol/L)高于湾口(4.69μmol/L)及湾外站位(3.72μmol/L), 湾内河流入海口附近的A5站位氨氮年平均浓度(11.70μmol/L)高于湾内其他站位(均低于10.00μmol/L)。湾外的D8站位靠近码头, 其氨氮浓度也偶现高值(7月氨氮浓度达到 16.16μmol/L)。硝氮月平均浓度变化范围为2.37—9.83μmol/L(图 4b), 春、秋季节硝氮浓度较高,冬、夏季节硝氮浓度较低。湾内站位的硝氮年平均浓度(11.49μmol/L)高于湾口(4.65μmol/L)及湾外站位(2.18μmol/L), 湾内北侧靠近李村河和娄山河入海口的 A3、A5站位硝氮年平均浓度分别为 14.06、21.89μmol/L, 显著高于湾内其他站位(均低于10.00μmol/L)。亚硝氮月平均浓度变化范围为0.19—1.74μmol/L(图4c), 1—8月亚硝氮浓度均较低,9—12月亚硝氮浓度有显著的升高。湾内站位的亚硝氮年平均浓度(0.91μmol/L)高于湾口(0.58μmol/L)及湾外站位(0.48μmol/L)。硅酸盐月平均浓度变化范围为 0.77—3.75μmol/L(图 4d), 5、6、9月硅酸盐浓度显著降低, 其他月份硅酸盐浓度在2.00—4.00μmol/L之间, 湾内站位的硅酸盐年平均浓度(2.97μmol/L)高于湾口(2.29μmol/L)和湾外站位(1.30μmol/L), 河口处附近站位 A5、C4硅酸盐年平均浓度分别为 4.30、3.11μmol/L, 高于其他站位(均低于 3.00μmol/L)。磷酸盐月平均浓度变化范围为 0.01—0.36μmol/L(图 4e),磷酸盐浓度全年均保持较低水平, 仅在5、11、12月出现显著的升高, 夏季磷酸盐浓度出现最低值。湾内近河口的 A5站位磷酸盐年平均浓度0.32μmol/L, 高于其他站位(均低于3.00μmol/L)。五项营养盐的分布均出现近河口站位(A5、C4)高于其他站位的情况, 陆源输入可能是营养盐的主要来源。全年氮磷比普遍较高, 整体呈现磷限制。
叶绿素a月平均浓度变化范围为0.49—5.02μg/L(图4f)。全年叶绿素a浓度呈现波动状态, 春夏季节叶绿素a浓度较高, 秋冬季节较低。湾内叶绿素a年均值为 2.97μg/L, 高于湾口(2.042μg/L)及湾外站位(2.092μg/L), 湾内海泊河、李村河、娄山河河口的A3、A5、C4站位叶绿素a年均值均高于2.80μg/L, 高于其他站位, 表明叶绿素a的浓度受陆源输入影响较大。
2.2 夜光藻种群动态
2.2.1 种群丰度的时空变化 胶州湾夜光藻种群周年变化幅度较大, 全年各站位的丰度范围为 0—31.37×103ind./m3, 2月的C4站位出现最大值, 11月的C4站位和12月的A3、B2、C1站位均未发现夜光藻细胞。不同月份胶州湾夜光藻丰度的平面分布如图5所示。1—2月湾内及湾口高于湾外, 湾内东侧靠近海泊河、李村河入海口处站位丰度高于西侧站位。3月,各站位间丰度差异不大, 湾口处靠近黄岛电厂的 D3站位出现最高值。4—9月夜光藻向湾外迁移, 湾内南侧丰度高于北侧, 湾口及湾外丰度高于湾内。10月,湾内北侧墨水河、娄山河及大沽河入海口处站位丰度高于南侧站位, 湾内丰度高于湾口及湾外。11月湾内西侧洋河、大沽河入海口处站位丰度高于东侧, 湾口黄岛电厂附近站位丰度高于湾内及湾外。12月湾内西侧及北侧站位未观测到夜光藻, 东侧海泊河、李村河娄山河入海口处站位有夜光藻分布, 湾外夜光藻丰度高于湾内及湾口。各站位夜光藻丰度年均值变化范围为(2.28—7.41)×103ind./m³, 最高值出现在湾口的D3站位; 最低值为湾内的C1站位。
2.2.2 种群结构 夜光藻月平均丰度周年变化示于图 6a, 月平均丰度介于(0.05—23.39)×103ind./m3;全年呈现双峰分布, 最高峰出现在 1—4月份, 次高峰出现在7—8月份。2015年夜光藻繁殖个体比例月均值变化如图 6b, 二分裂个体比例在 1—3月较高;有性繁殖个体比例在 1—4月较高, 在 9月有性繁殖个体比例出现一个较高的峰值(5.17‰), 10月, 二分裂个体比例出现一个较高的峰值(3.87‰), 其余月份两种繁殖个体比例均在1.5‰以下。

图5 胶州湾夜光藻丰度(ind./m3)时空变化Fig.5 Temporal and spatial distribution of Noctiluca scintillans in the Jiaozhou Bay
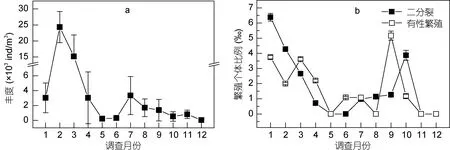
图6 胶州湾夜光藻种群结构周年变化Fig.6 Annual variation of the population structure in the Jiaozhou Bay
全年各站位夜光藻二分裂个体比例介于 0—31.25‰, 有性繁殖个体比例介于0—29.41‰。各调查站位繁殖个体比例年均值示于图 7, 二分裂个体比例年均值介于0—3.52‰, 湾内北侧3个站位(A3、A5、B2)二分裂个体比例均高于2‰, 南侧3个站位(C1、C3、C4)二分裂个体比例介于1‰—2‰, 湾口处三个站位(D1、D3、D5)二分裂个体比例最高, D1、D3均高于 3‰, 湾外三站位(D6、D7、D8)中仅 D7站位二分裂个体比例高于1‰。有性繁殖个体比例年均值介于 0.3‰—4.9‰, 湾内站位间差异不大, 均在 1‰左右, 湾口除 D1外, 其余两个站位有性繁殖个体比例均高于 3‰, 湾外三个站位有性繁殖个体比例在1‰—2.4‰。
2.3 相关性分析
相关性分析结果见表 1: 夜光藻丰度与水温、亚硝氮、硝氮呈显著负相关, 与叶绿素a呈显著正相关。二分裂与水温、盐度、亚硝氮呈显著负相关, 与叶绿素a呈显著正相关; 有性繁殖与水温、亚硝氮、硝氮呈显著负相关, 与叶绿素a呈显著正相关。夜光藻丰度与气象因子无明显相关性。

图7 各站位夜光藻不同繁殖方式个体比例Fig.7 The reproductive individual rate of Noctiluca scintillans in different stations
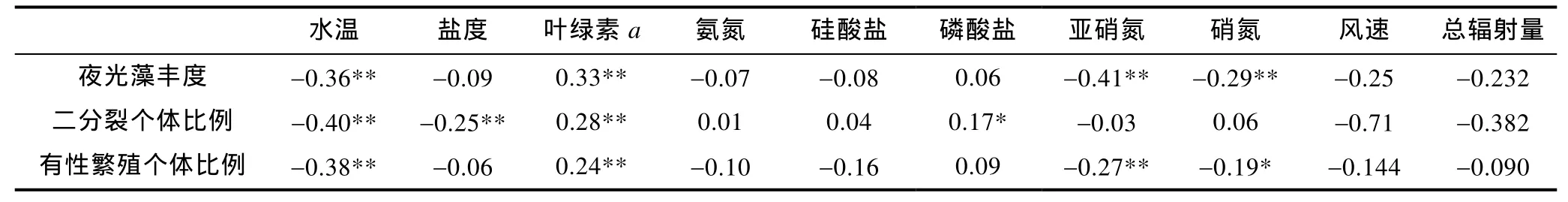
表1 夜光藻种群与环境因子间相关性Tab.1 Correlation between Noctiluca scintillans population and environmental factors
3 讨论
本研究的夜光藻周年动态与张天文等(2009)在2006—2007年的研究结果相比, 夜光藻丰度变化范围相差不大, 但峰值出现时间有较大差异, 可能是不同年份间环境差异造成的。夜光藻丰度年平均值在D3站位最高, 可能是受D3站位附近多家电厂排放的废水影响; C1站位夜光藻丰度年平均值最低, 可能是由于此站位离岸相对较远, 且没有明显的陆源输入补充营养物质, 因此夜光藻丰度较低。
夜光藻丰度与水温存在显著的负相关性, 说明水温对夜光藻种群动态有较大影响。结合水温与夜光藻时空分布分析, 同一月份水温较低的站位, 夜光藻丰度更高。尽管夜光藻在热带、亚热带和温带的近岸海域均有分布(Harrison et al, 2011), Le Fèvre等(1970)认为夜光藻是冷水种, 而且有研究表明水温过高会抑制夜光藻种群的增长(邹景忠等, 1983; 黄长江等,1997; Tada et al, 2004)。本研究发现, 夜光藻丰度较高时(>104ind./m³)水温均在 3—5°C, 低于历史资料中其他海区夜光藻赤潮暴发时水温, 可能是由于不同区域夜光藻最适水温差异造成的。
夜光藻是异养甲藻, 食物丰富程度会影响其种群动态。本研究中, 夜光藻丰度与叶绿素a之间呈显著的正相关, 全年夜光藻丰度的双峰分布也与历史资料中胶州湾浮游植物数量的冬夏双峰分布相一致(孙晓霞等, 2011), 说明夜光藻种群增长需要大量浮游植物支持。黄长江等(1997)研究发现夜光藻丰度和叶绿素a之间呈负相关, 该研究中夜光藻丰度远高于本研究。推测当夜光藻丰度较低时, 对浮游植物的摄食压力不明显, 表现出正相关性, 而当夜光藻丰度高时, 对浮游植物有较大的摄食压力, 表现出负相关性。
夜光藻丰度与亚硝氮、硝氮之间呈显著的负相关,而亚硝氮、硝氮与叶绿素 a之间没有显著的相关性,说明亚硝氮、硝氮这两种氮源可能直接影响夜光藻增殖。黄伟建等(1993)研究结果也显示夜光藻丰度与亚硝酸盐有显著相关; 蒋晓山等(1992)研究发现在长江口夜光藻赤潮暴发阶段, 海水中的硝氮和亚硝氮急剧降低; 周成旭等(1994b)研究表明外界离子变化可以直接影响夜光藻的生理代谢, 并认为氨氮可能对夜光藻的增殖有调控作用(周成旭等, 1999); 结合本文的结果, 显示硝氮和亚硝氮对于夜光藻的增殖也可能存在调控作用, 其具体作用机制有待进一步研究。
二分裂通过直接产生新个体使得种群数量增加。有性繁殖引起种群增长可能有两种方式: (1) 直接作用, 夜光藻的配子能够两两结合并成功发育成为营养细胞(Fukuda et al, 2006)。Sriwoon等(2008)推测在泰国湾北部由有性繁殖引起的夜光藻增长远高于二分裂引起的增长, 说明有性繁殖可直接对种群增长起作用; (2) 间接作用, 夜光藻配子在与营养细胞接触后, 能够重启营养细胞经过一定次数二分裂全部转变为配子母细胞的程序, 维持其有性繁殖(Sato et al, 1998), 这一过程会使二分裂个体比例增加, 从而间接对夜光藻种群增长起作用。
结合夜光藻丰度和繁殖个体比例分析, 发现各月份二分裂和有性繁殖个体比例并非均匀分布, 两种繁殖过程均受环境因素的影响。1月夜光藻二分裂和有性繁殖个体比例均较高, 促进种群数量增加, 使得夜光藻丰度在2月出现最高值, 随后二分裂个体比例降低而有性繁殖个体比例保持较高值, 夜光藻丰度也逐月降低, 表明此阶段夜光藻主要的增殖方式可能是二分裂。6月夜光藻的有性繁殖比例开始回升,7月夜光藻丰度和二分裂个体比例均出现了回升, 有性繁殖可能是引起这次夜光藻种群增殖的主要繁殖方式。二分裂个体比例和有性繁殖个体比例与夜光藻丰度均呈显著正相关(R=0.49, P<0.01; R=0.48,P<0.01), 表明两种繁殖方式均可引起夜光藻种群数量的增长。
二分裂与水温呈显著负相关, 有性繁殖与水温呈负相关。Uhlig等(1995)研究结果表明夜光藻在5—6°C下就具备二分裂能力, 本研究发现在水温3—5°C时二分裂个体比例出现较高值, 表明夜光藻二分裂可以耐受更低的水温。而在 8、9月水温高于26°C的站位, 虽然叶绿素含量较高, 但均未观察到夜光藻二分裂个体, 这与高温对二分裂的抑制有关(黄长江等, 1997)。
二分裂和有性繁殖个体比例都与叶绿素 a浓度呈显著正相关, 表明二分裂和有性繁殖都需要充足的营养基础。夜光藻二分裂时口和触手会消失, 因此需要在二分裂前摄入充足的食物(Elbrächter et al,1998); Sriwoon等(2008)研究发现只有在投喂食物的情况下绿色夜光藻(green Noctiluca scintillans)才会出现有性繁殖。本研究中5、11、12月叶绿素a含量低,未观察到夜光藻二分裂和有性繁殖个体; 而6月出现了有性繁殖个体, 却未观察到二分裂个体, 结果表明有性繁殖可能比二分裂更快响应食物的恢复, 并通过上述的间接调控使得二分裂个体比例增加。
在本研究中, 盐度与夜光藻二分裂个体比例有显著的负相关性, 而在其他研究中并未发现这种现象; 结合周成旭等(1994b)研究结果推测盐度变化可能对夜光藻的生理过程产生影响。
4 结论
(1) 2015年全年夜光藻丰度呈现冬、夏双峰分布;夜光藻二分裂及有性繁殖个体比例也呈现出季节分布。
(2) 二分裂可能是 1—4月夜光藻主要的繁殖方式, 而有性繁殖对 6—7月夜光藻的种群数量增长起主要作用。
(3) 夜光藻种群动态受环境因素影响显著。水温和种群数量呈显著负相关, 叶绿素a为夜光藻提供食物来源, 呈显著正相关, 硝氮及亚硝氮可能直接参与夜光藻代谢, 与夜光藻数量呈显著负相关。有性繁殖过程不是程序性行为, 受温度、盐度、叶绿素a等环境因素的影响。
孙晓霞, 孙 松, 吴玉霖等, 2011. 胶州湾网采浮游植物群落结构的长期变化. 海洋与湖沼, 42(5): 639—646
邹景忠, 董丽萍, 秦保平, 1983. 渤海湾富营养化和赤潮问题的初步探讨. 海洋环境科学, 2(2): 41—54
宋书群, 李才文, 孙 军, 2016. 夜光藻有性繁殖研究进展.生态学报, 36(9): 2451—2459
张天文, 朱丽岩, 徐培培等, 2009. 胶州湾夜光虫丰度的季节变化和分布特征. 中国海洋大学学报, 39(S): 89—93
陈汉辉, 杞 桑, 1991. 夜光藻摄食和营养繁殖的昼夜节律.暨南大学学报, 12(3): 104—107, 111
周成旭, 吴玉霖, 1994a. 夜光藻的繁殖. 海洋与湖沼, 25(2):162—164
周成旭, 吴玉霖, 1999. 甲藻赤潮及其毒素的产生机制及夜光藻氮代谢途径. 海洋与湖沼, 30(4): 454—459
周成旭, 吴玉霖, 邹景忠, 1994b. 夜光藻的营养动力学. 海洋与湖沼, 25(2): 152—157
钱宏林, 梁 松, 齐雨藻等, 1994. 南海北部沿海夜光藻赤潮的生态模式研究. 生态科学, (1): 39—46
钱树本, 刘东艳, 孙 军, 2005. 海藻学. 青岛: 中国海洋大学出版社, 225—284
黄长江, 杞 桑, 齐雨藻等, 1997. 南海大鹏湾夜光藻种群在其生态群落中的地位和功能. 海洋与湖沼, 28(4):348—355
黄伟建, 齐雨藻, 1993. 大鹏湾海水理化因子对夜光藻生长影响的因子分析. 海洋通报, 12(2): 17—22
蒋晓山, 洪君超, 王桂兰等, 1992. 长江口赤潮多发区夜光藻(Noctiluca scintillans)赤潮发生过程分析. 暨南大学学报(自然科学), 13(3): 134—139
Baek S H, Shimode S, Kim H C et al, 2009. Strong bottom-up effects on phytoplankton community caused by a rainfall during spring and summer in Sagami Bay, Japan. Journal of Marine Systems, 75(1—2): 253—264
Elbrächter M, Qi Y Z, 1998. Aspects of Noctiluca (Dinophyceae)population dynamics. In: Anderson D M, Cembella A D,Hallegraeff G M eds. Physiological Ecology of Harmful Algal Blooms. Berlin, Germany: Springer, 315—335
Enomoto Y, 1956. On the occurrence and the food of Noctiluca scintillans (Macartney) in the waters adjacent to the west coast of Kyushu, with special reference to the possibility of the damage caused to the fish eggs by that plankton. Nippon Suisan Gakkaishi, 22(2): 82—88
Fukuda Y, Endoh H, 2006. New details from the complete life cycle of the red-tide dinoflagellate Noctiluca scintillans(Ehrenberg) McCartney. European Journal of Protistology,42(3): 209—219
Harrison P J, Furuya K, Gilbert P M et al, 2011. Geographical distribution of red and green Noctiluca scintillans. Chinese Journal of Oceanology and Limnology, 29(4): 807—831.
Jang M C, Shin K S, Jang P G et al, 2010. Relationship between environmental factors and short-term variations of mesozooplankton during summer in Jangmok Bay, south coast of Korea. Ocean and Polar Research, 32(1): 41—52
Kiφrboe T, Titelman J, 1998. Feeding, prey selection and prey encounter mechanisms in the heterotrophic dinoflagellate Noctiluca scintillans. Journal of Plankton Research, 20(8):1615—1636
Le Fèvre J, Grall J R, 1970. On the relationships of Noctiluca swarming off the western coast of Brittany with hydrological features and plankton characteristics of the environment.Journal of Experimental Marine Biology and Ecology, 4(3):287—306
Miyaguchi H, Fujiki T, Kikuchi T et al, 2005. Relationship between the bloom of Noctiluca scintillans and environmental factors in the coastal waters of Sagami Bay,Japan. Journal of Plankton Research, 28(3): 313—324
Sato M S, Suzuki M, Hayashi H, 1998. The density of a homogeneous population of cells controls resetting of the program for swarmer formation in the unicellular marine microorganism Noctiluca scintillans. Experimental Cell Research, 245(2): 290—293
Shen Z L, 2001. Historical changes in nutrient structure and its influences on phytoplantkton composition in Jiaozhou Bay.Estuarine, Coastal and Shelf Science, 52(2): 211—224
Smayda T J, 1997. What is a bloom? A commentary. Limnology and Oceanography, 42(5 Part2): 1132—1136
Sriwoon R, Pholpunthin P, Lirdwitayaprasit T et al, 2008.Population dynamics of green Noctiluca scintillans(Dinophyceae) associated with the monsoon cycle in the upper gulf of Thailand. Journal of Phycology, 44(3):605—615
Strickland J D H, Parsons T R, 1972. A Practical Handbook of Seawater Analysis. Ottawa, Canada: Fisheries Research Board of Canada, 185—206
Tada K, Pithakpol S, Montani S, 2004. Seasonal variation in the abundance of Noctiluca scintillans in the Seto Inland Sea,Japan. Plankton Biology and Ecology, 51(1): 7—14
Uhlig G, Sahling G, Hanslik M, 1995. Noctiluca scintillans:Zeitliche Verteilung bei Helgoland und Räeumliche Verbreitung in der Deutschen Bucht (Langzeitreihen 1970—1993). Hamburg: Biologische Anstalt Helgoland, 1—127
