醇的选择性催化氧化研究进展
2018-01-12吴超龙姚小泉
吴超龙 喻 敏,2 姚小泉
(1.南京航空航天大学 材料科学与技术学院,江苏 南京 210016;2.南京晓庄学院 环境科学学院,江苏 南京 211171)
氧化是有机化学中实现不同有机物质之间转化的重要途径。而在众多氧化反应中,由醇到醛或酮的选择性催化氧化反应是化学研究中及化工生产中最常见和应用最广泛的重要反应之一[1]。醛和酮及其衍生物广泛应用于糖果、香水、制药等行业[2],同时,也是非常重要的化工合成中间体,广泛的应用于合成产业中。据统计,每年羰基化合物的产量约107t,大多数都是从醇的氧化而得来的[3]。原料醇来源丰富,相对比较容易得且价格便宜。
醇氧化到醛酮已报道的方法有很多。传统方法是通过化学计量的无机氧化物来氧化醇到醛酮,例如:铬(VI)氧化物[4]、高锰酸盐[5]、钌(VI)氧化物[6]、高价碘氧化物[7]等。然而,相比较而言,醛的活泼性较醇的高,化学计量的氧化剂很容易使产物醛发生进一步的氧化,因此,具有较低的反应的选择性[8]。这些氧化剂往往都是重金属的氧化剂,价格比较昂贵,且易产生重金属废液,严重污染环境;同时具有腐蚀性,危险性较高。
1均相催化
均相催化是反应物和催化剂处于均匀同一物相中的催化反应。这样会使反应物分子中的活化分子的百分数增大,从而增大反应活性和反应速率。
1.1 M/TEMPO 催化氧化体系
1984年,Semmelnack等[13]首次报道了以CuCl/TEMPO为催化剂,氧气为氧化剂,在温和条件下,DMF溶剂中实现伯醇到醛的选择性氧化转化,转化频率(TOF)高达9.6 h-1,这也充分体现出均相反应高速的优点。
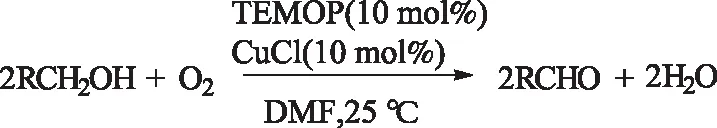
式1 CuCl/TEMPO催化伯醇的氧化Scheme 1 CuCl/TEMPO-catalyzedoxidation of primary alcohols
但是反应体系使用DMF作为溶剂,从而产品很难被分离出来。且该体系的底物适应性受限。
Bekkum等[14]1996年在以TEMPO (2, 2, 6, 6-tetramethylpiperidine-N-oxyl) 为助氧化剂,NaClO为氧化剂的反应体系中成功进行醇的氧化反应。该反应具有比较容易控制,且体系简单,产物易分离,成本较低等优点,已实现工业化生产。
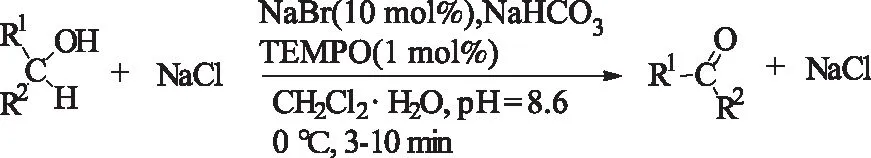
式2 TEMPO/NaClO对醇的氧化Scheme 2 TEMPO/NaClO-oxidized alcohols
2001年,Sheldon等[15]建立了Ru(PPh3)3Cl2/TEMPO催化氧化体系,该体系在10 bar的空气或者氧气氛,100 ℃下,可以高效的氧化烷基醇到相对应的醛或酮。活泼性较好的芳香醇更易被氧化,选择性也较高接近100%,同时转化率也都大于95%。但是,反应需要在高压条件下,一定程度上限制了该催化体系的发展。
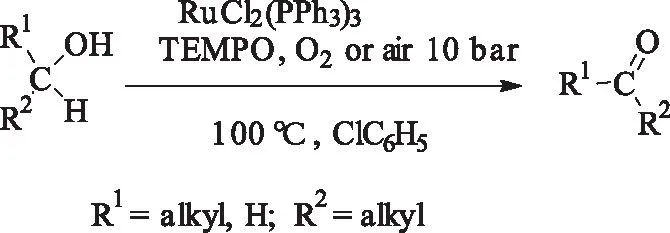
式3 Ru(PPh3)3Cl2/TEMPO高压催化氧化醇Scheme 3 Ru(PPh3)3Cl2/TEMPO-catalyzedoxidation of alcohols under high pressure
2002年,Ansari和同事们[16]在[bmim][PF6]离子液体中,实现温和条件下,芳基、烷基醇向对应醛酮的转化。该反应产率较高,且产物比较容易被萃取出来。但是,此离子液体价格昂贵,工业化成本较高。
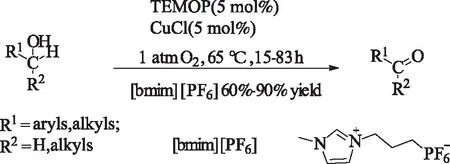
式4 [bmim][PF6]中CuCl/TEMPO催化的醇的氧化Scheme 4 CuCl/TEMPO-catalyzed oxidation ofalcohols in [bmim][PF6] solvent
Sheldon课题组[17]2003年报道,[Cu(II)-(2,2’-联吡啶)]/TEMPO催化体系能实现伯醇的选择性氧化,反应以碱作为助剂,乙腈/水为混合溶剂,室温空气氛下以较高的选择性完成伯醇的氧化成醛,但是,对于仲醇却没有氧化效果。

式5 [CuBr2(2,2’-bipyridine)]/TEMPO催化的伯醇的氧化Scheme 5 [CuBr2(2,2’-bipyridine)]/TEMPO-catalyzed oxidation of primary alcohols
Minisci等[18]研究发现,复合金属化合物与TEMPO构成的催化体系能很好的选择性氧化醇到对应的醛酮,如:Mn(NO3)2、Co(NO3)2和Cu(NO3)2等金属氧化物。在体系中,若在氧气氛中反应,即使在温度低于40 ℃时,2 h后氧化反应的转化率多于92%;而若在空气中反应,温度低于40 ℃时,则需5 h后才能有90%以上的收率。
1.2 Pd(II)催化剂
TEMPO是一种昂贵的助氧剂,市场价格昂贵,且回收成本较高,造成很难重复利用的问题,因此,M/TEMPO催化体系工业化成本较高。化学工作者把注意力都集中在开发比较经济实惠的催化体系。早在1977年Pd催化体系[19]就用于醇的选择性氧化。该体系较为简单,由Pd盐和无机碱组成,室温下就能实现醇的氧化。但是,该体系适应性有限。
1998年,Peterson等[20]报道用Pd(OAc)2/DMSO/NaHCO3作为催化体,常压80 ℃下,氧气氛中,氧化各种烯丙醇和苄醇。
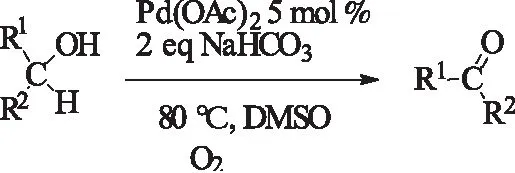
式6 Pd(OAc)2/NaHCO3催化氧气氛下烯丙醇和苄醇的氧化Scheme 6 Pd(OAc)2/NaHCO3-catalyzedoxidation of allyl alcohols or benzyl alcohols using O2
同年,Nishimura等[21]采用Pd(OAc)2/pyridine/MS3A为催化剂,在80 ℃常压氧气氛下,轻松的以较高的收率实现对各种醇的氧化。相比较于上面的体系,底物适应性较为广泛,可氧化各类醇类。
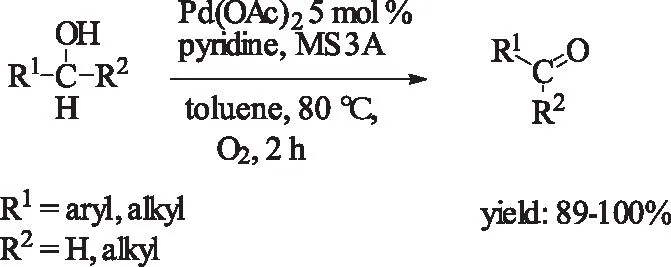
式7 Pd(OAc)2/pyridine/MS3A催化的一级、二级醇的氧化Scheme 7 Pd(OAc)2/pyridine/MS3A-catalyzedoxidation of primary alcohols and secondary alcohols
以上两种钯的催化体系,Steinhoff[22]通过研究了氧化机理,认为pyridine作为钯的配体可以有效的促进Pd(0)氧化为Pd(II)的进行,从而促进氧化反应进行,并且还可以抑制钯黑的生成,防止催化剂失活。
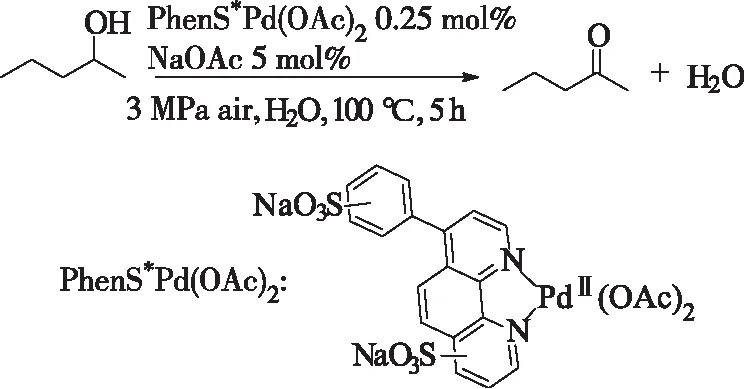
式8 PhenS*Pd(OAc)2于水相中催化醇的氧化Scheme 8 PhenS*Pd(OAc)2-catalyzedoxidation of alcohols in water
2005年,Buffin等[25]发现用修饰过的可以水溶性联喹啉与醋酸钯配合成新的配合物可以在水相中催化氧化仲醇到对应的酮。反应在pH-11,氧气氛,110-125 ℃下进行。该反应的选择性较高,且收率较好(85%-100%)。令人感到有趣的是,该催化体系对伯醇底物为完全氧化,即氧化到对应的脂肪酸。
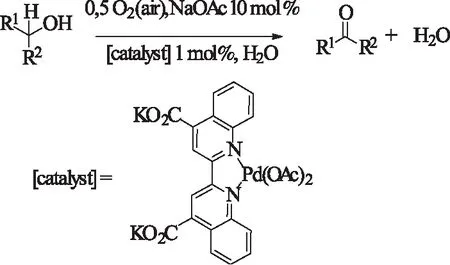
式9 Pd(II)-biquinoline催化仲醇的氧化Scheme 9 Pd(II)-biquinoline-catalyzedoxidation of secondary alcohols
1.3 其他金属配合物催化剂
化学工作者们对醇的选择性催化氧化的研究热情从未减少过,其它的过渡金属氧化物或者配合物也都被试用在醇的氧化反应。如:Cu[26], V[27], Ir[28], Re[29], Pt[30], Zn[31], Fe[32]等。其中,铜Cu和铁Fe是地球上含量比较丰富的,与其它的金属相比,比较易得且廉价,具有很高的工业应用前景。
2002年,Martin课题组[32]用Fe(NO3)3-FeBr3(2:1)为催化剂,乙腈为溶剂,室温空气氛下实现各类一级醇及二级醇的氧化,且产率较好,约80%左右,具有较好的工业应用价值,美中不足的是使用了非极性溶剂乙腈,后处理比较复杂。
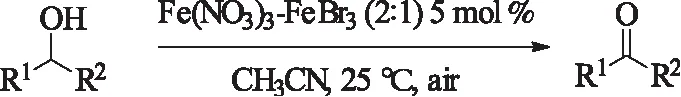
式10Fe催化体系催化的醇的氧化
Scheme10Fe-catalyzedoxidationofalcohols
2004年,Markó等[26a]通过添加NMI肼衍生物,使CuCl/phen催化剂得以保持活性,大大提高了催化氧化醇的能力。该体系条件温和,且底物适应性良好,但是,体系较为复杂,且使用氟代苯毒性溶剂和叔丁醇钾强碱。
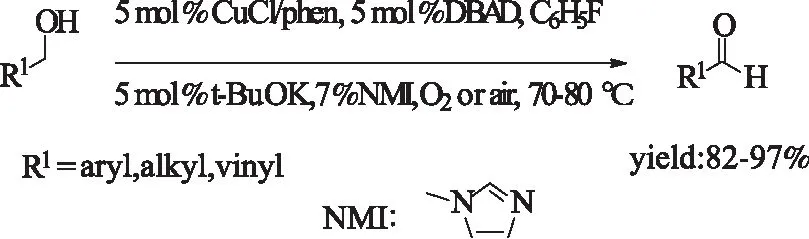
式11 CuCl/phen催化醇的氧化Scheme 11 CuCl/phen-catalyzedoxidation of alcohols
不仅Cu(I)表现出氧化醇的能力,06年,Velusamy及其合作者[26b]报道了Cu(II)配合物同样可以实现伯醇的氧化。在氧转移剂TEMPO的协助下,氧气氛,甲苯中,100 ℃成功的氧化醇到醛。该体系具有较好的底物适应性,但是催化剂较为复杂难以制备。
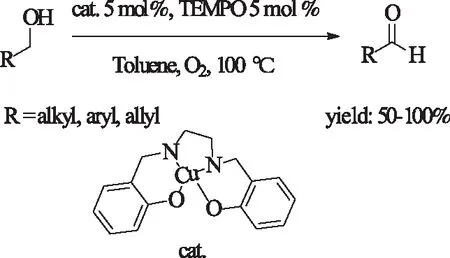
式12 Cu(II)配合物催化的伯醇的氧化Scheme 12 Cu(II)-catalyzed oxidationof primary alcohols
2多相催化
催化剂和反应物不处于同一物相。该类催化体系具有催化剂与产品易分离,催化剂易循环使用等优点。多相催化往往在工业中具有较大的应用价值,在醇的氧化工业生产中也有大量的多相催化体系。
2.1 负载的TEMPO/M体系
我们知道TEMPO/M催化氧化体系具有较好的催化效果,且具有较好的工业应用前景。但是在均相催化中催化剂难以分离,造成催化剂的浪费和环境的污染。因此,研究人员想到将催化体系固载化通过多相催化实现氧化。
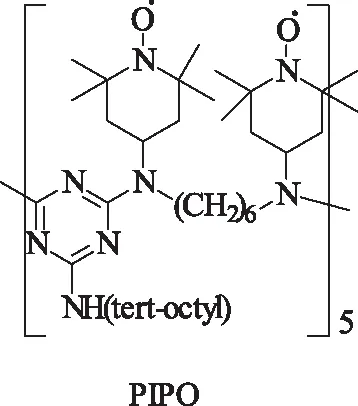
Sheldon课题组[33]将TEMPO固载化制作成polyamine-immobilized piperidinyl oxyl(PIPO),与CuCl构成催化剂体系,在DMSO溶剂中,实现苯甲醇的多相催化氧化成苯甲醛的转化。该催化体系已经在商业上应用。
耕地质量监测是一项长期的经常性的工作,要严格执行《中华人民共和国土地管理法》、《基本农田保护条例》等法律法规的各项规定,建立完善以基本农田质量跟踪制度、占补平衡质量验收制度、基本农田质量建设奖惩制度、定期检查制度为重点的基本农田质量建设管理机制。针对新开发耕地、复垦地和整理土地等补充耕地开展耕地质量评价工作,同时加大对此类耕地质量建设投资力度,提出培肥措施。通过推进基本农田质量与管理制度建设,实现对基本农田质量的依法监管。
2001年,Fey课题组[34]将TEMPO固载到二氧化硅表面上成TEMPO-amine-SiO2复合材料催化剂与NaClO构成催化氧化体系,在绿色溶剂水中氧气氛下高效的实现醇的氧化。且循环使用时,同样展现出很高的活性。
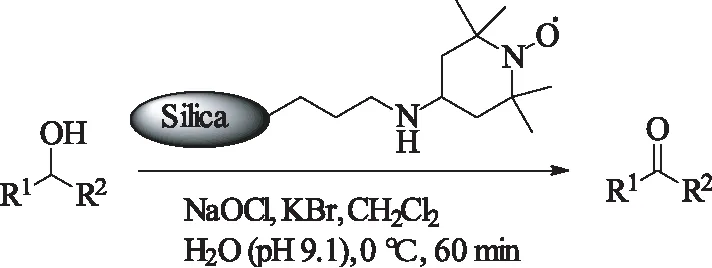
式13 TEMPO-amine-SiO2催化的醇的氧化Scheme 13 TEMPO-amine-SiO2-catalyzedoxidation of alcohols
2.2 负载Pd(II)配合物
2000年,Nishimura等人[35]基于Pd(OAc)2/pyridine/MS3A催化剂体系,发展了一种Pd(OAc)2/pyridine/hydrotalcite(Mg6Al2(OH)16CO3·4H2O)多相Pd催化剂,即Pd(II)-hydrotalcite。该催化体系以吡啶为助催化剂可以氧化苯甲醇及不活泼芳香醇。该反应在常压空气氛下,65 ℃下首次催化氧化苄醇可达到98%的收率,催化剂循环二次催化氧化收率可达到90%,没有明显的下降,依然保持较高的催化活性。
Mori等人[36]直接将Pd(II)浸渍到羟磷灰石上,从而制得Pd(II)-HAP[Ca10(HPO4)(PO4)5(OH)]催化剂。该催化剂体系不需要吡啶为助催化剂,不仅对苄醇和烯丙醇有较好的氧化活性,而且即使是脂肪醇和环醇在延长反应时间后,也能以较好的收率实现氧化。尤其对仲醇的氧化,效率较高且催化剂可以循环使用。
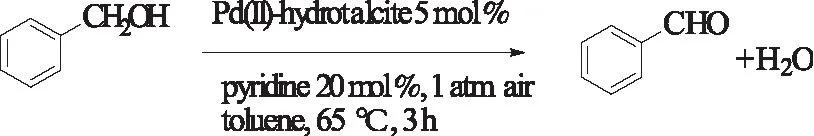
式14 Pd(II)-hydrotalcite多相催化苄醇的氧化Scheme 14 Pd(II)-hydrotalcite-catalyzedoxidation of benzyl alcohols
2011年,Layer等人[37]以NAP-Mg-Pd(0)(nanocrystalline magnesium oxide stabilized palladium(0))为催化剂实现醇的氧化。反应在室温,空气氛下进行,该体系能适应各种一级二级醇类,具有较广的底物适应性。

式15 NAP-Mg-Pd(0)催化的醇的氧化Scheme 15 NAP-Mg-Pd(0)-catalyzedoxidation of alcohols
2.3 金属杂多酸类催化剂
2000年,Neumann课题组[38]用活性炭负载Na5PV2Mo10O4制成氧化催化剂,在1 atm空气。100 ℃下以选择性100%的氧化苄醇到苯甲醛,对于取代苯甲醇也有较高的转化率,达到93%以上。
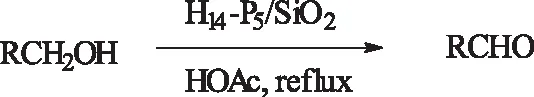
式16H14[NaP5W30O110]/SiO2催化醇的氧化
Scheme16H14[NaP5W30O110]/SiO2-
catalyzedoxidationofalcohols
Heravi等[39]在2007年将Preyssler类型的HPA化合物固载到硅胶上,合成负载型催化剂H14[NaP5W30O110]/SiO2,并构成以醋酸为溶剂,无需氧化剂,在118 ℃醋酸沸点温度下,回流一定时间(一般小于35 min),高效率的实现各类醇的氧化,并且收率大于95%。
2.4 其他金属催化剂
除上述一些常用的金属外,还有很多金属具有催化氧化醇到醛的能力。
2001年,Choudary 课题组[40]首次报道了用Ni-Al HTLC催化氧化醇。反应需在甲苯溶剂中,90 ℃氧气氛下进行。该催化体系较为简单,能很好的催化芳香基醇,选择性较好,在芳香醛的制备上具有一定的优势。但是对于其它醇效果不佳。
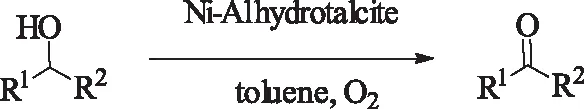
式17Ni-AlHTLC催化氧化醇
Scheme17Ni-AlHTLC-catalyzedoxidationofalcohols
2005年,Ebitani课题组[41]在Angew上报道了一种创新型的三金属催化剂RuIVMnIVMnIV/HT, (HT:hydrotalcite),记作:RuMn2/hydrotalcite,在1 atm氧气氛,60 ℃下,催化醇的氧化,该催化体系的转化率和收率均在90%之上。且3次循环利用催化苄醇的氧化,催化性能基本不变。

式18 RuMn2/hydrotalcite三金属催化醇的氧化Scheme 18 RuMn2/hydrotalcite-catalyzedoxidation of alcohols
同年,Tsukuda等人[42]把粒子尺寸小于5 nm的金纳米簇负载到聚合物PVP上制成催化剂(Au:PVP),室温下,在水中实现对羟基苄醇的氧化。但是,反应需要加3倍当量的碳酸钾,并且醇的水溶性要较好,才能获有较好的收率。该体系比较适用水溶性较好的醇。
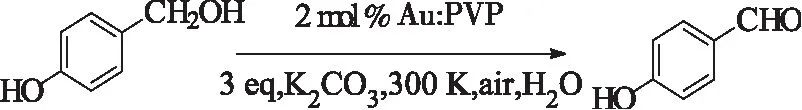
式19 Au:PVP催化的水溶性醇的氧化Scheme 19 Au:PVP-catalyzed oxidationof alcohols in water
2006年,Enache等人[43]在Science上发表了一篇以合金为催化剂催化氧化醇的方法。他们以Au-Pd/TiO2为催化剂,在100 ℃, 2 atm的氧气氛中,无溶剂条件下,能高效的氧化苄醇。在160 ℃, 1 atm氧气氛条件下,对苯乙醇的氧化TOF值最高达269 000 h-1,是催化氧化效率最高的催化体系。该体系主要能高效的催化氧化活泼的苄醇。
2013年,Huang等人[44]报道用P123负载的金银合金纳米颗粒在水相中催化苄醇的氧化。该催化体系在绿色溶剂水中进行,且体系较为简单。但是,该体系主要适用活泼性较高的芳基醇。
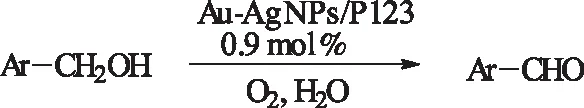
式20Au-AgNPs/P123催化苄醇氧化
Scheme20Au-AgNPs/P123-catalyzedoxidationofbenzylalcohols
2015年,Wang等人[45]合成Au@Pd包覆合金结构,以此为催化剂可用来催化苄醇的选择性氧化。该催化剂具有较高的活性,但是,催化剂的制作较为复杂,且都是贵重金属。
3光催化氧化
光能作为绿色无污染的能源,其在有机合成反应中的应用更加符合绿色化学的思想,近些年已经受到研究者的高度关注。
2008年,Yurdakal等人[46]在紫外光的照射下,于水溶液中,发现金红石型TiO2对苯甲醇及对甲氧基苯甲醇具有一定的光催化氧化性能,但是选择性不是很高。
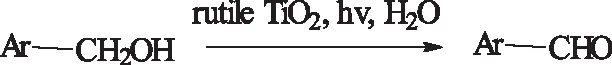
式21光促进催化氧化苯甲醇
Scheme21photocatalyticoxidationofbenzylalcohols
同年,Zhang等人[47]报道了经过染料敏化的TiO2在可见光照射,常压氧气氛中,无需任何溶剂下,与2,2,6,6-四甲基哌啶氧自由基(TEMPO)共同作用可以以100%的高选择性实现各类醇的选择性氧化。该体系是在光促进的作用下,节省了能源,但是仍需要价格昂贵的氧转移剂TEMPO。
2010年,Su等人[48]报道了一种光催化氧化的新体系。在可见光照射下,以三氟甲苯为溶剂,100 ℃,8 bar的高压氧气氛中,用mpg-C3N4为光催化剂,实现芳基醇氧化到对应的醛酮,反应时间较短,选择性较高。该催化体系的优点无需金属催化剂和氧自由基引发剂。但是,该体系使用了毒性较大的溶剂,且需要高压的条件。
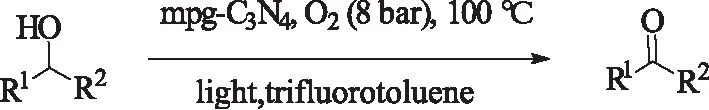
式22 光促进mpg-C3N4催化醇的氧化Scheme 22 mpg-C3N4-catalyzed oxidationof alcohols using O2 and visible light
4纳米颗粒催化
近年来,随着对纳米颗粒研究的兴起,其在有机合成反应方向的应用也在渐渐地增多。将纳米颗粒应用在醇的氧化反应上近些年也有报道。
2011年,Yao[49]课题组报道了用铜纳米颗粒催化的炔丙醇的选择性氧化。该催化体系需加入配体联吡啶,在以空气氛或TBHP(过氧化叔丁醇)为氧化剂,甲苯为溶剂,能高效的实现炔醇的氧化。

式23 铜纳米颗粒催化炔丙醇的氧化Scheme 23 Cu NPs-catalyzed oxidation ofpropargyl alcohols
在2015年,改组[50]报道了用碳氮材料负载型的铜纳米颗粒,无需配体添加剂的条件下,更加高效地实现炔丙醇的选择性氧化,反应时间2-8小时不等,且该催化剂可以循环使用[79]。
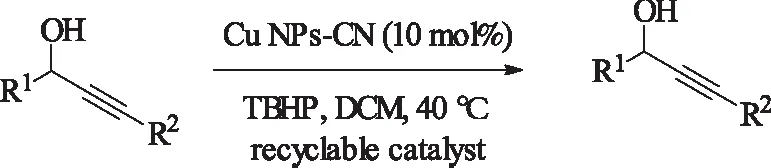
式24 Cu NPS-CN复合材料催化炔丙醇的氧化Scheme 24 Cu NPs-CN-catalyzedoxidation of propargyl alcohols
2013年,Huang等人[44]报道用P123负载的金银合金纳米颗粒在水相中催化苄醇的氧化。该催化体系在绿色溶剂水中进行,且体系较为简单。但是,该体系主要适用活泼性较高的芳基醇。
5小 结
醇的选择性氧化一直都是化学研究工作者研究的重点。均相催化、多相催化多使用过渡金属催化,主要是Pd、Cu、Ru等过渡金属。传统的常规催化体系的研究仍然有很大的研究空间。近年来,光催化醇氧化、纳米颗粒催化醇氧化渐渐成为人们研究的热点。光能作为自然能源,来源丰富,是公认的绿色能源;纳米颗粒有着独特的比表面特性,使其具有独特的催化活性。光催化、纳米颗粒催化方式比较符合绿色化学的思想。
[1] (a) Sheldon R A. Recent advances in green catalytic oxidations of alcohols in aqueous media [J]. Catal. Today, 2015, 247, 4~13; (b) Enache D I, Edwards J K, Landon P, Solsona-Espriu B., Carley A F, Herzing A A, Watanabe M, Kiely C J, Knight D W, Hutchings G J. Solvent-Free Oxidation of Primary Alcohols to Aldehydes Using Au-Pd/TiO2Catalysts [J]. Science, 2006, 311, 362~365.
[2] (a) Yasuhiro S, Takayuki H. Selective organic transformations on titanium oxide-based photocatalysts [J]. T. J. Photochem. Photobiol. C., 2008, 9, 157~170; (b) Zhang Y H, Tang Z R, Fu X Z, Xu Y J. Engineering the unique 2D mat of graphene to achieve garphene-TiO2nanocomposite for photocatalytic selective transformation: what advantage does graphene have over its forebear carbon nanotube [J]. ACS Nano., 2011, 5, 7 426~7 435.
[3] Sheldon R A, Arends I W C E, Dijksman A. New developments in catalytic alcohol oxidations for fine chemicals synthesis [J]. Catal. Today, 2000, 57, 157~166.
[4] Hudlicky M. Oxidation in Organic Chemistry, ACS Monograph Series [M]. Washington D C: Ameri. Chem. Sco., 1990.
[5] Menger F M, Lee C. Synthetically useful oxidations at solid sodium permanganate surface [J]. Tetrahedron Lett., 1981, 22, 1 655~1 656.
[6] Griffith W P. Ruthenium oxo complexes as organic oxidants [J]. Chem. Soc. Rev., 1992, 21, 179~185.
[7] (a) Alvarez R, Iglesias B, Lopez S, de Lera A. Stereocontrolled synthesis of all-(E) and (8Z)-anhydroretinol [J]. Tetrahedron Lett., 1998, 39, 5 659~5 662; (b) Paterson I, Delgado O, Florence G J, Lyothier I, Scott J P, Sereinig N. 1,6-Asymmetric induction in boron-mediated aldol reactions: Application to a practical total synthesis of (+)-discodermolide [J]. Org. Lett., 2002, 5, 35~38.
[8] Delaude L, Laszlo P. A novel oxidizing reagent based on potassium ferrate (VI) [J]. J. Org. Chem., 1996, 61, 6 360~6 370.
[9] (a) Chen L, Chen H, Luque R, Li Y. Metal-organic framework encapsulated Pd nanopaticles: towards advanced heterogeneous catalysts [J]. Chem. Sci., 2014, 5, 3 708~3 714; (b) Kantam M L, Arundhathi R, Likhar P R, Damodara D. Reusable copper-aluminum hydrotalcite/rac- BINOL system for room temperature selective aerobic oxidation of alcohols [J]. Adv. Syn. Catal., 2009, 351, 2 633~2 637; (c) Li Y, Gao Y, Yang C. A facile and efficient synthesis of polystyrene/gold-platinum composite particles and their application for aerobic oxidation of alcohols in water [J]. Chem. Commun., 2015, 51, 7 721~7 724; (d) Yamaguchi K, Mizuno N. Supported ruthenium catalyst for the heterogeneous oxidation of alcohols with molecular oxygen [J]. Angew. Chem. Int. Ed., 2002, 41, 4 538~4 542.
[10] (a) Nojima S, Kamata K, Suzuki K,Yamaguchi K. Selective oxidation with aqueous hydrogen peroxide by [PO4(WO(O2)2)4]3- supported on zinc-modified tin dioxide [J]. Chem. Cat. Chem., 2015, 7, 1 097~1 104; (b) Shen D, Miao C, Xu D, Xia C, Sun W. Highly efficient oxidation of secondary alcohols to ketones catalyzed by manganese complexes of N4 ligands with H2O2[J]. Org. Lett., 2014, 17, 54~57.
[11] Srivastava S, Singh S. Rh (III) catalyzed oxidation of cyclic alcohols by sodium periodate in acidic medium [J]. Asian J. Chem., 2008, 20, 4 773~4 780.
[12] Peterson B M, Herried M E, Neve R L, McGraff R W. Oxidation of primary and secondary benzylic alcohols with hydrogen peroxide and tert-butyl hydroperoxide catalyzed by a “helmet” phthalocyaninato iron complex in the absence of added organic solvent [J]. Dalton Trans., 2014, 43, 17 899~17 903.
[13] Semmelhack M F, Schmid C R, Cortes D A, Chou C S. Oxidation of alcohols to aldehydes with oxygen and cupric ion, mediated by nitrosonium ion [J]. J. Am. Chem. Soc., 1984, 106, 3 374~3 376.
[14] Nooy A E J de, Besemer A C, Bekkum H van. On the use of stable organic nitroxyl radicals for the oxidation of primary and secondary alcohols [J]. Synthesis, 1996, 10: 1 153~1 174.
[15] Dijksman A, Marino-González A, Mairata i Payeras A, Arends I W C E. Sheldon R A, Efficient and selective aerobic oxidation of alcohols into aldehydes and ketones using ruthenium/TEMPO as the catalytic system [J]. J. Am. Chem. Soc., 2001, 123, 6 826~6 833.
[16] Ansari I A, Gree R. TEMPO-catalyzed aerobic oxidation of alcohols to aldehydes and ketones in ionic liquid [bmim][PF6] [J]. Org. Lett., 2002, 4, 1 507~1 509.
[17] Gamez P, Arends I W C E, Reedigk J, Sheldon R A. Copper (II)-catalyzed aerobic oxidation of primary alcohols to aldehydes [J]. Chem. Commun., 2003, 19, 2 414~2 415.
[18] Nishimura T, Onoue T, Ohe K, Uemura S. Pd(OAc)2-catalyzed oxidation of alcohols to aldehydes and ketones by molecular oxygen [J]. Tetrahedron Lett., 1998, 39, 6 011~6 014.
[19] Blackbum T F, Schwartz J. Homogeneous catalytic oxidation of secondary alcohols to ketones by molecular oxygen under mild conditions [J]. J. Chem. Soc., Chem. Commun., 1997, 157~158.
[20] Peterson K P, Larcok R C. Palladium-catalyzed oxidation of primary and secondary allylic and benzylic alcohols [J]. J. Org. Chem., 1998, 63, 3 185~3 189.
[21] Bj?rsvik H R, Liguori L, Minisci F. A new nodified “montanari oxidation process” by means of chlorine dissolved in the reaction solvent as oxidant and TEMPO as catalyst: oxidation of 3-S-quinuclidinol to 3-quinuclidi- none [J]. Org. Proc. Res. Dev., 2002, 6, 197~200.
[22] (a) Steinhoff B A, Fix S R, Stahl S S. Mechanistic study of alcohol oxidation by the Pd(OAc)2/O2/DMSO catalyst system and implications for the development of improved aerobic oxidation catalysts [J]. J. Am. Chem. Soc., 2002, 124, 766~767; (b) Steinhoff B A, Stahl S S. Ligand-modulated palladium oxidation catalysis: mechanistic insights into aerobic alcohol oxidation with the Pd(OAc)2/pyridine catalyst system [J]. Org. Lett., 2002, 4, 4 179~4 181.
[23] Ten Brink G J, Arends I W C E, Sheldon R A. Green, catalytic oxidation of alcohols in water [J]. Science, 2000, 287, 1 636~1 639.
[24] Ten Brink G J, Arends I W C E, Sheldon R A. Catalytic conversions in water. Part 21: mechanistic investigations on the palladium-catalysed aerobic oxidation of alcohols in water [J]. Adv. Synth. Catal., 2002, 344, 355~369.
[25] Buffin B P, Clarkson J P, Belitz N L, Kundu A. Pd(II)-biquinoline catalyzed aerobic oxidation of alcohols in water [J]. J. Mol. Catal. A: Chem., 2005, 225, 111~116.
[26] (a) Markó I E, Gautier A, Dumeunier R, Doda K, Philippart F, Brown S M, Urch C J. Efficient, copper-catalyzed, aerobic oxidation of primary alcohols [J]. Angew. Chem. Int. Ed., 2004, 43, 1 588~1 591; (b) Velusamy S, Srinivasan A, Punniyamurthy T. Copper(II) catalyzed selective oxidation of primary alcohols to aldehydes with atmospheric oxygen [J]. Tetrahedron Lett., 2006, 47, 923~926.
[27] Jiang N, Ragauskas A J. Vanadium-catalyzed selective aerobic alcohol oxidation in ionic liquid [bmim]PF6[J]. Tetrahedron Lett., 2007, 48, 273~276.
[28] Suzuki T, Morita K, Tsuchida M, Hiroi K. Iridium-catalyzed oppenauer oxidations of primary alcohols using acetone or 2-butanone as oxidant [J]. J. Org. Chem., 2003, 68, 1 601~1 602.
[29] Paraskevopoulou P, Psaroudakis N, Koinis S, Stavropoulos P, Mertis K. Catalytic selective oxidation of benzyl alcohols to aldehydes with rhenium complexes [J]. J. Mol. Catal. A: Chem., 2005, 240, 27~32.
[30] Korovchenko P K, Donze C, Gallezot P, Besson M. Oxidation of primary alcohols with air on carbon-supported platinum catalysts for the synthesis of aldehydes or acids [J]. Catal. Today, 2007, 121, 13~21.
[31] Sugimura T, Futagawa T, Mori A, Ryu I, Sonoda N, Tai A. A stereochemical study of the isomerization of cyclopropyl ethers to allyl ethers catalyzed with zinc iodide [J]. J. Org. Chem., 1996, 61, 6 100~6 103.
[32] Martin S E, Suárez D F. Catalytic aerobic oxidation of alcohols by Fe(NO3)3-FeBr3[J]. Tetrahedron Lett., 2002, 43, 4 475~4 479.
[33] (a) Dijksman A, Arends I W C E, Sheldon R A. Polymer immobilized TEMPO(PIPO): an efficient catalyst for the chlorinated hydrocarbon solvent-free and bromide-free oxidation of alcohols with hypochlorite [J]. Chem. Commun., 2000, 271~272; (b) Sheldon R A, Arends I W C E. Catalytic oxidations mediated by metal ions and nitroxyl radicals [J]. J. Mol. Catal. A: Chem., 2006, 251, 200~214.
[34] (a) Bolm C, Fey T. TEMPO oxidation with a silica-supported catalyst [J]. Chem. Commun., 1999, 1 795~1 796; (b) Fey T, Fischer H, Bachmann S, Albert K, Bolm C. Silica-supported TEMPO catalysts: sunthesis and application in the anelli oxidation of alcohols [J]. J. Org. Chem., 2001, 66, 8 154~8 159.
[35] Kakiuchi N, Maeda Y, Nishimura T, Uemura S. Pd(II)-hydrotalcite-catalyzed oxidation of alcohols to aldehydes and ketones using atmospheric pressure of air [J]. J. Org. Chem., 2001, 66, 6 620~6 625.
[36] Mori K, Hara T, Mizugaki T, Ebitani K, Kaneda K. Hydroxyapatite-supported palladium nanoclusters: a highly active heterogeneous catalyst for selective oxidation of alcohols by use of molecular oxygen [J]. J. Am. Chem. Soc., 2004, 126, 10 657~10 666.
[37] Layer K, Maheswaran H, Arundhathi R, Kantam M L, Bhargava S K. Nanocrystallinemagnesium oxide stabilized palladium (0): an efficient reusable catalyst for room temperature selective aerobic oxidation of alcohols [J]. Adv. Syn. Catal., 2011, 353, 606~616.
[38] Neumann R, Khenkin A M, Vigdergauz I. Quinones as co-catalysts and models for the surface of active carbon in the phosphovanadomolybdate-catalyzed aerobic oxidation of benzylic and allylic alcohols: synthetic, kinetic, and mechanistic aspects [J]. Chem. Eur. J., 2000, 6, 875~882.
[39] Heravi M M, Zadsirjan V, Bakhtiari K, Oskooie H A, Bamoharram F F. Green and reusable heteropolyacid catalyzed oxidation of benzylic, allylic and aliphatic alcohols to carbonyl compounds [J]. Catal. Commun., 2007, 8, 315~318.
[40] Choudary B M, Kantam M L, Rahman A, Reddy C V, Rao K K. The first example of activation of molecular oxygen by nickel in Ni-Al hydrotalcite: a novel protocol for the selective oxidation of alcohols [J]. Angew. Chem. Int. Ed., 2001, 40, 763~766.
[41] Ebitani K, Motokura K, Mizugaki T, Kaneda K. Heterotrimetallic RuMnMn species on a hydrotalcite surface as highly efficient heterogeneous catalysts for liquid-phase oxidation of alcohols with molecular oxygen [J]. Angew. Chem. Int. Ed., 2005, 44, 3 423~3 426.
[42] Tsunoyama H, Sakurai H, Negishi Y, Tsukuda T. Size-specific catalytic activity of polymer-stabilized gold nanoclusters for aerobic alcohol oxidation in water [J]. J. Am. Chem. Soc., 2005, 127, 9 374~9 375.
[43] Enache D I, Edwards J K, Landon P, Solsona-Espriu B., Carley A F, Herzing A A, Watanabe M, Kiely C J, Knight D W, Hutchings G J. Solvent-free oxidation of primary alcohols to aldehydes using Au-Pd/TiO2catalysts [J]. Science, 2006, 311, 362~365.
[44] Huang X M, Wang X G, Wang X S, Wang X X, Tan M W, Ding W Z, Lu X G. P123-stabilized Au-Ag alloy nanoparticles for kinetics of aerobic oxidation of benzyl alcohol in aqueous solution [J]. J. Catal., 2013, 301, 217~226.
[45] Wang H W, Wang C L, Yan H, Yi H, Lu J L. Precisely-controlled synthesis of Au@Pd core-shell bimetallic catalyst via atomic layer deposition for selective oxidation of benzyl alcohol [J]. J. Catal., 2015, 324, 59~68.
[46] Yurdakal S, Palmisano G, Loddo V, Augugliaro V, Palmisano L. Nanostructured rutile TiO2for selective photocatalytic oxidation of aromatic alcohols to aldehydes in water [J]. J. Am. Chem. Soc., 2008, 130, 1 568~1 569.
[47] Zhang M, Chen C, Ma W, Zhao J. Visible- light-induced aerobic oxidation of alcohols in a coupled photocatalytic system of dye-sensitized TiO2and Tempo [J]. Angew. Chem. Int. Ed., 2008, 47, 9 730~9 733.
[48] Su F Z, Mathew S C, Lipner G, Fu X Z, Antonietti M, Blechert S, Wang X C. mpg-C3N4-catalyzed selective oxidation of alcohols using O2and visible light [J]. J. Am. Chem. Soc., 2010, 132, 16 299~16 301.
[49] Han C Y, Yu M, Sun W J, Yao X Q. Ligand-promoted, copper nanoparticles catalyzed oxidation of propargylic alcohols with TBHP or air as oxidant [J]. Synlett., 2011, 16, 2 363~2 368.
[50] Lv W, Tian J, Deng N, Wang Y, Zhu X S, Yao X Q. Dual-immobilized catalyst: carbon nitride-supported copper nanoparticles catalyzed oxidation of propargylic alcohols [J]. Tetrahedron Letters, 2015, 56, 1 312~1 316.
