万古霉素致患者肝功能异常分析
2018-01-12杨蒙蒙
孙 涛,杨蒙蒙,杨 鹏,郑 瑶,张 琰
(第四军医大学唐都医院药学部,西安 710038)
自20 世纪90 年代以来,万古霉素一直被国际抗生素专家誉为“人类对付顽固性耐药菌株的最后一道防线”,通常只在常用抗菌药物无效时才应用,特别是用于耐甲氧西林金黄色葡萄球菌(MRSA)引起的感染,但万古霉素的个体差异大,不良反应多[1-3]。
肝脏是身体内的重要代谢器官,在药物分解代谢过程中发挥着重要作用[4]。同时,药物也可以引起肝损伤[5]。据WHO统计,药物性肝损伤已成为全球第5位人类死亡原因[6],据统计,我国由药物导致肝损伤患者占肝病患者的l%~5%,占急性肝炎患者的10%,占暴发性肝衰竭患者的13%~30%[7-8]。目前已有临床案例报道万古霉素诱导了肝损伤[9],本文通过对我院近一年内1 083名使用万古霉素的住院患者进行回顾性调查,统计并分析其中发生肝功能异常患者的用药情况,为促进万古霉素的合理用药提供依据。
1 资料与方法
1.1调查对象 从我院HIS系统中调取2015年8月~2016年7月使用万古霉素住院患者病例1 083份。
1.2数据采集 在抽取的病例中,统计患者的基本情况,包括患者的年龄、性别、体质量、疾病或症状名称和万古霉素的使用情况。
1.3肝功能检查方法 采用国际临床化学联合会(IFCC)推荐的谷丙转氨酶(ALT)和谷草转氨酶(AST)检测标准程序检测ALT和AST活性。
1.4万古霉素导致肝功能异常 患者筛选标准:①肝功能异常前有明确的万古霉素使用;②用药后肝功能检查ALT或AST单项升高,而其中有一项超过正常上限的2倍;③排除甲、乙、丙、丁、戊型肝炎,巨细胞病毒性肝炎,EB病毒性肝炎,酒精性肝炎,脂肪肝等;④排除心功能不全或其他原因所致肝损伤;⑤原有病毒性肝病史或肝炎病毒血清学标志阳性者,用药前无症状且肝功能正常;⑥根据肝功能异常发生的时间、程度、转归判断肝功能异常与万古霉素的关系。

2 结果
2.1患者一般情况 总病例数为1 083份,剔除103份无效病例,有效病例为980份。患者男性多于女性,按照人数以年龄分段划分从多到少依次为中年、青年、老年、儿童、少年,见表1;按照人数以感染部位划分由多到少依次为肺部、脑部、关节、腹部、血液、其他,见表2。
表1使用万古霉素患者的信息
Tab.1 The information of patients administrated vancomycin

性别例数年龄段儿童(<7岁)少年(≥7~<18岁)青年(≥18~<41岁)中年(≥41~<66岁)老年(≥66岁)男6863525126378122女2943386214348
表2使用万古霉素患者的主要感染部位
Tab.2 The main infection sites of patients administrated vancomycin
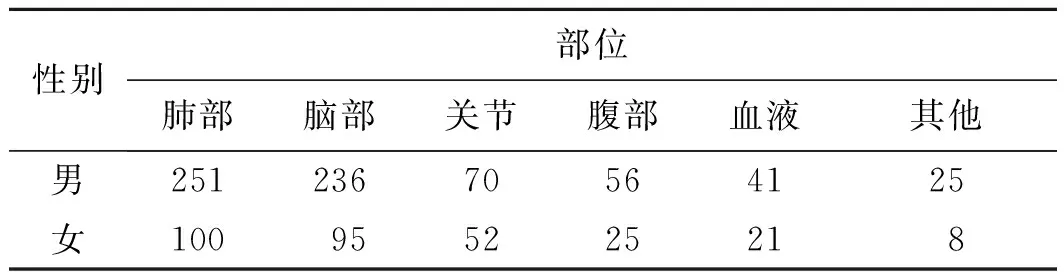
性别部位肺部脑部关节腹部血液其他男25123670564125女100955225218
2.2患者给药情况 患者均按照盐酸万古霉素说明书规定的用法用量使用,根据年龄、体质量和症状适量增减。成人一般给药剂量为500 mg,8 h,或1 g,12 h;老年患者500 mg,12 h,或1 g,24 h;儿童、婴儿每日40 mg·kg-1,分2~4次静脉滴注;新生儿每次给药量为10~15 mg·kg-1,出生1周内的新生儿每12 h给药1次,出生1 周~1月的新生儿每8 h给药1次。每次静脉滴注时间都在60 min以上,给药持续时间为8.32±2.96 d。
2.3发生肝功能异常患者一般情况 980名患者中,有13名肝功能发生异常,总发生率为1.33%,男性多于女性;按照人数以年龄分段划分:中年>青年>老年=儿童>少年,见表3;按照人数以感染部位划分:肺部>脑部>关节=腹部>血液=其他,见表4。
表3万古霉素导致肝功能异常患者的信息
Tab.3 The information of patients with liver dysfunction induced by vancomycin

性别例数年龄段儿童(<7岁)少年(≥7~<18岁)青年(≥18~<41岁)中年(≥41~<66岁)老年(≥66岁)男811231女510121发生率/%1.332.943.031.600.961.18
表4万古霉素导致肝功能异常患者的主要感染部位
Tab.4 The main infection sites of patients with liver dysfunction induced by vancomycin
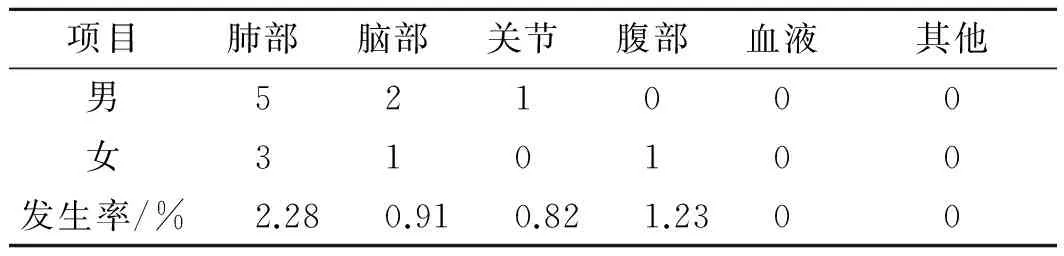
项目肺部脑部关节腹部血液其他男521000女310100发生率/%2.280.910.821.2300
2.4发生肝功能异常患者AST和ALT变化 13名发生肝功能异常的患者,静脉滴注万古霉素前AST(29.09±11.12 U·L-1)和ALT(30.64±12.80[(U·L-1])活性均为正常水平,AST/ALT为0.98±0.23。正常给药剂量持续静脉滴注万古霉素6.27±2.14 d,在滴注5.55±2.25 d发生肝功能异常,AST(85.18±50.77 U·L-1)和ALT(141.00±86.26 U·L-1)显著升高(P<0.01),ALT活性的升高程度超过AST,AST/ALT为0.85±0.75。停止使用万古霉素后5.15±1.29 d,所有患者的AST(37.55±27.79 U·L-1)和ALT(47.09±26.56 U·L-1)活性均下降,AST/ALT为0.82±0.46,除有2名患者外,其余患者均恢复正常,见图1。
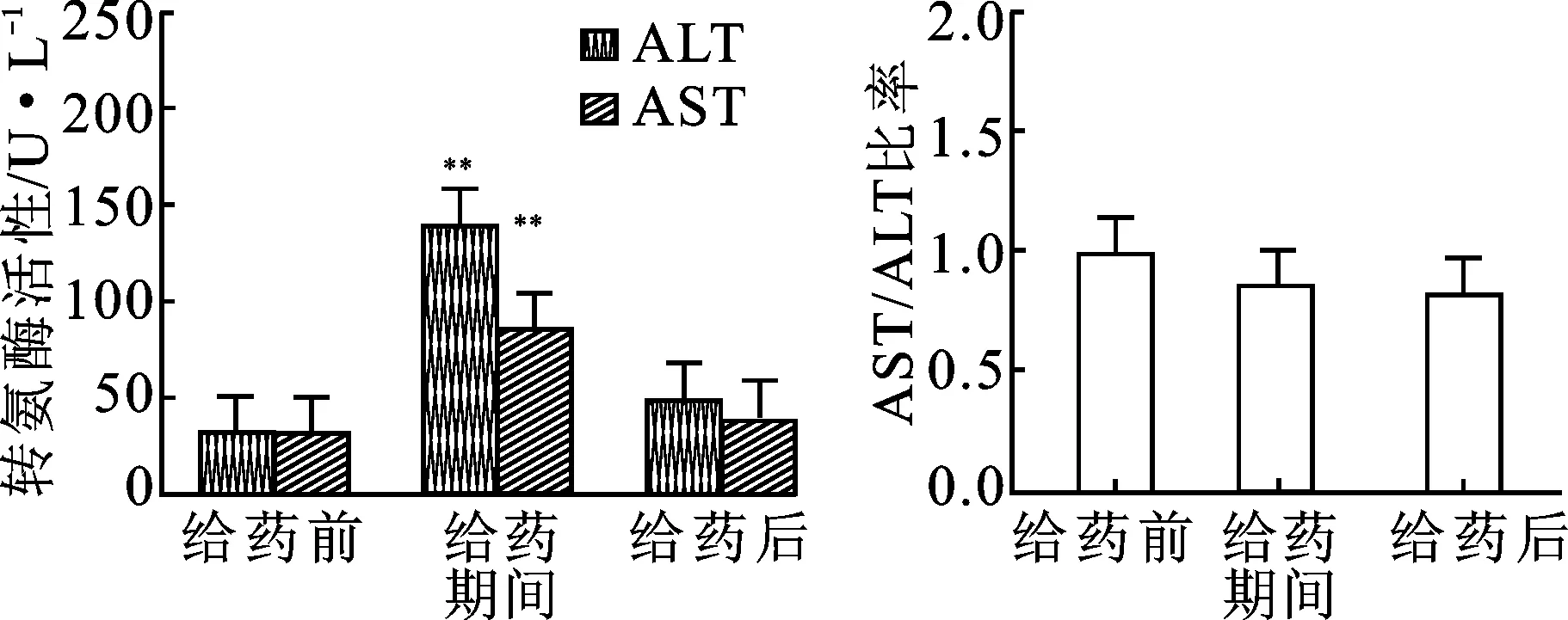
图1万古霉素导致肝功能异常患者肝功能的经时变化
A.万古霉素导致转氨酶活性;B.AST/ALT比率变化。与给药前比较* *P<0.01。
Fig.1 The ongoing changes of liver function in the patients with liver dysfunction induced by vancomycin
A.the changes of transaminase activity induced by vancomycin;B.the rate of AST/ALT.* *P<0.01 vs before administration.
3 讨论
万古霉素是链霉菌属衍生的三环糖肽类抗生素,主要作用机制为抑制细菌RNA合成,阻碍细菌细胞壁的形成,从而改变其通透性,以达到杀菌目的,对多种耐药性细菌均有良好的杀菌效果[10]。近年来由于MRSA、耐甲氧西林表皮葡萄球菌(MRSE)的感染增加,又发现难辨梭菌(CD)是形成抗生素相关性的伪膜性肠炎的主要病因,使得万古霉素的应用日渐增多[1]。我院几乎所有临床科室均有万古霉素的使用,但主要是在呼吸内科、脑外科、骨科和血液科使用,这可能与这些科室G+感染的概率较高有关。
万古霉素虽然临床疗效确实,但治疗窗较窄,不良反应多[2-3,11],本文探讨了万古霉素诱导的肝毒性。980名住院患者中,13名患者发生肝功能异常(发生率为1.33%)。根据国际医学科学组织委员会(Counsil for International Organization of Medical Sciences,CIOMS)制定的药物不良反应发生频率标准,万古霉素诱导的肝功能异常属于常见(≥1%,<10%)不良反应。分析发现,各年龄段和不同感染部位患者使用万古霉素后肝功能异常发生率是不同的,这可能源于我们所涉及的肝功能异常患者例数较少而存在抽样误差。
研究发现,万古霉素诱导的肝脏功能异常以ALT的增高程度超过AST的增高程度为特征,AST/ALT的比值小于1,且停用万古霉素后可在较短的时间内肝功能恢复正常,因此,我们认为万古霉素诱导的肝脏损伤较为轻微。
目前认为药物性肝损伤的发生机制主要有2种,即直接肝毒性和不良的免疫反应[12]。大多数情况下,药物性肝损伤由可能造成肝细胞损害的药物直接作用或药物的活性代谢产物引起。肝细胞的损害也可能触发先天免疫系统的细胞活性(如Kupffer细胞和自然杀伤细胞)而引起炎性反应和(或)获得性免疫应答的激活[13-14]。万古霉素引起血清转氨酶水平升高的机制可能是由于其中的一个途径,或两者兼而有之。
总之,万古霉素诱导的肝脏损伤较常见,损伤程度较轻微,依然应引起临床医生和药师的重视。因此,在应用万古霉素前,应全方面地对患者进行安全性评价,严格控制用药间隔时间和剂量,并需要监测各项生化指标,如果条件允许,应该监测万古霉素的血药浓度,从而有效降低万古霉素的不良反应[15-16]。如出现肝功能异常应停药,并根据患者情况给予适当处理措施,以保障患者安全用药和规避医师职业风险。
[1] 宋盼,邓佩佩.万古霉素研究现状及发展[J].河北化工,2012,35(4):20-22.
[2] Levy J H,Marty A T.Vancomycin and adverse drug reactions[J].Crit Care Med,1993,21(8):1107-1108.
[3] Sinha Ray A,Haikal A,Hammoud K A,et al.Vancomycin and the risk of aki:a systematicreview and Meta-analysis[J].Clin J Am Soc Nephrol,2016,11(12):2132-2140.
[4] Almazroo O A,Miah M K,Venkataramanan R.Drug metabolism in the liver[J].Clin Liver Dis,2017,21(1):1-20.
[5] Katarey D,Verma S.Drug-induced liver injury[J].Clin Med,2016,16(Suppl 6):S104-S109.
[6] 任东东,邓存良.药物性肝损伤的研究进展[J].西南军医,2014,16(6):670-672.
[7] 张盛,熊枝繁.药物性肝病的研究进展[J].中国明康医学,2013,25(1):87-121.
[8] 刘晓燕,陈婧,王晓霞,等.3 233例急性、亚急性、慢加急性肝衰竭病因特点分析[J].临床医学工程,2012,19(5):823-825.
[9] 秦楠,尤艳明,张春雷,等.万古霉素导致急性肝损伤1例[J].中华临床医师杂志:电子版,2013,7(21):9818-9819.
[10]时友忠,安洪亮,李泰平,等.我院ICU 298例次万古霉素血药浓度监测与临床用药分析[J].药学与临床研究,2012,20(6):541-543.
[11]Bamgbola O.Review of vancomycin-induced renal toxicity:an update[J].Ther Adv Endocrinol Metab,2016,7(3):136-147.
[12]Cadle R M,Mansouri M D,Darouiche R O.Vancomycin-induced elevation of liver enzyme levels[J].Ann Pharmacother,2006,40(6):1186-1189.
[13]Holt M P,Ju C.Mechanisms of drug-induced liver injury[J].AAPS J,2006,8(1):E48-E54.
[14]Naisbitt D J,Farrell J,Wong G,et al.Characterization of drug-specific T cells in lamotrigine hypersensitivity[J].J Allergy Clin Immunol,2003,111(6):1393-1403.
[15]何杰文,范华.万古霉素的不良反应[J].海峡药学杂志,2011,23(11):235-236.
[16]孙浩,徐英宏,刘晓东,等.万古霉素血清药物浓度监测及临床应用分析[J].实用药物与临床,2013,16(6):521-524.
