嗜水气单胞菌分离鉴定与药敏试验
2018-01-12王帅兵熊良伟朱善元徐建生吴海波
王帅兵, 熊良伟, 朱善元,2, 徐建生, 吴海波, 王 婧, 张 龙
(1.江苏农牧科技职业学院,江苏泰州 225300; 2.江苏省兽用生物制药高技术研究重点实验室,江苏泰州 225300;3.扬州大学兽医学院,江苏扬州 225009)
嗜水气单胞菌(Aeromonashydrophila)是广泛存在于水体中的一种正常共栖菌,有致病菌和非致病菌之分。致病性嗜水气单胞菌是水生动物细菌性疾病的主要病原之一,可引起鱼、蛙、鳖等水生动物出血性败血症[1]。近年来,该病在我国各地广泛流行,大规模暴发,死亡率高,给水产养殖业造成巨大经济损失。使用抗菌药是目前防治水生动物细菌性疾病的主要手段。然而,大量研究证明,嗜水气单胞菌已对多种药物产生耐药性[2-3],给水生动物疾病防治带来困难。
本试验从江苏、上海等不同地区疑似嗜水气单胞菌病的水生动物采集病料,进行细菌分离,以嗜水气单胞菌标准株为参照,经鉴定获得4个不同来源的嗜水气单胞菌,进行药敏试验并作比较分析,为有效防治嗜水气单胞菌病、监控嗜水气单胞菌的耐药性提供参考。
1 材料与方法
1.1 试剂
细菌生化反应微量、营养琼脂培养基、肉汤培养基、AHM鉴别培养基、5%兔血平板、1%脱脂奶蔗糖胰蛋白胨、药敏纸片均购自杭州微生物试剂有限公司。
1.2 试验用动物
异育银鲫,约100 g/尾,购自江苏省泰州市某水产养殖场,购回后在实验室训养、观察1周无异常情况,备用。
1.3 病原菌的分离与纯培养
无菌操作取疑似出血病的鱼病灶组织(血液、肺、肝胰腺、肾脏等),分别接种于普通琼脂培养基,28 ℃培养24 h,分别挑取可疑菌落,涂片进行革兰氏染色镜检。
挑取革兰氏镜检为阴性短杆菌的疑似菌落在普通琼脂培养基上多次划线纯化,直至得到形态一致、特征稳定的菌落。选取单个菌落转接到琼脂斜面28 ℃培养18 h,置4 ℃冰箱保存、编号备用。
1.4 革兰氏染色及生理生化特性试验
分离菌株及标准株分别连续单传3代纯培养后挑取单个菌落,进行革兰氏染色镜检,穿刺接种AHM培养基及接种微量生化管,按常规方法进行AHM鉴别培养、氧化酶试验及吲哚、甲基红、鸟氨酸脱羧酶、葡萄糖、蔗糖、阿拉伯糖、七叶苷、水杨苷等生化鉴定。
1.5 菌株的致病性鉴别
1.5.1 溶血试验和溶蛋白试验 取纯培后的单个菌落分别划线接种于5%无菌兔血平板和1%脱脂奶蔗糖胰蛋白胨平板,置28 ℃培养24 h后观察溶血情况和溶蛋白情况。兔血平板上若在菌落周围形成不透明的草绿色溶血环,认定为α溶血;若在菌落周围形成清晰、完全透明的溶血环,则认定为β溶血;若菌落周围无溶血现象,则认定为γ溶血。1%脱脂奶蔗糖胰蛋白胨平板若菌落周围出现清晰、透明的溶蛋白圈,则认定为阳性,否则为阴性。
1.5.2 毒力因子提取与检测 (1)Aer毒素的提取与检测。各菌株接种到肉汤培养基后28 ℃培养48~60 h,4 500 r/min离心,取上清。参照文献[4]的方法,先用20%饱和度硫酸铵在 4 ℃ 沉淀4 h,5 000 r/min离心后取上清,再用60%饱和度硫酸铵沉淀,4 ℃过夜,5 000 r/min离心,沉淀用50 mmol/L Tris-HCl(pH值为7.8~8.0)溶解后透析2 d,12 000 r/min离心 5 min,上清进行SDS-PAGE电泳。
(2)胞外蛋白酶(ECPase)的提取与检测。各菌株分别用肉汤培养基于28 ℃培养48~60 h,4 500 r/min离心,取上清,参照文献[5]的方法,用70%饱和度硫酸铵沉淀,4 ℃过夜,5 000 r/min 离心,沉淀用50 mmol/L Tris-HCl(pH值7.8~8.0)溶解并透析2 d,12 000 r/min离心5 min,上清进行 SDS-PAGE电泳。
1.5.3 回归感染试验 嗜水气单胞菌接种于琼脂平板,于28 ℃培养18~20 h,挑取单个菌落接种于琼脂平板扩大培养18~24 h。无菌条件下向培养皿中加入少量无菌生理盐水,用玻璃刮仔细刮下菌苔。离心,取沉淀用生理盐水洗涤2次。用1 mL生理盐水悬浮,分光光度法测菌液浓度后,用无菌肉汤培养基分别调整菌浓度至1×108CFU/mL。将2种浓度的菌液肌肉注射进行攻菌,剂量为1 mL/尾[6],同时用无菌肉汤培养基作阴性对照。10尾鱼/组,每天换水1/3,每3~4 h观察并记录死亡情况,对死亡鱼进行解剖和病原再分离,以确定是否由攻毒活菌引起死亡。
1.6 药敏试验
按K-B药敏纸片扩散法[7]进行操作,取单个菌落接种于肉汤培养基中,37 ℃培养16 h,调整菌浓度相当于0.5麦氏单位。用无菌棉拭子蘸取调整好的菌液于管壁挤去多余液体,均匀涂布于营养琼脂平板,待培养基表面干燥后放置药敏纸片使其紧贴培养基表面,各纸片的中心距离不小于24 mm,纸片距培养皿边缘的距离不小于15 mm。于28 ℃培养24 h后,用游标卡尺量取抑菌圈直径,根据杭州微生物试剂有限公司提供的标准判断分离菌株对药物敏感性。
2 结果
2.1 细菌形态观察及AHM鉴别反应
标准株及4株分离菌在普通琼脂培养基上于28 ℃培养24 h后生长良好,标准株及4个菌株菌落特征均为圆形、表面光滑、中央凸起、边缘整齐、白色、不透明、大小约2 mm。在肉汤培养基中培养24 h后培养基明显变浑浊,试管底部有乳白色沉淀,轻摇后乳白色沉淀均匀悬浮。取琼脂培养基上的单个菌落分别进行革兰氏染色后镜检均可见红色、两端钝圆的短杆菌,判定为革兰氏阴性杆菌。4株分离菌在AHM鉴定培养基上沿穿刺线呈刷状生长(运动力为阳性),培养基顶部显紫色,底部为淡黄色,与嗜水气单胞菌标准株特性一致。标准株及4株分离菌编号及来源见表1。

表1 5株分离菌的编号及来源
2.2 分离菌株生理生化特性
筛选出的4株分离菌吲哚、氧化酶试验均呈阳性。葡萄糖、麦芽糖、蔗糖、甘露糖、阿拉伯糖、七叶苷、水杨苷等糖发酵试验均呈阳性,不能利用乳糖和鸟氨酸,与标准株反应一致,符合致病性嗜水气单胞菌特性[8]。生理生化特性试验结果见表2。
2.3 分离菌株致病性及毒力因子检测结果
4个分离菌株与标准株溶血试验均表现为β溶血,溶蛋白试验均可见明显的溶蛋白圈,表明分离菌及标准株均具致病性(表3)。
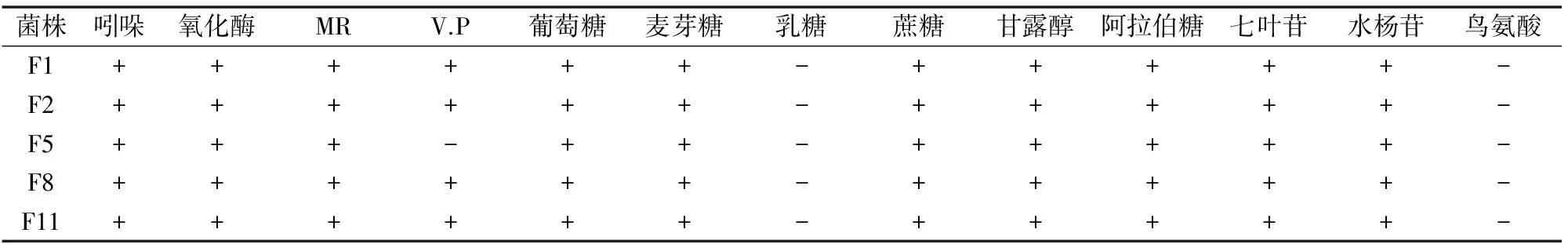
表2 生化试验结果
注:“+”表示阳性反应,“-”表示阴性反应。

表3 5株分离菌的毒性试验结果
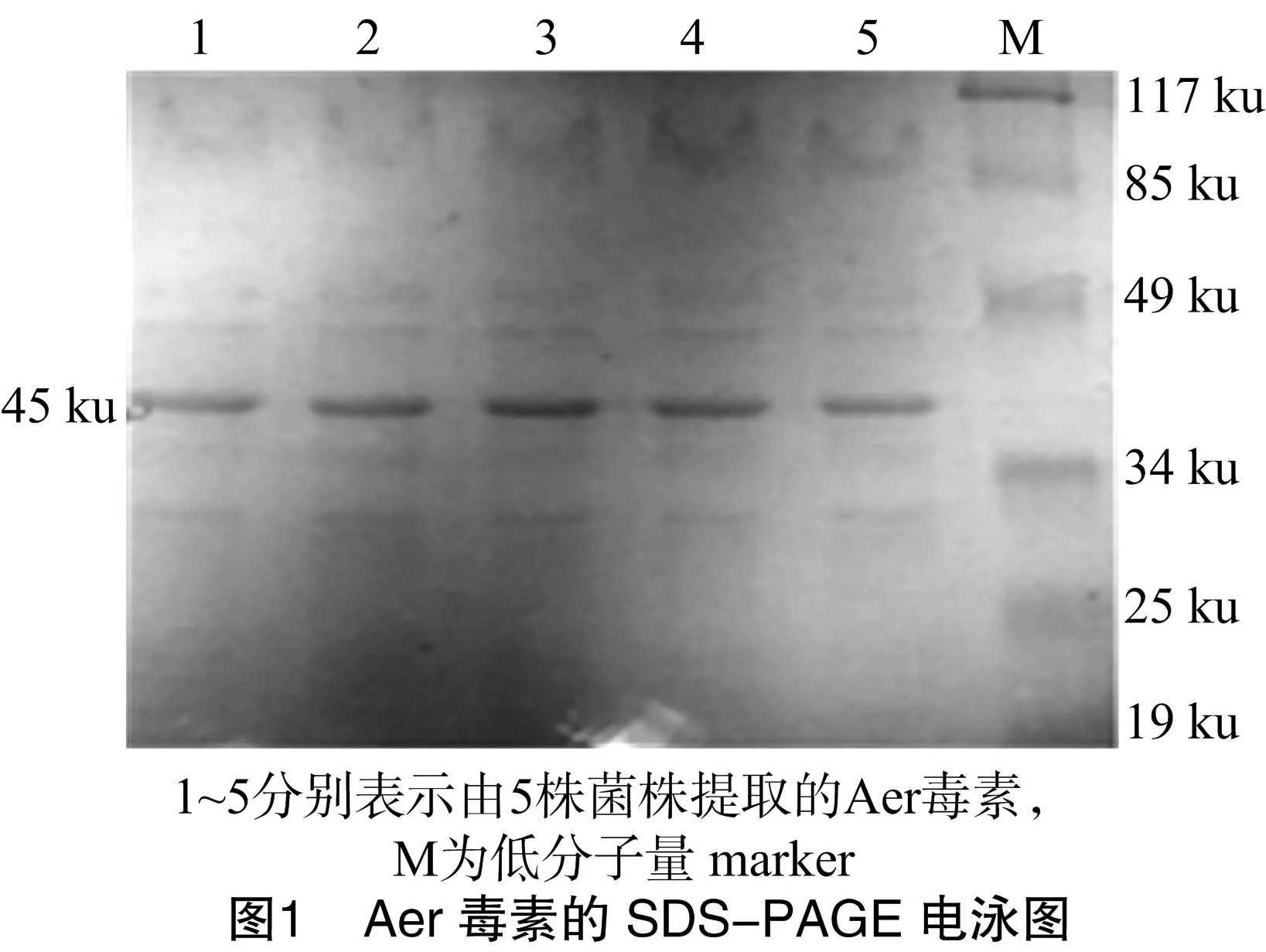
提取毒力因子Aer毒素和ECPase,进行SDS-PAGE电泳后均可找到相应条带,各菌株的Aer毒素约为45 ku,杂带少;各菌株的ECPase约为35 ku,杂带相对较多。SDS-PAGE电泳结果见图1、图2。
2.4 回归试验结果
试验组鲫鱼在接种感染后12 h表现出游动变缓、摄食减少或拒食现象,此后相继出现体平衡能力减弱、废食等现象,在接种后3~5 d开始出现明显死亡,到7 d时死亡率均达60%以上,阴性对照组在试验期内正常存活,未出现死亡(表4)。对感染死亡的鱼进行分离培养、镜检、生化鉴定,结果与嗜水气单胞菌特征一致。
2.5 药敏试验结果
4个菌株及标准株对14种抗菌药物敏感性结果见表5。由表5可知,包括标准菌株在内的5个菌株对阿米卡星、左氧氟沙星和氟苯尼考均表现出高度敏感性;对氨苄西林、阿莫西林、红霉素和四环素基本不敏感;5个菌株对阿奇霉素、链霉素、庆大霉素、多西环素、诺氟沙星、环丙沙星、 复方新诺明的敏感性表现不尽相同,对链霉素、庆大霉素总体表现敏感,对阿奇霉素、多西环素、诺氟沙星、环丙沙星、复方新诺明均表现出一定的耐药性。
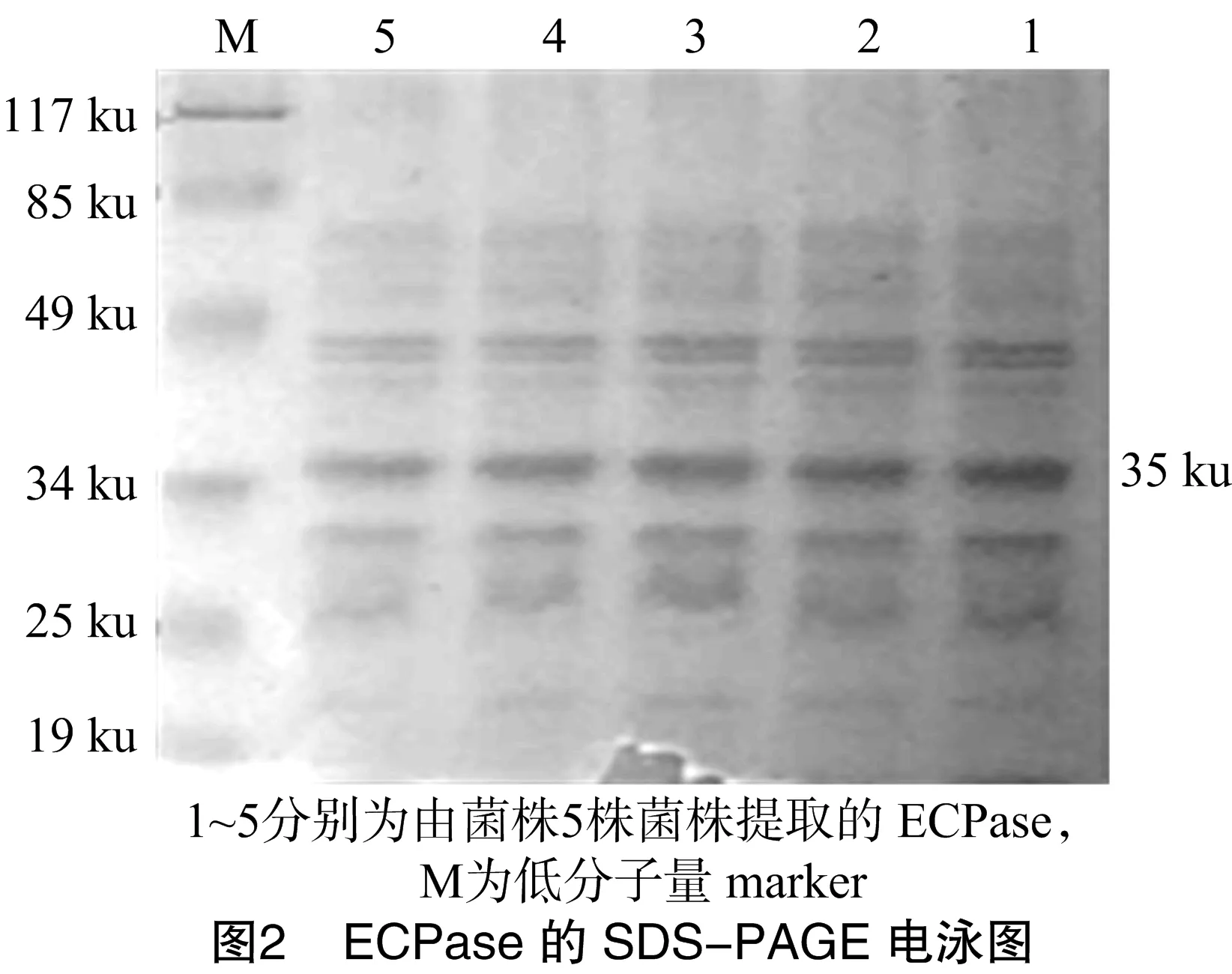
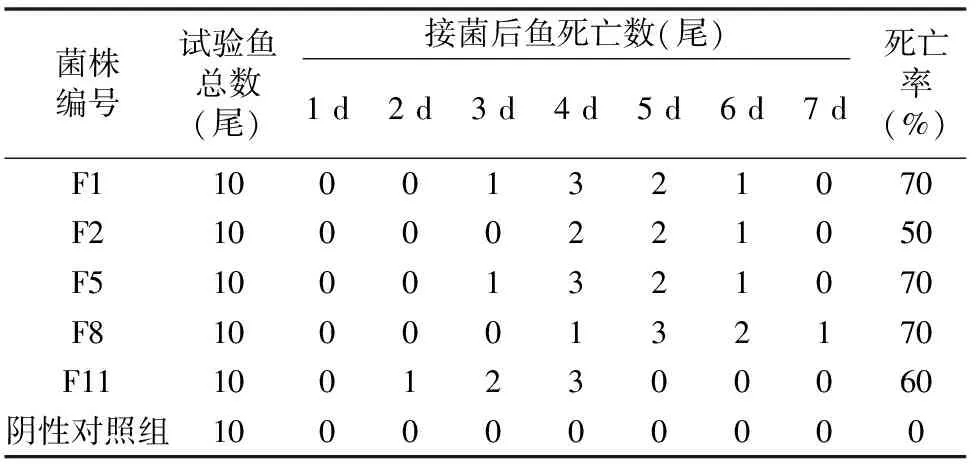
表4 分离菌株对健康鲫鱼的感染试验结果
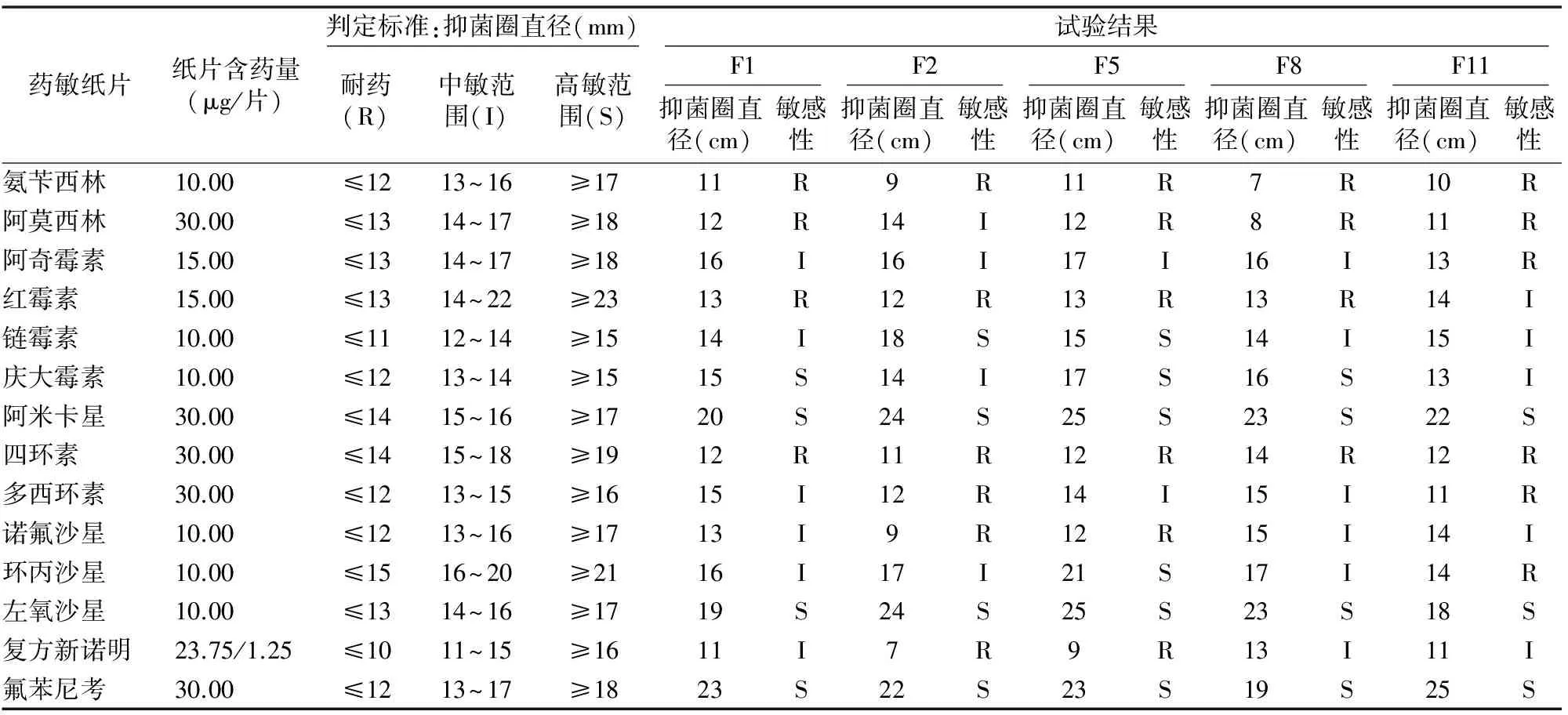
表5 嗜水气单胞菌对14种抗菌药物的敏感性试验结果
3 分析与讨论
嗜水气单胞菌有致病菌和非致病菌之分,致病菌可引起多种水生动物流行性传染病的暴发,其致病性与毒力因子有关,目前已知的毒力因子主要有以Aer毒素为主的外毒素、胞外蛋白酶、结构蛋白和信号相关蛋白。Aer毒素是嗜水气单胞菌引起变温动物溶血和出血的主要毒力因子,常在胞外蛋白酶的协同下发挥致病作用[9]。因此,Aer毒素和ECPase成为鉴别致病性嗜水气单胞菌的重要依据。本试验通过提取5个菌株Aer毒素和ECPase并进行SDS-PAGE电泳,均可得到相应蛋白条带。其中,45 ku是弱致病株Aer毒素的特征条带,35 ku蛋白是胞外蛋白酶被2-巯基乙醇裂解后的产物[10],为具有典型肠毒素性状的细菌外毒素。这进一步证实4个分离菌株及标准株均为致病性嗜水气单胞菌。
嗜水气单胞菌引发的鱼类出血病给水产养殖造成了巨大经济损失。目前,使用抗菌药物是防治鱼类出血病的常用手段。药敏试验表明,嗜水气单胞菌对阿米卡星、左氧氟沙星和氟苯尼考普遍敏感,在防治水生动物嗜水气单胞菌感染疾病时可优先选用;对链霉素和庆大霉素总体表现敏感,可作为备选药物。对阿奇霉素、多西环素、环丙沙星、诺氟沙星、复方新诺明部分菌株表现中度敏感,部分存在耐药性,生产中应合理控制、科学使用。试验中发现不同来源的嗜水气单胞菌对氨苄西林、阿莫西林、红霉素和四环素均产生耐药性,与以往报道[11-12]基本一致,生产中应避免使用上述药物。4个分离菌株及标准株对阿奇霉素、链霉素、庆大霉素、多西环素、环丙沙星、诺氟沙星、复方新诺明的敏感性结果存在差异,可能因养殖水域、养殖品种、用药方法和用药种类不同,导致嗜水气单胞菌产生耐药性的药物种类也不同。防治嗜水气单胞等引起的细菌性疾病时,应选用高度敏感的药物,有效控制疾病,减少经济损失。同时,严格按规定剂量用药,注意交替用药或轮换用药,避免连续使用同一药物或同类药物,从而避免细菌产生耐药性。此外,使用特异性卵黄抗体、中草药对嗜水气单胞菌感染也有一定防治效果[13-14]。
嗜水气单胞菌是一种条件致病菌,一旦感染引发疾病则较难控制,因此重在预防。养殖前期应做好鱼塘和鱼种的消毒工作,养殖过程中应注意控制养殖密度,保持良好的水质,保证科学合理的饵料营养供给,发现病鱼及时隔离和诊断。此外,使用高效的新型疫苗也是预防嗜水气单胞菌感染的重要手段。然而,因水生动物给药的特殊性及病原菌血清型的多样化[15],目前使用的菌苗不能获得理想效果。因此,以细菌毒力因子为基础开发可口服的亚单位疫苗是未来防治嗜水气单胞菌感染的重要方向。
[1]陆承平. 致病性嗜水气单胞菌及其所致鱼病综述[J]. 水产学报,1992,16(3):282-287.
[2]朱芝秀,何后军,邓舜洲,等. 嗜水气单胞菌江西地区分离株耐药性及耐药质粒分析[J]. 江西农业大学学报,2012,34(6):1262-1268.
[3]蔡丽娟,许宝青,林启存. 水产致病性嗜水气单胞菌耐药性比较与分析[J]. 水产科学,2011,30(1):42-45.
[4]李莲瑞. 嗜水气单胞菌Aer毒素的表达与抗原性分析[D]. 长春:中国人民解放军军需大学,2003:33.
[5]储卫华. 嗜水气单胞菌侵袭机制及其胞外蛋白酶的研究[D]. 南京:南京农业大学,2002:54.
[6]于生兰,王帅兵,朱善元,等. 嗜水气单胞菌卵黄抗体的制备[J]. 黑龙江畜牧兽医,2011,12(23):119-122.
[7]叶应妩,王毓三,申子瑜. 全国临床检验操作规程[M]. 南京:东南大学出版社,2006:890-923.
[8]王春林,曹 雪,刘晓丹,等. 嗜水气单胞菌不同分离株生化特性及胞外蛋白酶的检测[J]. 畜牧与兽医,2008,40(6):16-19.
[9]邱军强,杨先乐,程训佳. 嗜水气单胞菌毒力因子特性及作用机理研究进展[J]. 中国病原生物学杂志,2009,4(8):616-619.
[10]李焕荣,陈怀青,陆承平. 嗜水气单胞菌胞外蛋白酶ECPase54的纯化及特性分析[J]. 南京农业大学学报,1996,19(3):88-94.
[11]肖根辉,王 萍,刘明超,等. 中华鳖致病性嗜水气单胞菌分离鉴定与药敏试验[J]. 经济动物学报,2011,15(1):56-60.
[12]周 毅,张培培,徐 晔,等. 金鱼嗜水气单胞菌的分离鉴定及药敏试验[J]. 水产科学,2014,33(6):379-384.
[13]陈 强,周建武,饶平凡,等. 卵黄抗体在防治中华鳖气单胞菌病中的应用[J]. 福州大学学报(自然科学版),2001,29(5):115-118,126.
[14]陈学年,朱大世. 中草药防治鲫鱼败血症试验[J]. 淡水渔业,2001,31(1):43-45.
[15]钱 冬,陈月英,沈锦玉,等. 引起鱼类暴发性流行病的嗜水气单胞菌的血清型、毒力及溶血性[J]. 微生物学报,1995,35(6):460-464.
