过氧化氢对小球藻干质量和油脂含量的影响
2018-01-12王元琮
王元琮, 何 冰
(江苏省农业科学院种质资源与生物技术研究所,江苏南京 210014)
利用微藻生产生物能源越来越受到人们的重视。微藻是一种可以高效利用光能和二氧化碳合成油脂的单细胞或简单多细胞微生物,具有适应性强、生长快速、产油量高等特点。与植物类似,微藻可以通过光合作用将太阳能转化为化学能并以糖、蛋白和油脂的形式存储起来[1]。一般认为,当微藻处于逆境胁迫条件下,会限制自身的生长,同时提高自身的油含量,以更好地帮助自己适应环境[2]。
当植物处于逆境中时,体内会积累活性氧。微量的活性氧具有信号分子的作用,可以调节植物产生相应的反应,应对环境中的胁迫。但是当活性氧的积累量过多时,就会对植物产生伤害。过氧化氢(H2O2)是活性氧的一种,一般情况下在细胞中通过光呼吸形成。过氧化氢的过多积累会导致氧化性损伤,进而破坏细胞的新陈代谢和完整性,最终造成细胞死亡[3-4]。最近有研究表明,用微量H2O2处理海藻会促进其生长,高浓度的H2O2则会抑制微藻的生长[5-6]。也有研究认为,H2O2处理小球藻(Chlorellavulgaris)虽然可以显著抑制其生长,但同时也能够显著提高其油含量,当H2O2浓度达到 4 mmol/L 时,总油脂产量会有显著提高,更高浓度的H2O2则会完全杀死藻细胞[7-9]。一般认为,H2O2对微藻的毒性主要是因为H2O2在微藻细胞内可以转化为活性极高的羟基自由基(·OH),进而损伤细胞膜、蛋白质以及DNA[10-11],在高浓度H2O2胁迫下,微藻会主动抑制结构物质的合成,降低生长速率,转而把更多的能量以油脂的形式存储起来[12-13]。尽管关于活性氧对于微藻的生长、油脂积累的影响已经有不少研究,但是关于外源H2O2处理对微藻基因表达的影响至今仍然缺乏相关报道。为了进一步分析活性氧对微藻干质量和油脂积累影响的分子机制,笔者以前一段时间报道的小球藻藻种ChlorellasorokinianaLS-2(以下简称LS-2)作为研究材料[14],用不同浓度H2O2进行处理,并检测LS-2的生长量、产油量以及相关基因的表达变化,以期为解析小球藻响应外源H2O2的分子机制提供一定的线索。
1 材料与方法
1.1 试验藻种与试剂
本试验所用藻种为笔者所在实验室筛选出来的小球藻(Chlorellasorokiniana)LS-2[14],已提交至中国普通微生物菌种保藏管理中心,保藏号为CGMCC 8710。过氧化氢(H2O2,30%,分析纯)购自西陇化工股份有限公司。
1.2 培养方法和条件
培养方法和条件参考已有的报道[15],将藻种保存于液体Tris-Acetate-Phosphate(TAP)培养基内,接种时选用处于对数生长期的藻细胞,接入150 mL TAP培养基,保证接入后D680 nm=0.042。培养温度为26 ℃,每天光—暗周期为12 h—12 h,光照度为4 800 lx。
培养基接入对数期藻细胞后,随即加入适量H2O2至所需工作浓度。
1.3 藻细胞干质量的测定
取20 mL达到所需生长时间的藻细胞,放入50 mL离心管中离心收集藻细胞(5 000 r/min,5 min)。将收集下来的藻细胞放入烘箱,95 ℃烘20 min,然后调至75 ℃烘至恒质量,用分析天平称量藻细胞的质量,计算得出干质量。
1.4 油脂提取
将生长9 d的藻液倒入50 mL离心管中,5 000 r/min离心5 min后收集藻细胞。往离心管中加入5 mL浓盐酸(HCl,38%),置于75 ℃水浴20 min。取出离心管后加入5 mL无水乙醇,静置冷却至室温。加入10 mL无水乙醚,涡旋振荡 1 min,放入离心机内,于4 000 r/min离心1 min,分层后萃取上层并加入圆底烧瓶。重复3次直至萃取干净。将圆底烧瓶放入旋转蒸发仪,让有机溶剂挥发干净后称质量,计算总脂含量,相关公式如下:
总脂产量(mg/L)=提取油脂质量(mg)/提取样品体积(L);
油脂含量(mg/g)=提取油脂质量(mg)/提取样品干质量(g)。
1.5 RNA的提取和cDNA反转录
取处于对数生长期的不同处理的藻细胞,收集后用液氮研磨,加入TRIzol(Invitrogen),按照说明书提取。提取的RNA用RNAase-free DNAase I(TaKaRa)于37 ℃处理 20 min,消化剩余的DNA。按照反转录试剂盒(TaKaRa)说明将产物总RNA反转录为单链cDNA。
1.6 统计分析
本试验均重复3次,数据分析采用SPSS 19.0。多重比较采用的是最小显著差数法(least significant difference,简称LSD)。P<0.05被视为差异显著。2组样本比较采用t检验方法(Student’st-test),P<0.05视为差异显著。
2 结果与分析
2.1 过氧化氢浓度对小球藻(LS-2)干质量积累的影响
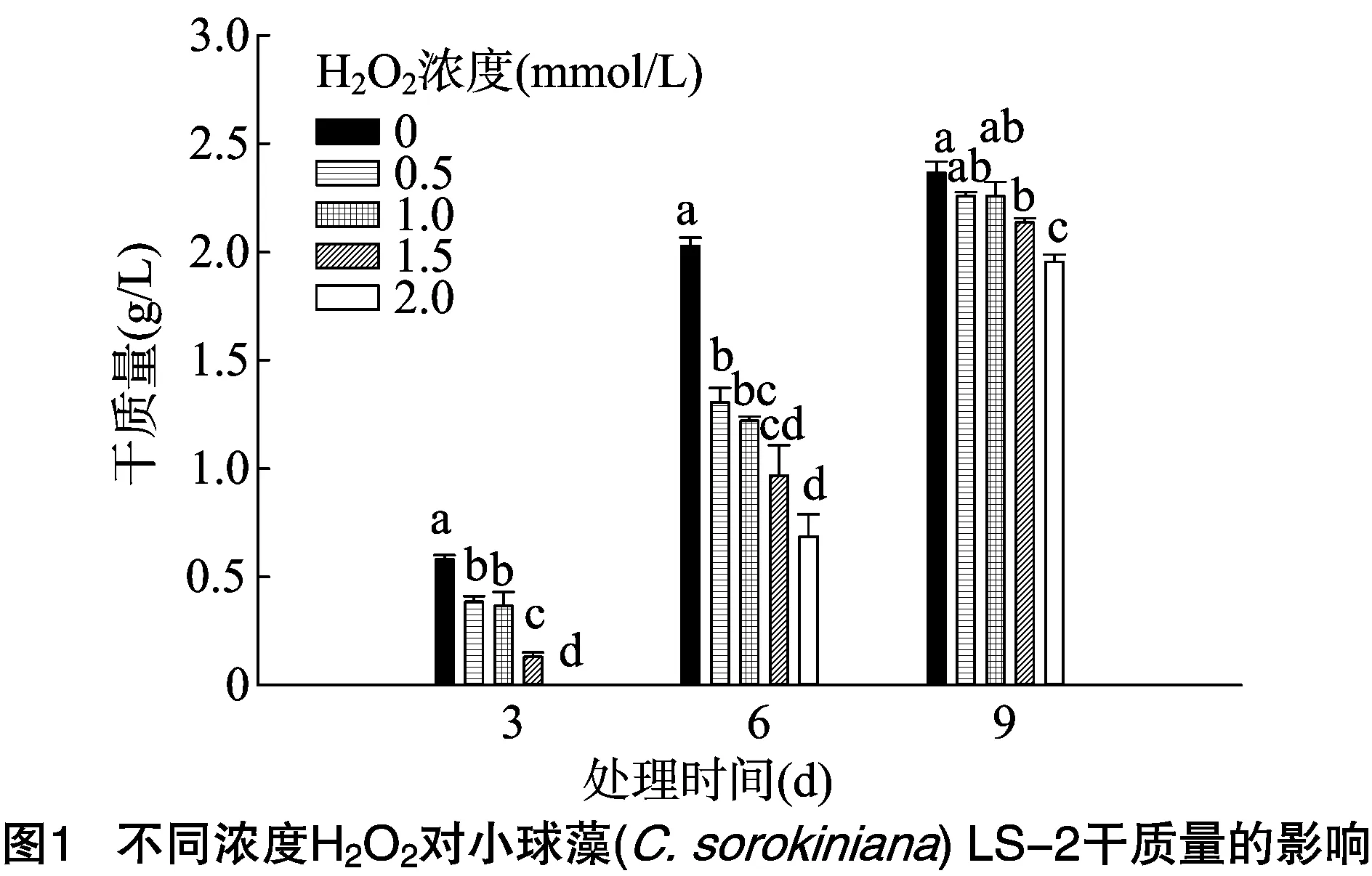
在TAP培养基中接入等量处于对数生长期的LS-2,并加入不同浓度的过氧化氢(0.5、1.0、1.5、2.0 mmol/L),分别在3、6、9 d测定其干质量。图1结果表明,随着处理浓度的升高,微藻的生长速率受到抑制的程度越大,不同浓度过氧化氢对于干质量积累的抑制在处理3 d和处理6 d时较为明显。接种LS-2后3 d,0.5 mmol/L H2O2处理的干质量为(0.385±0.025)g/L,比对照的(0.580±0.020)g/L下降了约33.6%。而用2.0 mmol/L H2O2处理的培养基中,LS-2几乎无法检测到生长。接种后6 d,对照干质量达到(2.028±0.376)g/L,不同浓度H2O2处理的干质量分别比对照下降了35.7%[0.5 mmol/L H2O2处理,(1.305±0.657)g/L]、66.2%[2.0 mmol/L H2O2处理,(0.686±0.103)g/L]。接种后9 d,对照干质量为(2.365±0.513)g/L,0.5、1.0 mmol/L H2O2处理在干质量上与对照均无显著差异,分别为(2.258±0.187)、(2.258±0.065)g/L。当用1.5 mmol/L H2O2处理时,干质量下降约9.6%,为(2.137±0.019)g/L;H2O2浓度增至 2.0 mmol/L 时,干质量下降约17.3%,为 (1.955±0.033)g/L。以上结果表明,外源H2O2处理小球藻会抑制其生长速率,当浓度达到1.5 mmol/L时,会明显降低LS-2的最大干质量。
2.2 过氧化氢处理对LS-2油脂积累的影响
为了探讨H2O2对LS-2油脂积累的影响,笔者在接种 9 d 后分别提取了不同处理的LS-2的总油脂并进行测定。结果表明,H2O2处理对LS-2油脂总产量的影响不显著(图2-A),但是2 mmol/L H2O2处理与对照处理相比,显著增加了LS-2的油脂含量,提升了28.6%(图2-B)。这与之前报道的H2O2在小球藻(Chlorellavulgaris)中产生的效果一致。
2.3 H2O2处理对LS-2碳固定相关基因表达的影响
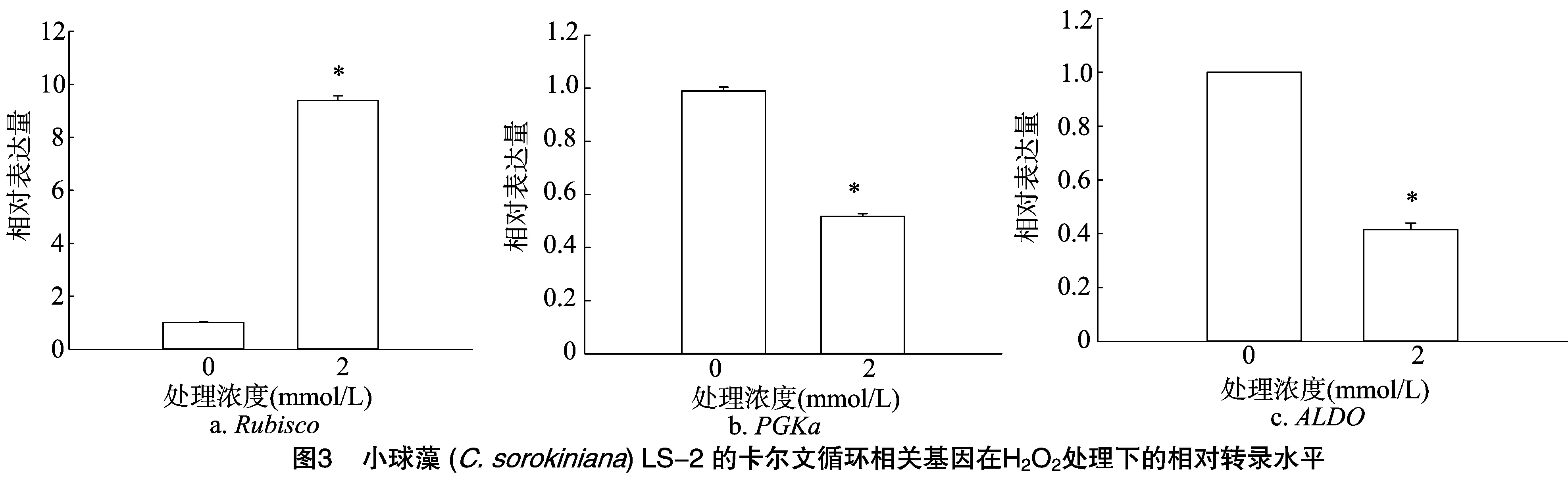
为了进一步研究H2O2处理对LS-2生长影响的机制,笔者分别提取了处于对数生长期的对照和2 mmol/L H2O2处理微藻细胞的RNA,并通过实时荧光定量PCR(qPCR)检测了相关基因的表达量,结果见图3。核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)是光合作用不可或缺的关键酶。其功能是催化第1个主要的碳固定反应。本研究结果表明,2.0 mmol/L H2O2处理的LS-2中,其转录水平有了显著提高,是对照转录水平的9倍(图3-A)。磷酸甘油酸变位酶a(phosphoglycerate mutase a,简称PGKa)和醛缩酶(fructose-1,6-bisphosphate aldolase,简称ALDO)在LS-2卡尔文循环中位于Rubisco的下游,编码它们的基因在2.0 mmol/L H2O2处理下转录水平仅为对照水平的1/2(图3-B、图3-C)。由此可见,在2.0 mmol/L H2O2处理下,虽然Rubisco转录有了提高,但卡尔文循环仍然受到了一定的抑制,这很可能是 2.0 mmol/L H2O2处理下微藻生长受到抑制的主要原因之一。
2.4 H2O2处理对LS-2油脂合成相关基因表达的影响
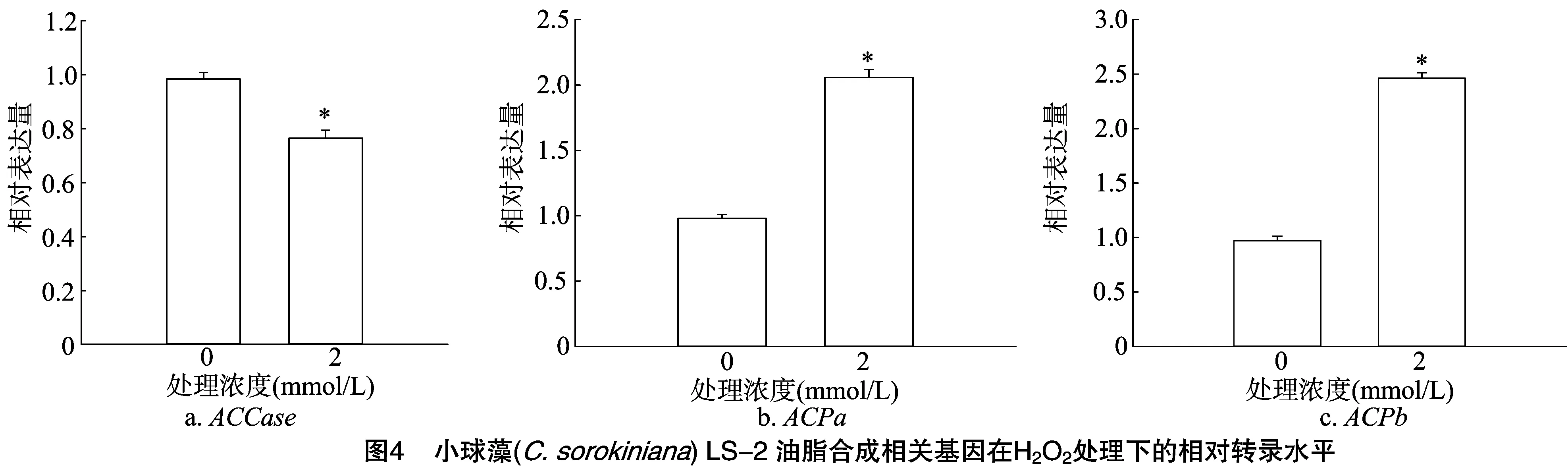
为了进一步解释H2O2处理增加LS-2油脂含量的机制,笔者检测了油脂合成途径前2步的关键基因,即编码乙酰辅酶A羧化酶(ACCase)及其下游的编码酰基载体蛋白(ACPa、ACPb)基因的转录水平。结果显示, 2.0 mmol/L H2O2处理LS-2藻细胞ACCase的转录水平与对照处理相比变化不大,略有下降(图4-A)。但是下游的ACPa、ACPb的转录水平都提升了1倍以上(图4-B、图4-C)。这有助于将ACCase催化的产物尽可能地转化为丙二酰-ACP,并进入随后的脂肪酸合成途径,为尽可能多地合成脂肪酸提供了条件。

2.5 H2O2处理对LS-2糖酵解相关基因表达的影响
糖酵解途径的中间产物可以作为油脂合成的底物。笔者进一步验证了H2O2处理对LS-2中编码糖酵解途径最后2步的关键酶,即烯醇化酶(enolase,简称ENL)、丙酮酸激酶(pyruvate kinase,简称PK)的基因转录水平的影响。结果显示,H2O2处理的藻细胞ENL的转录水平较对照上调了7倍(图5-A),但是其下游编码关键酶的PKa、PKb转录水平较对照变化不大,其中PKa略有下调,PKb略有上调(图5-B、图5-C),暗示这2种丙酮酸激酶可能受胁迫的影响略有不同。以上结果表明,LS-2藻细胞的糖酵解途径并没有受到外源H2O2的抑制。
3 讨论与结论
植物在受到外界环境胁迫时,体内会积累包括过氧化氢在内的多种活性氧。之前有报道表明,高浓度的H2O2会导致Rubisco折叠错误,并且更容易失去活性[16]。此外,活性氧也可以作为信号分子,调节植物应对外界刺激时的基因表达[17]。本研究发现,H2O2处理小球藻会使编码Rubisco蛋白的基因转录水平上调。笔者推测,这种转录水平的提高很可能是微藻为了应对这种状况而产生的补偿效应,因此尽管Rubisco的转录水平上调,其下游的卡尔文循环相关基因转录水平仍然受到了抑制。
之前有研究表明,微量的活性氧可以促进海洋微藻的生长,高浓度的活性氧则会对其生长产生抑制[5-6]。这种低浓度活性氧促进生长的效应在作物中也有发现[17]。本研究对小球藻LS-2和之前对小球藻(Chlorellavulgris)的研究都表明,H2O2处理会对其生长造成抑制,低浓度的H2O2仅在前期对小球藻的生长速率有一定抑制, 对最终的生物量和油含量影响不大。本研究发现,外施H2O2能够显著提高小球藻LS-2的Rubisco转录水平。因此,笔者推测之前报道的中低浓度活性氧之所以具备促进微藻生长的能力可能部分是由于其一方面提升了Rubisco的转录,另一方面由于浓度过低没有达到对Rubisco蛋白产生毒害的程度,这样使得Rubisco总量增加,从而增加了碳固定所造成的。

之前有研究推测,微藻在胁迫条件下油脂含量增加是可能是由于其碳固定途径受抑制的同时,糖酵解途径受到的影响不大,相应的糖酵解相对中间产物增多,这些产物为油脂合成提供了充足的底物[18-19]。本研究也表明,高浓度H2O2虽然能够抑制卡尔文循环相关基因的转录,但提高了油脂合成途径相关基因的转录,同时对于糖酵解途径关键基因的转录影响不大,这些基因表达的数据支持该推测,证明了小球藻在高浓度H2O2的胁迫下,能够抑制自身碳固定途径,加强油脂合成途径,从而更好地在外部逆境下生存。
[1]Brennan L,Owende P. Biofuels from microalgae-A review of technologies for production,processing,and extractions of biofuels and co-products[J]. Renewable and Sustainable Energy Reviews,2010,14(2):557-577.
[2]Lue J,Sheahan C,Fu P C. Metabolic engineering of algae for fourth generation biofuels production[J]. Energy & Environmental Science,2011,4(7):2451-2466.
[3]de Jong A J,Yakimova E T,Kapchina V M,et al. A critical role for ethylene in hydrogen peroxide release during programmed cell death in tomato suspension cells[J]. Planta,2002,214(4):537-545.
[4]方允中,李文杰. 自由基与酶:基础理论及其在生物学和医学中的应用[M]. 北京:科学出版社,1989:147-162.
[5]董正臻,董振芳,丁德文,等. 过氧化氢对两种海洋微藻的毒性效应研究[J]. 海洋科学进展,2004,22(3):320-327.
[6]谢 荣,唐学玺,李永祺,等. 活性氧对3种海洋微藻生长的影响[J]. 海洋学报,2001,23(1):94-101.
[7]Battah M,El-Ayoty Y,Abomohra A E,et al. Effect of Mn2+,Co2+and H2O2on biomass and lipids of the green microalgaChlorellavulgarisas a potential candidate for biodiesel production[J]. Annals of Microbiology,2015,65(1):155-162.
[8]Barrington D J,Ghadouani A. Application of hydrogen peroxide for the removal of toxic cyanobacteria and other phytoplankton from wastewater[J]. Environmental science and technology,2008,42(23):8916-8921.
[9]Drábková M,Admiraal W,Marsálek B. Combined exposure to Hydrogen peroxide and light-selective effects on cyanobacteria,green algae,and diatoms[J]. Environmental Science & Technology,2007,41(1):309-314.
[10]Abo-Shady A M,El-Sheekh M M,El-Naggar A H,et al. Effect of UV-B radiation on growth,photosynthetic activity and metabolic activities ofChlorococcumsp[J]. Annals of Microbiology,2008,58(1):21-27.
[11]Halliwell B,Gutteridge J M. Oxygen toxicity,oxygen radicals,transition metals and disease[J]. Biochemical Journal,1984,219(1):1-14.
[12]Hu Q,Sommerfeld M,Jarvis E,et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J]. The Plant Journal:for Cell and Molecular Biology,2008,54(4):621-639.
[13]Li Y,Chen Y F,Chen P,et al. Characterization of a microalgaChlorellasp. well adapted to highly concentrated municipal wastewater for nutrient removal and biodiesel production[J]. Bioresource technology,2011,102(8):5138-5144.
[14]Sun Z L,Chen Y F,Du J C. Elevated CO2improves lipid accumulation by increasing carbon metabolism inChlorellasorokiniana[J]. Plant Biotechnology Journal,2016,14(2):557-566.
[15]Parsaeimehr A,Sun Z,Dou X,et al. Simultaneous improvement in production of microalgal biodiesel and high-value alpha-linolenic acid by a single regulator acetylcholine[J]. Biotechnology for Biofuels,2015,8(1):11.
[16]Sen L,Wei L,Li G F,et al. Interaction of hydrogen peroxide with ribulose-1,5-bisphosphate carboxylase/oxygenase from rice[J]. Biochemistry-Moscow,2004,69(10):1136-1142.
[17]Jiang Y P,Cheng F,Zhou Y H,et al. Hydrogen peroxide functions as a secondary messenger for brassinosteroids-induced CO2assimilation and carbohydrate metabolism inCucumissativus[J]. Journal of Zhejiang University-Science B,2012,13(10):811-823.
[18]Stefels J. Physiological aspects of the production and conversion of DMSP in marine algae and higher plants[J]. Journal of Sea Research,2000,43(3/4):183-197.
[19]Wang Y C,He B,Sun Z L,et al. Chemically enhanced lipid production from microalgae under low sub-optimal temperature[J]. Algal Research,2016,16:20-27.
