徐香猕猴桃RNA提取条件及内参基因的优化
2018-01-12赵素平胡博然胡花丽周宏胜刘红艳李鹏霞
赵素平, 胡博然, 胡花丽, 周宏胜, 刘红艳, 李鹏霞
(1.扬州大学旅游烹饪学院,江苏扬州 225127; 2.江苏省农业科学院农产品加工研究所,江苏南京 210014;3.江苏省农业科学院园艺产品采后处理工程实验室,江苏南京 210014)
高质量的RNA样品是分子生物学研究的基础,在总RNA提取时,能否有效地去除果实中的多糖、多酚等物质,并抑制RNA酶活性,是核酸提取效率及核酸质量的重要影响因素[1]。猕猴桃果实含有较多的多糖、酚类物质,由于多糖、酚类物质的干扰,使得猕猴桃RNA提取较其他植物RNA提取的难度大[2]。目前国内外有关提取猕猴桃果实总RNA的方法主要有改进的Lopez-Gomez与Gomez-lim方法[3]、异硫氢酸胍法[4]、HAc-NaAc法[5]、RNA提取试剂盒法等,但是异硫氢酸胍法、试剂盒法比较昂贵,HAc-NaAc法提取需要分离DNA、RNA。本研究在十六烷基三甲基溴化铵(CTAB)法的基础上进行优化,拟建立1种适于提取猕猴桃果实总RNA的经济简便的方法。另外,内参基因的表达量可以对目标基因的表达量进行归一化和标准化,以减小样本之间的差异,内参基因在实时荧光定量PCR(qRT-PCR)中起重要作用[6]。相同猕猴桃果实的不同品种、不同部位和不同发育阶段等均会对同一基因的表达产生影响,因此,根据果实品种及试验处理,优化和选择用于qRT-PCR的内参基因至关重要。本研究以植物常用的内参基因(ACTB、TUB、18SrRNA、GAPDH和Actin)为基础[7],拟选择最适合徐香猕猴桃果实基因表达水平研究的内参基因。
1 材料与方法
1.1 材料
徐香猕猴桃,购自南京众彩物流批发市场,挑选大小相近、无病虫害、无机械损伤、成熟度基本一致的果实进行处理。在处理后的3、6、9 d进行样品采集,将果肉组织用液氮冷冻,并在 -70 ℃ 下储存。
1.2 方法
1.2.1 提取液配制 CTAB抽提液成分:2.5%(质量分数)CTAB,2%(质量分数)聚乙烯吡咯烷酮(PVP),100 mmol/L Tris-HCl[pH值8.0,用焦碳酸二乙酯(DEPC)处理的水配制],25 mmol/L乙二胺四乙酸(EDTA),2.0 mol/L NaCl,0.5 g/L 亚精胺,充分混匀后于121 ℃灭菌30 min。使用前加入100 g/L的β-巯基乙醇、三氯甲烷+异戊醇(体积比 24 ∶1)、8 mol/L LiCl、70%乙醇。以上试剂均用0.1%DEPC处理的灭菌双蒸水配制。
1.2.2 提取方法
1.2.2.1 试剂盒法提取猕猴桃总RNA 严格按照试剂盒的要求提取总RNA。
1.2.2.2 优化CTAB法提取猕猴桃总RNA 在传统CTAB方法[8]的基础上,进行提取条件的优化。提取步骤:(1)在经过DEPC水处理的无RNA的2 mL离心管中加入1 mL CTAB抽提液,再加入100 μLβ-巯基乙醇,混匀备用。(2)取猕猴桃冻样置于预冷的研钵中(研钵用乙醇燃烧灭菌后加液氮预冷),加入液氮,迅速研磨成均匀的粉末,研磨得越细越好;称取0.4 g磨碎的样品放入有CTAB抽提液的离心管中,立即混匀,65 ℃水浴30 min(每隔5 min混匀1次)。(3)取出离心管,冷却至室温,10 000 r/min、10 ℃离心10 min,取上清放入新的无RNA的离心管中。(4)加入等体积三氯甲烷、异戊醇(体积比为24 ∶1),于室温条件下剧烈摇动5 min,12 000 r/min、4 ℃离心10 min,取上清液加入无RNA的新离心管内,重复此步骤3次至蛋白层不再出现。(5)吸取上清液至无RNA的新离心管中,加入1/2体积8 mol/L LiCl(使其终浓度为4 mol/L LiCl),于-20 ℃放置过夜(即沉淀时间大于8 h)。(6)将于-20 ℃放置8 h以上的离心管取出,13 000 r/min、4 ℃离心30 min。(7)去除上清,用600 μL 75%乙醇洗涤沉淀,于 13 000 r/min、4 ℃离心5 min,重复此步骤3次,最后一次倒掉乙醇后再空管离心1次,吸出残留的乙醇,之后在超净工作台上放置5 min,使残留乙醇挥发,以免影响下游试验。(8)加20 μL DEPC处理的灭菌双蒸水溶解沉淀,充分混匀,长期保存于-70 ℃。
1.3 总RNA的质量检测
(1)取2 μL总RNA,用核酸定量分析仪测定并计算D260 nm/D280 nm值、D260 nm/D230 nm值及核酸的浓度,分析其质量与浓度。(2)检测RNA的琼脂糖凝胶电泳在1×TAE缓冲液中进行,在3 μL RNA加样缓冲液(6×loading buffer)中加入 2 μL 总RNA,混合均匀后点样于1%琼脂糖凝胶上进行电泳,利用凝胶成像系统观察RNA的完整性。
1.4 cDNA合成
cDNA的合成严格按照First Strand cDNA Synthesis Kit(由Thermo Scientific Revert Aid提供)操作。总RNA的纯化:反应体系含有2 μg/μL RNA,1 μL 10×反应缓冲液(含MgCl2),1 μL(1 U)DNase Ⅰ(RNase-free),加入无核酸酶的双蒸水使总体积至10 μL。反应条件:37 ℃温育30 min后立即冰浴,之后加入1 μL 50 mmol/L EDTA再于65 ℃温育 10 min,冰浴5 min后即可进行cDNA合成。
cDNA合成:在上述体系中加入random primer 1 μL,反应总体积调至12 μL。65 ℃加热5 min后立即置于冰上降温,之后加入4 μL 5×反应缓冲液,1 μL RiboLock RNase Inhibitor(20 U/μL),2 μL 10 mmol/L dNTP Mix,1 μL RevertAid M-MuLV RT(200 U/μL),总反应体系为20 μL。之后于25 ℃孵育5 min,42 ℃孵育60 min,70 ℃孵育5 min。将合成产物于-70 ℃保存备用。
1.5 猕猴桃内参基因的筛选
内参基因参照张慧琴等的研究[9-10],详见表1。引物由苏州金唯智生物科技有限公司合成,对5个基因序列进行常规PCR扩增,反应体系:10 μL 2×PCR-Mix,各0.8 μL上、下游引物,0.5 μL cDNA,7.9 μL灭菌双蒸水,总反应体系 20 μL。反应步骤:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,此步骤35个循环;72 ℃ 10 min。通过半定量PCR和qRT-PCR检测内参基因ACTB、TUB、Actin、GAPDH、18S rRNA,挑选适合徐香猕猴桃成熟果实检测的内参基因。
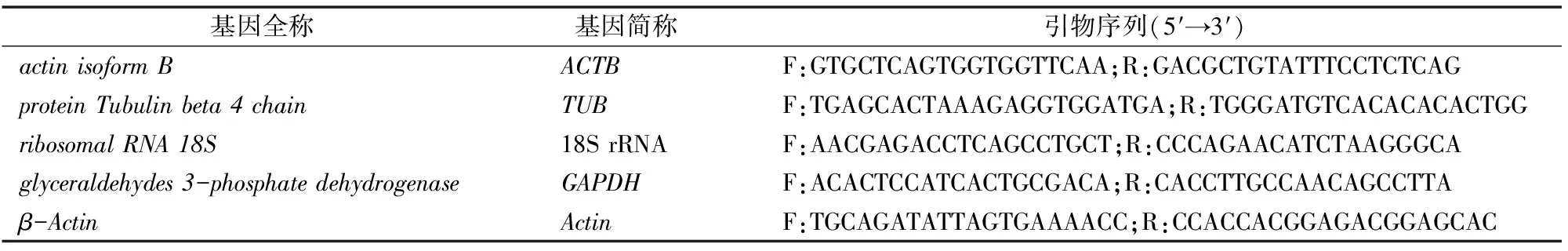
表1 内参基因引物序列
2 结果与分析
2.1 猕猴桃总RNA提取结果
2.1.1 用试剂盒提取猕猴桃贮藏0 d样品RNA结果 在波长280、230、260 nm下的吸光度依次代表核酸、盐、蛋白等有机物的含量。高纯度RNA的D260 nm/D280 nm值应介于1.8~2.0之间,D260 nm/D230 nm值大于2.0[11]。从表2可以看出,使用试剂盒提取猕猴桃RNA的D260 nm/D280 nm值、D260 nm/D230 nm值整体上分别低于1.8、2.0,这说明RNA中蛋白、多糖等杂质污染严重。第3次提取猕猴桃总RNA质量有所提高,但是RNA含量低,不利于进行下游试验。从图1可以看出,试剂盒提取猕猴桃总RNA条带不清晰且弥散,说明RNA有所降解。由图2可以看出,猕猴桃总RNA条带清晰但亮度不高,说明RNA含量及纯度均较低。因此可知,试剂盒不适合用来提取徐香猕猴桃总RNA。

表2 试剂盒提取猕猴桃RNA的相应结果
2.1.2 CTAB法提取猕猴桃总RNA结果
2.1.2.1 传统CTAB法第1次提取猕猴桃总RNA结果 以贮藏0 d猕猴桃样品为基础设置不同起始质量,进行总RNA的提取。从表3可看出,随着猕猴桃样质量的增加,提取的猕猴桃总RNA含量会相应提高,但D260 nm/D280 nm值、D260 nm/D230 nm值也随之下降,说明提取的总RNA含有多糖、多酚等物质,总RNA质量不高,不适合用于下游分子生物学试验。



表3 CTAB法提取猕猴桃贮藏0 d样品RNA的结果
2.1.2.2 第1次优化条件提取猕猴桃总RNA结果 优化条件:猕猴桃样质量选择0.5 g,CTAB含量由2.0%提高至2.5%,β-巯基乙醇含量由2%提高到10%,三氯甲烷-异戊醇抽提次数增加至3次。利用优化后的CTAB法提取猕猴桃果实总RNA,用核酸定量分析仪进行检测。由表4可知,猕猴桃总RNA的D260 nm/D280 nm值基本在1.8~1.9,而D260 nm/D230 nm值介于1.8~2.0,说明总RNA纯度提高了,但是仍存在少量多糖、多酚和蛋白质等物质。由图3的1%琼脂糖凝胶电泳结果看出,总RNA电泳结果呈现2条带,且28S的亮度比18S的亮度大,但是18S条带出现了降解,需要进一步优化提取条件。

表4 第1次优化CTAB法提取猕猴桃总RNA结果

2.1.2.3 第2次优化条件提取猕猴桃总RNA结果 优化条件:样品质量由0.5 g减少至0.3 g,70%乙醇洗涤次数增加至3次。从表5可以看出,减少猕猴桃提取时的样品质量,增加乙醇洗涤次数,可以提高总RNA的纯度及质量,但D260 nm/D230 nm值仍小于2.0。由图4可知,猕猴桃总RNA条带整齐、清晰,但RNA条带亮度不高,说明RNA样品含量较低,因此需要进一步优化方法,从而提高猕猴桃总RNA的浓度及纯度。
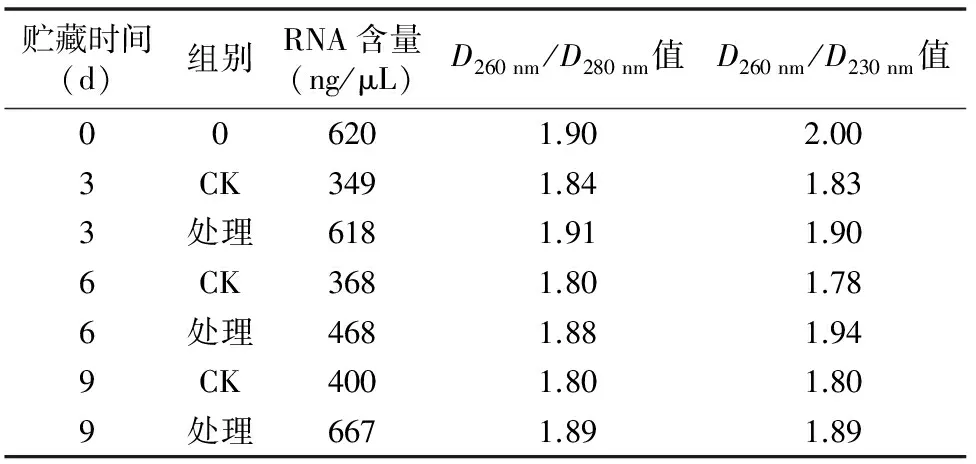
表5 优化CTAB法提取猕猴桃总RNA结果
2.1.2.4 第3次优化条件提取猕猴桃总RNA结果 优化条件:样品质量0.4 g,LiCl由1/3体积增加至1/2体积,同时LiCl沉淀时间为过夜。通过提高样品质量至0.4 g,以及LiCl

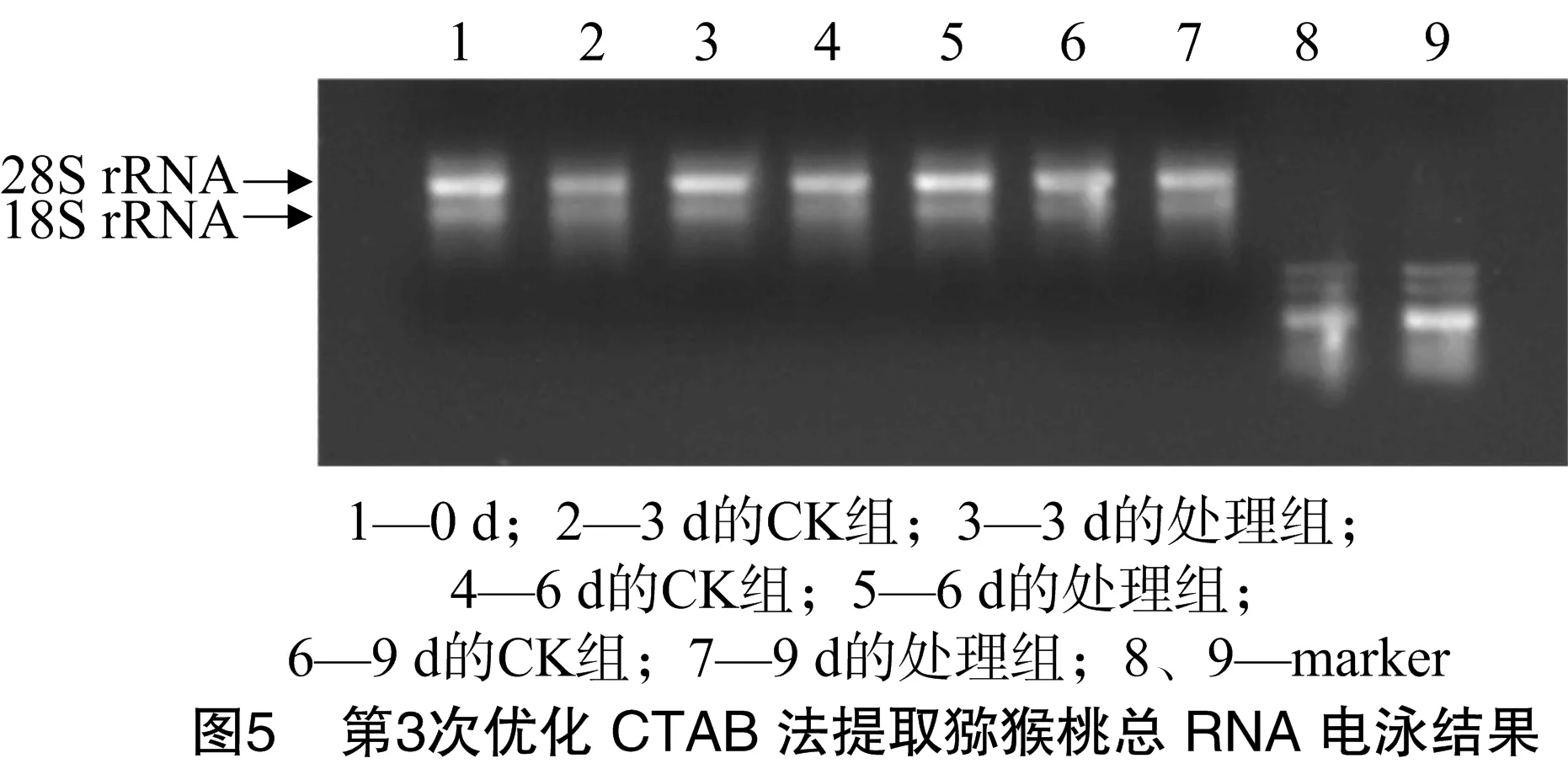
沉淀过夜提取总RNA,由表6可知,D260 nm/D280 nm值介于 1.8~2.0之间,D260 nm/D230 nm值基本为2.0左右,表明提取的猕猴桃总RNA质量较高。从图5可以看出,RNA条带整齐、清晰完整,28S条带亮度约是18S条带亮度的2倍,表明总RNA的纯度、完整性和产率均较高,蛋白质、多糖及多酚等去除得较彻底,可作为反转录的模板。
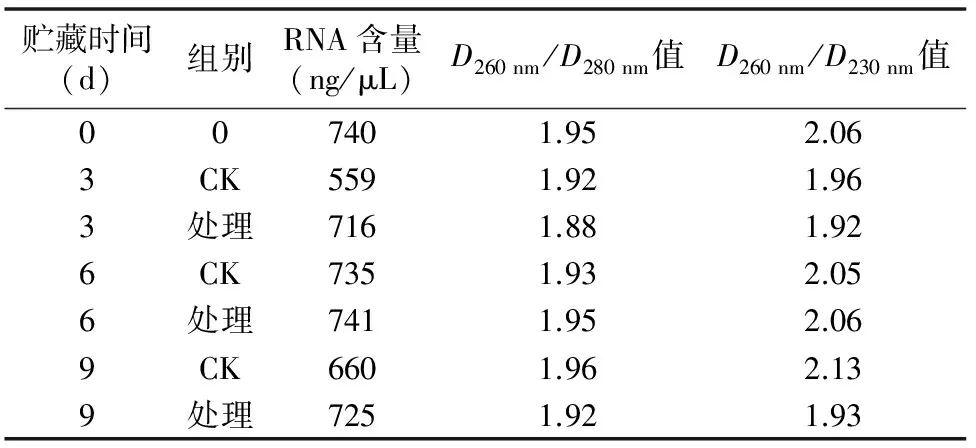
表6 优化CTAB法提取猕猴桃总RNA结果
2.2 猕猴桃果实内参基因的筛选
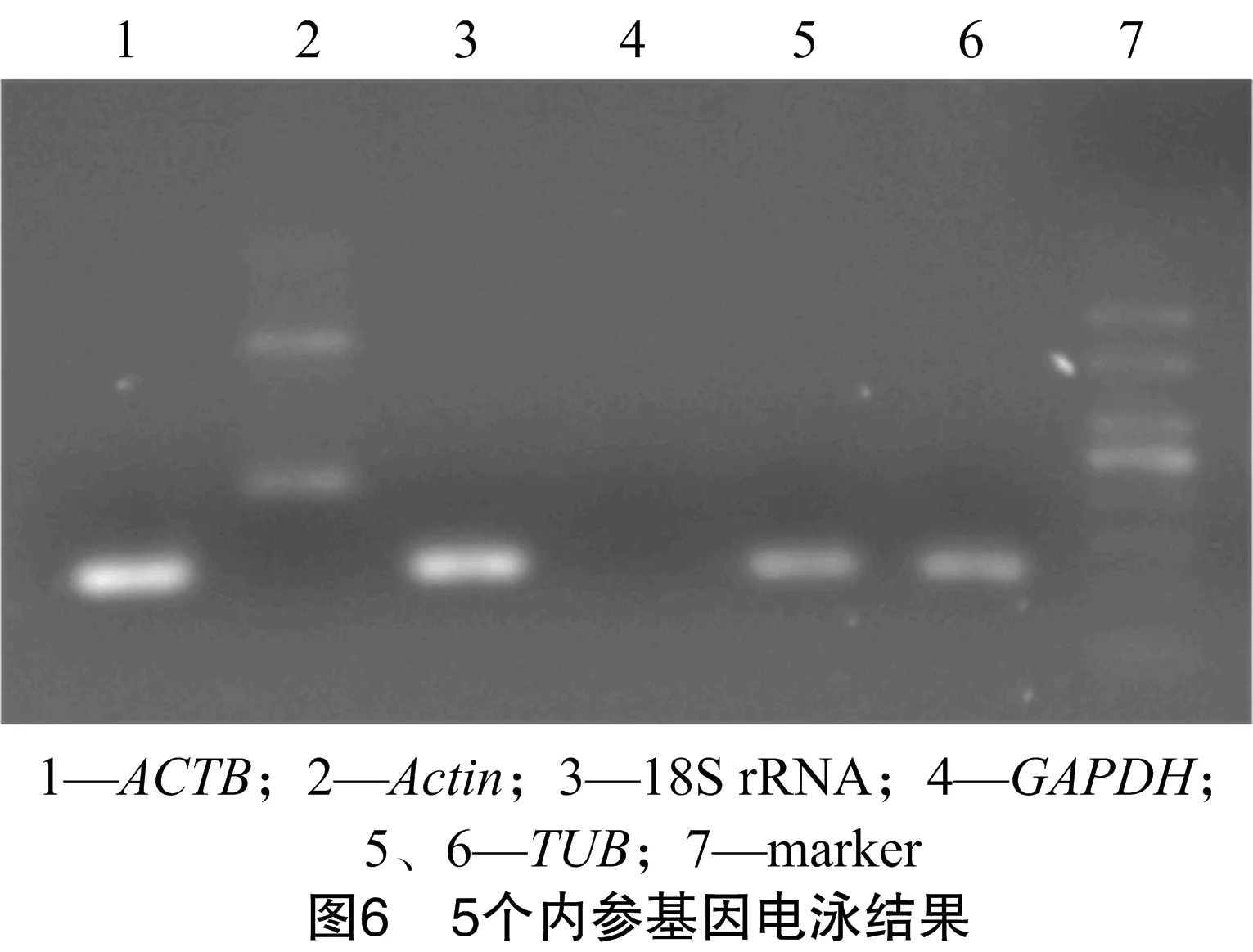
2.2.1 半定量PCR筛选猕猴桃果实内参基因 PCR产物用溴化乙锭染色的1.5%琼脂糖凝胶电泳检测,并用GelDoc XR(Bio-Rad,美国)照相记录。对ACTB、TUB、Actin、GAPDH、18S rRNA 5个内参基因进行初步筛选。从图6看出,将猕猴桃贮藏0 d的cDNA分别加入5对内参引物进行PCR扩增,电泳结果为ACTB和18S rRNA亮度最高,Actin有二聚体,GAPDH没有表达,TUB亮度相对较低,因此内参初步筛选结果为ACTB、18S rRNA。
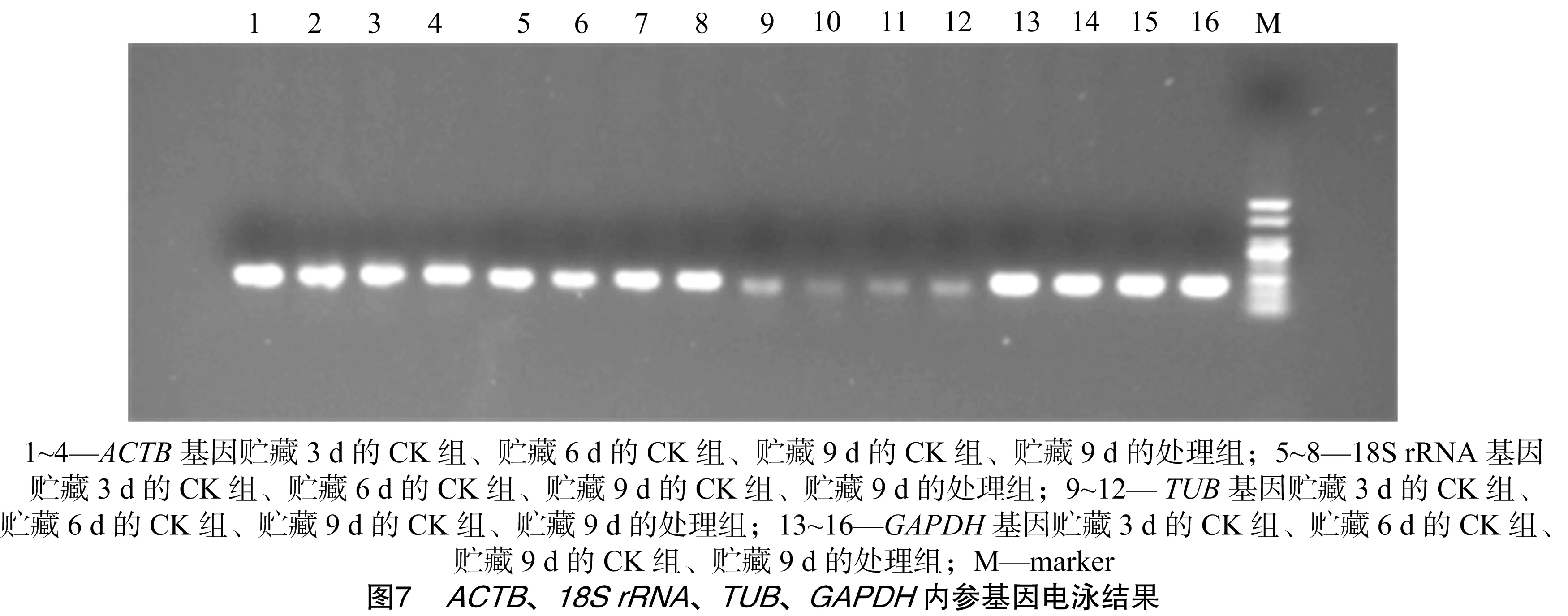
由图7可知,将猕猴桃不同时间和不同处理的cDNA通过分别加入ACTB、18S rRNA、TUB和GAPDH这4对内参引物进行PCR扩增,电泳结果为ACTB、18S rRNA亮度最高且表达较稳定,TUB亮度相对较低,而GAPDH亮度高但表达稳定性不高。
从图8可以看出,将贮藏0、3 d的CK组、贮藏3 d的处理组、贮藏6 d的CK组、贮藏6 d的处理组、贮藏9 d的CK组、贮藏9 d的处理组的cDNA通过分别加入Actin内参引物进行PCR扩增,电泳结果显示Actin引物均有二聚体,不适合作为徐香猕猴桃的内参基因。

2.2.2 实时荧光定量PCR检测ACTB、TUB和18S rRNA 由表7可知,TUB的CT值基本在32以上,说明TUB基因基本不表达,18S rRNA的CT值介于8.0~11.0之间,值相对偏低,不适宜作为徐香猕猴桃果肉的内参基因,而ACTB的CT值介于19.0~24.0之间,表达稳定性相对较高,因此选择ACTB作为荧光定量PCR的内参基因。
3 讨论
3.1 优化CTAB法提取徐香猕猴桃总RNA
优化后的CTAB法所用试剂均是常规试剂,可有效降低试验成本[12-13]。本研究中优化CTAB法的关键:(1)提取猕猴桃总RNA时样起始量不能太大,否则提取液不能完全消化猕猴桃内的物质,优化后选取的样品质量为0.4 g。(2)CTAB含量由2.0%提高到2.5%,CTAB是蛋白质的变性剂,提高CTAB含量可以有效去除果实中的蛋白质。(3)提取液中β-巯基乙醇含量由2%提高到10%,可以变性蛋白,有效抑制RNA酶的活性[14],同时,β-巯基乙醇作为有效还原剂,能有效抑制酚类物质及内源酚的氧化,防止褐化效应发生,提高RNA提取质量。(4)三氯甲烷-异戊醇抽提次数增加至3次,三氯甲烷和异戊醇混合液使蛋白质变性、分层,且可以去除脂类,还可使有机相和无机相迅速分离,从而有效回收RNA。(5)LiCl由1/3体积增加至1/2体积,高浓度LiCl在选择性沉淀RNA的同时,可使多糖留在溶液中而不随RNA沉淀下来[15]。LiCl沉淀需要在4 ℃放置过夜,时间长,但是RNA的产率高,且RNA纯度高,从而降低了RNA降解的概率。LiCl本身沉淀大片段RNA效果好的特点使得到的RNA大片段损失很少,更适于进行后续的分子生物学试验[16]。(6)70%乙醇洗涤增加至3次。多次乙醇洗涤可有效去除多糖,同时高浓度的NaCl也有助于去除多糖[17]。(7)加入 0.5 g/L 亚精胺可以有效抑制RNA酶活性。基于以上优化后的CTAB法提取的猕猴桃总RNA,完全可以满足 RT-PCR、Northern Blotting等分子生物学试验的要求。
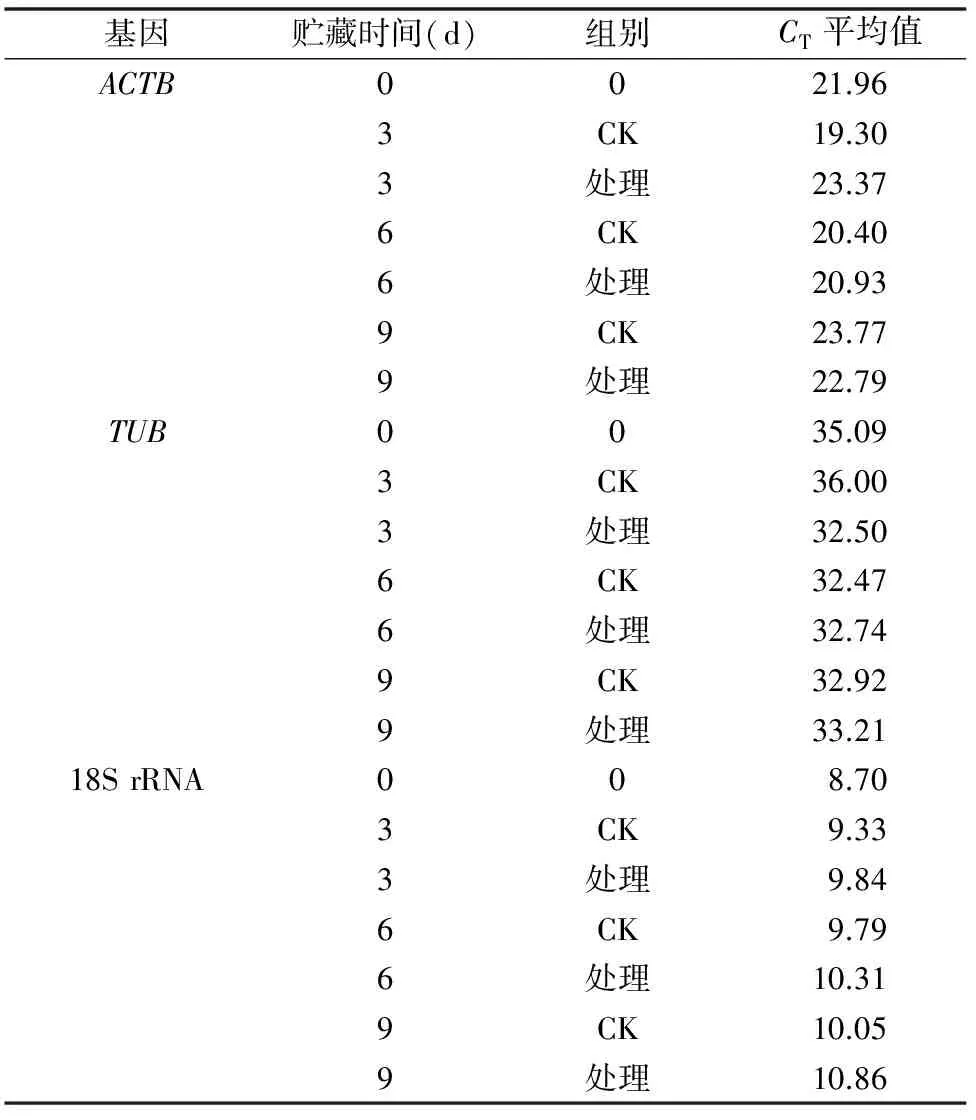
表7 ACTB、TUB和18S rRNA qRT-PCR结果
注:CT表示从基线到指数增长拐点所对应的循环数。
3.2 徐香猕猴桃内参基因的优化
选择一种或多种参考基因作为内参基因用来分析qRT-PCR基因的表达,同时参考基因需要不受试验条件的影响[18]。qRT-PCR分析最常用的参考基因包括Actin、18S RNA、GADPH、TUB等[19]。有研究表明,相同植物的不同品种、不同组织器官以及相同组织器官在不同发育阶段,同一基因的表达均会出现差异[20-21]。因此,根据猕猴桃的品种及不同的处理方式,选用合适的内参基因对其他基因的表达水平进行归一化,才能对试验结果进行正确判断与比对。随着分子生物学研究的广泛开展和不断深入,基因表达分析已经广泛应用于猕猴桃基因代谢调控机制的研究中,因此筛选稳定的内参基因在基因表达分析中起着关键作用[22]。
张慧琴等发现,TUB和ACTB在华特猕猴桃6种不同组织中表达均稳定,适合作为华特猕猴桃不同组织基因表达的内参基因[9]。本试验通过半定量PCR检测ACTB、TUB、Actin、GAPDH、18S rRNA这5个内参基因可知,ACTB在徐香猕猴桃果实中表达最稳定。由本研究结果可知,通过荧光定量PCR进一步确定ACTB适合作为徐香猕猴桃果实的内参基因。因此,通过半定量PCR、qRT-PCR最终选择ACTB作为徐香猕猴桃果肉的内参基因,用于实时荧光定量PCR分析。这些研究结果可为下一步揭示徐香猕猴桃衰老机制研究提供有力的试验方法。
[1]王 杰,王 全,田 娜,等. 不同植物组织RNA提取方法的比较分析[J]. 北京农学院学报,2015,30(1):76-80.
[2]汤三妹,杨 娟,周秋莲,等. 猕猴桃RNA提取与RT-PCR[J]. 生物技术通报,2005(5):67-71.
[3]陈昆松,徐昌杰,张上隆,等. 富含多糖猕猴桃果实组织中总RNA提取方法的改进[J]. 植物生理学报,1998(5):371-373.
[4]梅晓宏,高红岩,罗云波. 提取猕猴桃果实总RNA的新方法[J]. 中国食品学报,2007,7(3):55-57.
[5]刘胜洪,刘 文,刘明峰,等. 一种高效提取猕猴桃DNA和RNA的方法[J]. 生物技术通报,2011(9):171-175.
[6]Nolan T,Hands R E,Bustin S A. Quantification of mRNA using real-time RT-PCR[J]. Nature Protocols,2006,1(3):1559-1582.
[7]Ferradas Y,Rey L,Martinez O,et al. Identification and validation of reference genes for accurate normalization of real-time quantitative PCR data in kiwifruit[J]. Plant Physiology and Biochemistry,2016,102:27-36.
[8]刘 军. 猕猴桃GalUR基因克隆及功能分析[D]. 杨凌:西北农林科技大学,2010.
[9]张慧琴,谢 鸣,肖金平,等. 猕猴桃实时荧光定量PCR分析中内参基因的筛选[J]. 浙江农业学报,2015,27(4):567-573.
[10]张 波. 猕猴桃脂氧合酶基因家族的功能解析及其调控[D]. 杭州:浙江大学,2007.
[11]尹 慧,陈 莉,李晓艳,等. 百合叶片总RNA提取方法比较及优化[J]. 中国农业大学学报,2008,13(4):41-45.
[12]张 涛,韩 梅,刘翠晶,等. 人参总RNA提取方法及反转录酶的比较[J]. 江苏农业科学,2015,43(8):34-37.
[13]刘 波,张晓明,郭巧生,等. 百蕊草根系总RNA提取方法比较及优化[J]. 江苏农业科学,2015,43(1):44-46.
[14]王静毅,郑丽珊,冀小蕊,等. 番木瓜果皮和种子总RNA提取方法的研究[J]. 热带农业科学,2006,26(6):18-20.
[15]郝福玲,刘雅莉,王跃进. 百合花瓣总RNA提取方法的研究[J]. 西北植物学报,2005,25(6):1143-1147.
[16]宋 蓓,赵 锦,刘孟军,等. 改良CTAB-LiCl法提取枣总RNA体系的建立[J]. 中国农学通报,2007,23(7):79-83.
[17]邵 毅,罗云波,张京声,等. 李果实高质量RNA提取方法的比较和优化[J]. 北京林业大学学报,2010,32(1):57-62.
[18]Vandesompele J,de Preter K,Pattyn F,et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology,2002,3(7):research0034.1- research0034.11.
[19]Thellin O,Elmoualij B,Heinen E,et al. A decade of improvements in quantification of gene expression and internal standard selection[J]. Biotechnology Advances,2009,27(4):323-333.
[20]Andersen C L,Jensen J L,Orntoft T F. Normalization of real-time quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J]. Cancer Research,2004,64(15):5245-5250.
[21]Jian B,Liu B,Bi Y R,et al. Validation of internal control for gene expression study in soybean by quantitative real-time PCR[J]. BMC Molecular Biology,2008,9:59.
[22]Gu C S,Chen S M,Liu Z L,et al. Reference gene selection for quantitative Real-Time PCR in chrysanthemum subjected to biotic and abiotic stress[J]. Molecular Biotechnology,2011,49(2):192-197.
