我国黑木耳国认品种种质基础及黑木耳育种技术现状
2018-01-12孙国琴王海燕康立茹谢亚杰
庞 杰, 孙国琴, 王海燕, 于 静, 康立茹, 谢亚杰
(1.内蒙古自治区农牧业科学院,内蒙古呼和浩特 010030; 2.食用菌内蒙古自治区工程研究中心,内蒙古呼和浩特 010030)
黑木耳[Auriculariaauricular(L. ex Hook.) Underw]是我国重要的食用菌生产种类,隶属于担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、木耳目(Auriculariales)、木耳科(Auriculariaceae)、木耳属(Auricularia)的可食用大型真菌,木耳属全世界约50种,我国约10种[1]。
黑木耳在我国种植历史悠久,早在北魏时期的《齐民要术》就记载了木耳生产。黑木耳生产规模巨大,据中国食用菌协会统计,2014年我国黑木耳产量为579万t,较上一年的556.39万t同比增长4%,生产规模已经超越平菇,成为继香菇之后的第二大食用菌生产种类。
黑木耳生产同其他的农业生产相同,优质的品种是黑木耳高产高效的基础保障。所谓作物新品种选育就是人为的作物种质重组,作物种质重组的基础是需要不同来源和遗传背景的种质资源[2]。本研究收集了23个国认黑木耳品种的详细信息,对我国国认黑木耳的遗传基础进行分析,旨在了解我国国认黑木耳品种现状,此外,分析了我国黑木耳育种的基本技术手段和现状,为进一步开展黑木耳育种研究提出方向。
1 国认黑木耳品种的遗传基础
根据全国农业技术推广服务中心公布的黑木耳品种名单[农技种便函(2015) 60号],收集黑木耳国认品种的相关信息(表1)。23个国认黑木耳品种中,分离驯化的品种有18个,占到总品种的78.3%,杂交选育的品种有5个,仅占总品种数的21.7%。23个国认品种中, 总体可以分为两大群体,分别是东北群体和华中南群体。东北群体来源我国东北地区,包括的地区有黑龙江、吉林、辽宁和内蒙古东部,品种有15个;华中南群体来源于浙江、湖南、湖北大巴山等地区,包括的品种有6个;品种H10由东北群体和华南群体杂交而成,浙耳1号品种未标注来源地区。国认品种中,有明确亲缘关系的是黑耳5号(Au86)和黑耳4号(931),黑耳4号以黑耳5号和黑龙江呼玛野生黑木耳品种为亲本,通过双核菌丝脱壁再生育成。可以看出,目前我国国认黑木耳品种以分离驯化为主,育种技术落后,品种的遗传基础较为单一。我国国认黑木耳品种没有明确的骨干品种。
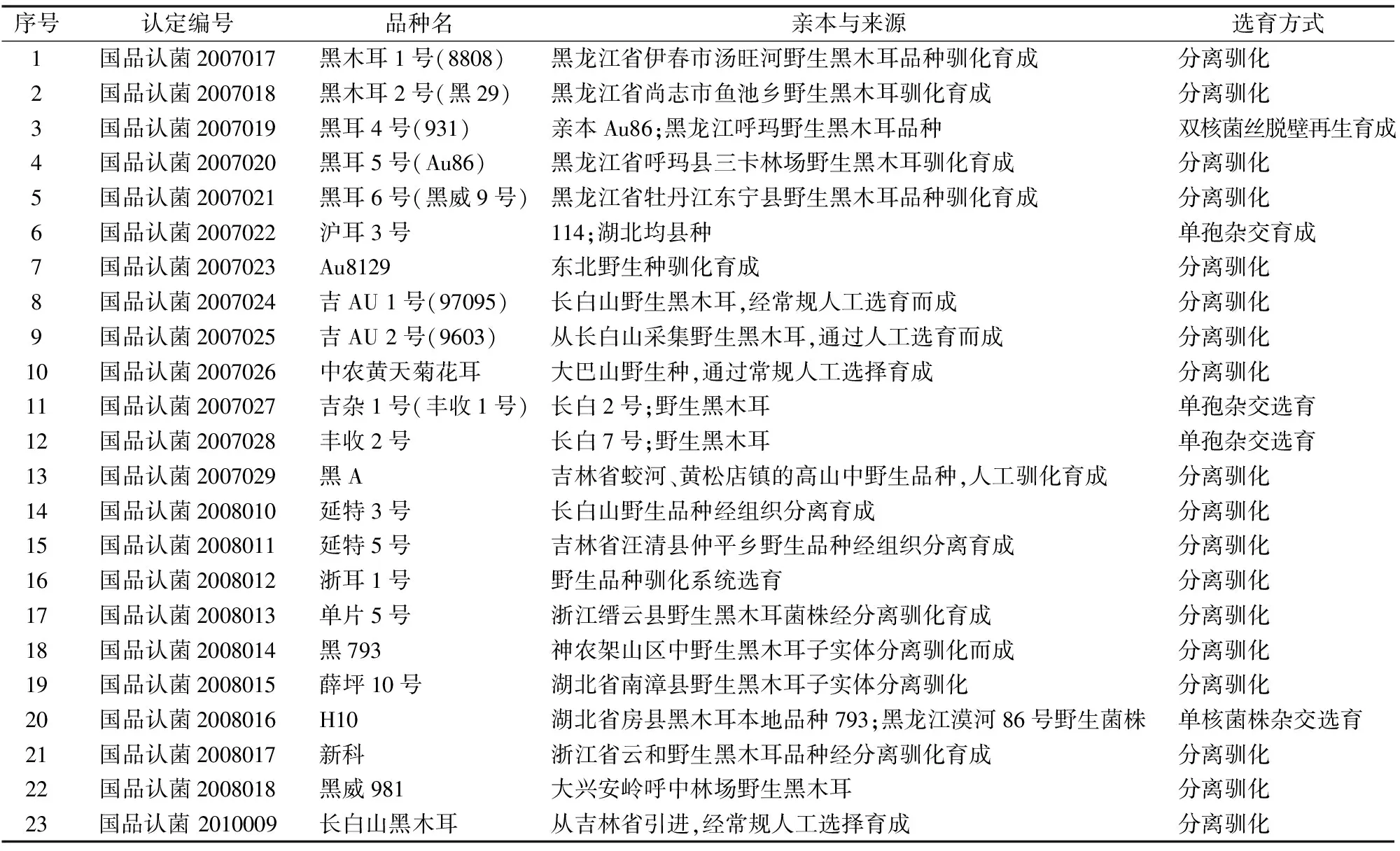
表1 23个国认黑木耳品种的详细信息
2 我国黑木耳育种技术现状
黑木耳是一种可食用的大型真菌,在生产中与植物不同的是其通过纯菌丝体营养繁殖产生后代,生产中的菌种也不是植物学中常规定义的种子,而是一个特殊的生长状态。但是无论如何生产,品种选育都是实现黑木耳高产高效生产的基础。
2.1 组织分离
通过分析国认品种的来源可以看出,我国国认黑木耳品种来源绝大多数是组织分离。这是由于黑木耳物种特性和组织分离是一种简单快捷的技术手段共同造成的。通过组织分离获得的黑木耳纯菌丝体可以直接用于生产,优质的种质可以直接用于品种的审定。所以,组织分离是获得优质黑木耳种质、品种的快捷方式。
黑木耳组织分离主要包括3种主要方式,分别是孢子分离、子实体组织分离、耳木菌丝分离。孢子分离是将黑木耳耳片简单消毒灭菌后,悬挂在培养基上方,通过孢子掉落,获得纯的菌丝体;子实体分离是将黑木耳子实体消毒后,直接放置在培养基上萌发生长,获得纯的菌丝体;耳木分离是分离野外椴木上生长的黑木耳菌丝体,在培养基上获得纯培养,从而用于生产。上述技术简单易得,是黑木耳菌种获得和开展黑木耳新品种选育的基础技术。
在黑木耳组织分离中,关键是组织灭菌,灭菌不到位,会影响到组织的萌发和菌丝体的最终使用。目前基本的灭菌方式有75%乙醇[3]、0.01%氯化汞[4]和2%次氯酸钠,以及培养基中加入青霉素、链霉素、庆大霉素等抗菌药物[3],抑制细菌生长。此外,李晓等发现加入青霉素、链霉素不仅有抗菌作用,还能够促进黑木耳菌丝的萌发[5-6],但其原因还未见报道。
2.2 杂交选育
杂交育种是一项成熟的育种技术,是指不同基因型的亲本菌株之间通过基因的自由组合、交换或其他方式产生兼有双亲优点的新的基因型[7]。这类型的基因重组是将双亲控制不同性状的优良基因结合于一体,或将双亲中控制同一性状的不同微效基因积累起来,产生在各该性状上超过亲本的类型。通常论述的杂交育种在食用菌中一般指的是单核菌株杂交育种,单核菌株杂交选育又可以分为单孢杂交、双单杂交、多孢杂交[8]。单孢杂交指的是把从子实体中收集的单核孢子菌丝体,或者通过原生体单核化技术获得的原生质体单核体菌丝,将两者中具有不同基因型或者生态型的单核体之间进行配对杂交[9]。国认品种沪耳4号、吉杂1号和丰收2号都是通过单孢杂交获得。福山等采用单孢杂交技术选育出了黑木耳优良菌种辽八号[10];李曼霞报道,单孢杂交技术选育出了黑木耳优良菌种陕耳1号[11]。双单杂交也就是布勒现象,当单倍体的初生菌丝与异核的非单倍体的次生菌丝发生杂交时,初生菌丝中的细胞核接受次生菌丝中的核而转变成次生菌丝的现象,目前双单杂交在金针菇上应用较多[12]。多孢杂交顾名思义指的是将很多孢子放到一起并在同一时间内进行杂交,然后从中挑选杂交菌株[13]。李省印等报道了通过多孢杂交育成了黑木耳新品种陕耳3号[14]。
单核菌株杂交选育关键内容是获得有效的单核菌株及开展合理高效的配对工作。食用菌有性生殖生殖可以分为同宗结合和异宗结合,黄亚东等研究结果表明,黑木耳是一种二级性异宗结合,因此在杂交组合中有50%的可能为不育[15-16]。目前关于黑木耳单核菌种研究主要集中在如何获得和高效鉴定方面,对于黑木耳单核菌株高效配对研究和性状分离研究相对较少,还处在杂交育种的初级阶段。韩增华等研究发现,荧光核染色技术可快速有效地鉴定黑木耳菌株的核相,脂酶同工酶技术可快速、准确地区分黑木耳单核菌株及杂交新菌株的不同核型,研究得到了1个酶带差异显著的黑木耳新菌株[17]。刘桂娟等研究发现在光学显微镜下通过观察黑木耳菌丝有无锁状联合来鉴定单、双核菌丝不够准确,光学显微镜镜检不能作为鉴定菌株单、双核的唯一依据,结合双重荧光染色镜检能更准确地鉴定菌株锁状联合的有无;并且提出了杂交菌株真实性鉴定法[1]。张伟琳利用HW5号和139号2株远源性大的优良黑木耳菌种作为亲本菌株制备原生质体菌株和孢子菌株,利用荧光显微镜和简单重复序列(ISSR)分子标记技术以及酯酶同工酶法来确定菌株单、双核及交配型,分别获得20个孢子单核菌株和2种交配型的原生质体单核菌株,用这2种单核菌株进行配对杂交,最终共获得6个杂交菌株[18]。韩增华等研究发现,酯酶同工酶谱及RAPD图谱结果可以将互补型条带和亲本条带清晰明确地区分开来,单核体单-单杂交获得核型为A1B2的杂交菌株,与亲本981的相似度高于亲本8808[19]。
2.3 原生质体融合育种
原生质体融合育种也可以理解为杂交育种,但其育种所用的材料是食用菌菌丝体生长的一个特殊阶段或者是通过技术手段从正常菌丝体细胞中获得的。国认菌种黑耳4号(931)(国品认菌2007019)就是通过原生质体融合育种技术获得。所谓原生质体融合育种技术指的是将具有遗传差异的没有细胞壁的单核原生质体,在融合剂的诱导下完成融合,使基因组发生部分或全部的交换和重组[20]。单核原生质体的来源可以分为自然产生的单核原生质体和人工处理产生的单核原生质体。自然生长状态下,异宗结合的蕈菌都具有原生质体单核化的现象,通过分离得到这些单核原生质体,并将单核原生质体应用在遗传育种之中[18]。人工处理产生单核原生质体就是通过蜗牛酶液、溶壁酶液及果胶酶液等分解细胞壁[21],从而获得单核原生质体。大量学者对黑木耳原生质体制备等技术开展了研究[22-27],唐玉琴报道,通过原生质体技术选育出了黑木耳新品种双高一号[28]。
邱敦莲等认为,茶树菇单核原生质体产生的同一交配型群体中,群落形态、菌丝生长速度、羟甲基纤维素酶相对活性和酯酶同工酶形状都具有相对的稳定性,变异范围小,说明亲本形状不易在原生质体中分散和稀释,在育种程序中可以从一个比较小的变异范围内选择具有亲本形状的不育单核体,有效地克服了传统育种过程中由孢子单核体遗传多样性所造成的亲本形状分散和选材困难的障碍,减少了筛选杂交后代的工作量[29]。谭琦等利用RAPD技术,对香菇孢子单核体和原生质体单核体的遗传差异变化进行了分析,结果表明以交配型基因为标记的孢子单核体遗传变异大于原生质体单核体,同种交配型的孢子单核体遗传相似性分别为66.3%、71.7%,而原生质体单核体的遗传相似性分别为98.7%、93.7%[30]。因此,通过原生质体单核化可以获得更接近亲本形状的育种材料,可以更快速地将一些优良形状整合在一起,从而获得优质的品种。黑木耳上关于单核原生质体遗传变异情况的分析还未见报道。
2.4 其他育种技术
除上述主要的育种技术手段外,黑木耳育种技术还包括诱变育种和生物工程育种。所谓诱变育种利用包括物理、化学以及生物、空间等诱变因子,使原黑木耳菌种中的遗传物质发生突变,进而使一部分菌株的遗传性状发生改变的技术手段[31]。贾建航等将黑木耳等食用菌材料进行卫星或高空气球搭载,通过地面研究拮抗反应、菌丝生长速度、出菇形态等方面发现,高空搭载材料出现明显变异,RAPD研究也证实一些搭载菌株在DNA水平发生了变异[32]。但是诱变过程中育种材料的变异方向不可控,随机性大,经过诱变处理后需要开展大量的试验进行分析变异方向。生物工程育种是目前育种技术的前沿,在植物育种中,目标育种成为发展的趋势。所谓生物工程育种是在分子水平上对菌株进行操作,获得具有特定遗传性状的新菌株。基因工程技术给黑木耳的可控育种方式开辟了新的方向,整合一些黑木耳中不具备但是对于黑木耳高产高效生产重要的基因,满足人们及市场的需要,这种新型的可控制的育种手段将在黑木耳育种工作中发挥着极其重要的作用。但是目前,食用菌中大多数重要性状都是数量性状,如菌丝生长速度、生育期、子实体形态、酶活性、单菇质量以及产量等,与质量性状不同,数量性状受多基因控制,遗传基础复杂,易受环境影响,表现为连续变异,表型和基因型间没有明确的对应关系,常规的育种手段难以实现数量性状的遗传改良[33]。
总体来说,黑木耳杂交育种技术研究相对薄弱,对杂交育种的机理机制性问题研究较少,如菌丝特性、子实体特性的孢子分离规律,目标性状的基因控制方式,黑木耳远缘杂交技术突破等等内容。上述研究内容的缺失,严重地制约着黑木耳杂交育种的大规模开展。
3 黑木耳育种研究方向和重点工作
食用菌既不像细菌等原核生物,又不同于高等植物等真核生物,形成了较为特殊的遗传行为和生活史特性[34],但是新品种选育同样是食用菌高产高效生产的基础环节和重要环节。现阶段落实黑木耳供给侧改革就是要减少黑木耳生产数量,提高黑木耳生产效率,降低黑木耳生产成本,提高黑木耳生产质量。这个目标的实现依然要依靠优质的黑木耳品种。通过综合以上信息,黑木耳育种工作的重点有以下几个方面:
3.1 扩大黑木耳种质资源种群,丰富品种的遗传背景
种质资源是新品种选育的基础,丰富的遗传背景是高效优质品种的基础。目前我国国认黑木耳品种的遗传基础主要来源于我国东北群体和华中南群体,并且两大群体种质资源相互杂交较少,各地区适宜的品种都是从本地区种质资源中选育获得,减少了种质资源间的交流和互换。通常来讲,杂交组合中较远的亲缘关系能够获得较强的杂种优势。因此,有必要扩大黑木耳种质资源的种群,丰富品种的遗传背景,实现黑木耳品种的高产和高效生产。
3.2 开展黑木耳产量形成规律研究
产量形成规律是实现黑木耳高产高效栽培的基础理论,只有探明黑木耳产量形成规律,才能指明黑木耳优良品种选育的目标。黑木耳产量形成规律内容应该包括黑木耳菌种活力机理、黑木耳培养料降解机理、黑木耳成耳生理等方面。通过探明黑木耳产量形成规律,有针对性地选择菌种活力高、培养料降解彻底、容易出耳的种质资源,从而选育出优质、高效的黑木耳品种。
3.3 开展杂交育种的基础关键技术研究
在杂交育种中,基础技术是杂交育种的中间关键环节,探明了这些中间关键环节的基本原理,开展杂交组合配对只是获得优质品种的重复性配对工作。在黑木耳杂交育种基础研究中,目前集中在单核菌株的获得和鉴定方面,关于单核菌种的性状规律和单核菌株亲和性方面研究较少。通过大量的基础理论研究,探明黑木耳在形成孢子过程中性状的分离规律和单核菌株亲和性规律,探明优质性状在原生质体单核化过程中的分离、组织规律,以提高黑木耳优质菌种的育成效率。此外,开展黑木耳杂种优势机理、优良性状的基因定位和性状控制基因分析,为黑木耳目标育种工作奠定基础。
3.4 开展黑木耳杂交品种选育研究
赵厚坤等认为经过多次的扩繁,菌种就会出现产量低、品质差、抗逆性差、发病率高,甚至不出耳的严重后果;经过有性繁育出的菌种,完全可以突破母本的优良性状,在各方面的表现都优于母本[35]。此外,杂种优势也是目前食用菌新品种选育的重要应用方面。通过大力开展黑木耳杂交育种,特别是不同种群间的杂交育种,扩大杂种优势,选育出优质、高效的黑木耳新品种。
[1]刘桂娟,姚方杰,陈 影,等. 黑木耳杂交菌株选育及其鉴定方法[C]//第九届全国食用菌学术研讨会摘要集. 北京:中国菌物学会,中国农学会食用菌分会,2010.
[2]黎 裕,李英慧,杨庆文,等. 基于基因组学的作物种质资源研究:现状与展望[J]. 中国农业科学,2015,48(17):3333-3353.
[3]尹晓宇,张兴梅. 黑木耳组织分离改进方法研究[J]. 黑龙江农业科学,2015(3):132-134.
[4]李云龙,刘 柱. 黑木耳的组织分离技术[J]. 浙江食用菌,2008,16(3):41.
[5]李 晓,孟秀秀,代月婷,等. 黑木耳简单快速组织分离新法[J]. 中国食用菌,2014,33(6):11-12.
[6]宋素珍,商进才. 黑木耳组织分离的新消毒法[J]. 食用菌,1991(1):38.
[7]付立忠,吴学谦,魏海龙,等. 我国食用菌育种技术应用研究现状与展望[J]. 食用菌学报,2005,12(3):63-68.
[8]阎培生,罗信昌,周 启. 木耳属种的分子系统发育关系研究[J]. 吉林农业大学学报,1998,20(增刊):77-80.
[9]陈世通,白建波,蒲 敏,等. 香菇单孢杂交及杂交菌株分子鉴定[J]. 食用菌学报,2013,20(1):1-8.
[10]福 山,韩 丽. 黑木耳优良菌种“辽八号”选育成功[J]. 特产科学实验,1987(3):17.
[11]李曼霞. 黑木耳新菌种陕耳1号[J]. 西北农业学报,1993(1):33.
[12]王 波,祁丽萍,贾定洪,等. 金针菇双-单杂交遗传机理分析[C]//第十届全国食用菌学术研讨会论文汇编. 北京:中国菌物学会,2014.
[13]桑 峰. 木耳优良杂交菌株的初步筛选[D]. 武汉:华中农业大学,2011.
[14]李省印,常杨生,胡彩霞,等. 代料地栽黑木耳新品种‘陕耳3号’[J]. 园艺学报,2004,31(4):565-565.
[15]黄亚东. 木耳的极性研究[D]. 武汉:华中农业大学,2004.
[16]肖 扬. PCR技术在黑木耳交配型因子研究中的应用[D]. 武汉:华中农业大学,2005.
[17]韩增华,张丕奇,戴肖东,等. 黑木耳亲本、单核、杂交菌株鉴定的研究[J]. 菌物研究,2009,7(2):99-103.
[18]张伟琳. 黑木耳单核杂交菌株远源性的研究[D]. 哈尔滨:黑龙江大学,2011.
[19]韩增华,张介驰,张丕奇,等. 黑木耳单核杂交菌株遗传分析[J]. 核农学报,2015,29(5):843-848.
[20]Zhao J,Chang S T. Monokaryotization by protoplasting heterothallic species of edible mushrooms[J]. World Journal of Microbiology and Biotechnology,1993,9(5):538-543.
[21]陈文强,王 进,邓百万,等. 秦巴山区黑木耳主要栽培种内原生质体分离与融合[J]. 食品与生物技术学报,2014,33(8):856-864.
[22]赵有鑫,唐玉琴. 原生质体融合技术在黑木耳育种上的研究进展[J]. 吉林农业C版,2011(4):69-69.
[23]许修宏,孟 琦,刘华晶,等. 黑木耳菌丝原生质体的制备再生及单核鉴定研究[J]. 东北农业大学学报,2011,42(8):96-100.
[24]郭砚翠,刘凤春,王雅茹,等. 黑木耳原生质体再生株选育高产菌株研究[J]. 食用菌学报,1994,1(2):7-10.
[25]韩增华,张丕奇,戴肖东,等. 黑木耳原生质体制备、再生及单核体荧光鉴定[J]. 食用菌学报,2008,15(3):13-17.
[26]杨国良,杨秀琴,杨晓仙,等. 毛木耳与黑木耳的原生质体融合育种[J]. 中国食用菌,1990(4):14-16.
[27]李 楠,许修宏. 黑木耳原生质体制备及再生的研究[J]. 东北农业大学学报,2009,40(7):34-37.
[28]唐玉琴. 通过原生质体技术选育的黑木耳新品种“双高一号”品比研究[J]. 北方园艺,2014(24):153-154.
[29]邱敦莲,刘本洪,肖在勤,等. 茶树菇原生质体的分离和再生以及单核菌株的筛选[J]. 西南大学学报(自然科学版),2008,30(12):116-120.
[30]谭 琦,杨建明,陈明杰,等. 香菇孢子单核体与原生质体单核体遗传差异分析[J]. 中国食用菌,2001,20(6):3-5.
[31]付立忠,吴学谦,魏海龙,等. 我国食用菌育种技术应用研究现状与展望[J]. 食用菌学报,2005,12(3):63-68.
[32]贾建航,金德敏,边银丙,等. 食用真菌空间诱变育种研究[J]. 食用菌学报,1998,5(4):13-18.
[33]龚文兵,肖 扬,周 雁,等. 食用菌QTL定位研究进展[J]. 园艺学报,2011,38(9):1800-1806.
[34]贺立虎,李黔蜀. 食用菌遗传育种技术的研究进展[J]. 陕西农业科学,2012,58(1):116-118.
[35]赵厚坤,李云龙,刘 柱. 黑木耳杂交育种试验[J]. 中国食用菌,2008,27(1):19-21.
