Cd-HA-TiO2联合胁迫对小球藻致毒效应的研究
2018-01-11梁斯韵曾丽璇张秋云罗继文
梁斯韵, 康 园, 曾丽璇, 张秋云, 罗继文
(华南师范大学化学与环境学院,广州 510006)
Cd-HA-TiO2联合胁迫对小球藻致毒效应的研究
梁斯韵, 康 园*, 曾丽璇, 张秋云, 罗继文
(华南师范大学化学与环境学院,广州 510006)
以小球藻为受试生物,研究Cd-HA-TiO2联合暴露体系对小球藻的毒性作用. 实验结果表明,Cd单独作用、Cd-HA和Cd-TiO2联合作用下,Cd的96h-EC50分别为:0.166、0.185~0.207和0.185~0.199 mg/L,以上结果说明当HA或TiO2存在情况下,可以降低Cd对小球藻的生物毒性,这主要是由于HA或TiO2可以吸附水中Cd,降低体系中自由金属离子的质量浓度,进而减弱了Cd的生物毒性. 但在Cd-HA-TiO2三者联合作用下,Cd的96h-EC50降低到0.063~0.089 mg/L,表明当HA、TiO2同时存在时,Cd对小球藻的生物毒性显著增强. 通过检测暴露后的丙二醛(MDA)、过氧化氢酶(CAT)和超氧化物(KAT)水平,发现Cd-HA-TiO2联合作用时,小球藻的CAT水平显著高于其他暴露条件(P<0.05);细胞内Cd分布实验结果显示三者联合暴露显著促进了小球藻细胞内的Cd的生物累积量(P<0.05).因此,小球藻的氧化性损伤(CAT水平)和Cd的生物积累水平可能解释了三者联合暴露导致Cd毒性显著增强的原因.
小球藻; 联合毒性; 二氧化钛; 腐殖酸; 镉
自20世纪80年代以来,纳米技术和纳米材料发展迅速,纳米二氧化钛(TiO2)作为基体材料,在食品、化妆品、能源、医学、催化等领域得以广泛运用[1]. 纳米二氧化钛可通过多种途径进入天然水体环境和生物体内,对水生生态系统和人体健康构成潜在风险. 水体中的镉(Cd)主要来源于矿山开采、工业废水、土地冲刷等,大气镉尘经过干湿沉降也可使镉进入环境水体中[2]. 镉在天然水体中主要以游离态存在,也可与水体中的有机和无机配体形成可溶性配合物[3]. 腐殖酸(HA)作为一类天然的高分子化合物,在地球中分布广泛,其含量约占水中总有机物的50%~90%[4]. 腐殖酸官能团中带有大量羧基、羟基、醌基等活性基团,可以与水中多种物质发生物理、化学作用,改变污染物在水中的迁移和归宿,进而改变污染物质对水生生物的生物毒性[5].
藻类作为水生生态系统初级生产者,是水生生态系统的基础组成部分,对水生生态系统的平衡、稳定和发展有着十分重要的作用,同时也是水体污染中的首要受害者. 小球藻由于存在广泛、生长速度快、易于人工培养、结构简单、对环境变化敏感等特点,使其在环境毒理学研究领域得到广泛关注[6].
已有大量研究考察了单污染物(重金属、纳米二氧化钛)的生物毒性及其环境健康风险[7-9]. 然而,环境中还存在多种污染物,多种物质之间的相互作用与联合反应均会影响某一物质的生物有效性和毒性. 也有许多报道研究了重金属—腐殖酸、重金属—二氧化钛、腐殖酸—二氧化钛两者联合暴露时对水生藻类的影响[10-15],但对3种物质联合暴露的研究还比较缺乏. 本文旨在将腐殖酸这一自然因素纳入考虑范围中,并选取了Cd和TiO2,研究Cd-HA-TiO2联合暴露体系对小球藻的毒性作用,并与单独暴露、两者联合暴露作比较,分析Cd-HA-TiO2联合暴露下小球藻的生理应答.
1 研究方法
1.1 藻类培养
试验所用小球藻由暨南大学惠赠. 小球藻用水生4号培养基[16]在光照培养箱中连续培养,温度(25±1) ℃,光照强度6 000 lx,光暗周期16 h∶8 h,每天定时摇动3次. 小球藻经实验室预培养使藻细胞达到同步化生长,取处于指数生长期的健康藻细胞进行实验. 实验中培养基所用化学试剂均为分析纯,使用前未经进一步纯化. 腐殖酸为商品腐殖酸,购于上海晶纯生化科技股份有限公司. 二氧化钛类型为P25.
1.2 藻类生物量计算
通过血球计数板对小球藻进行计数,确定在水生4号培养基中藻细胞密度与OD684之间的线性关系,实验结果为:y=3 633.21x,相关系数R2=0.997>0.990%,P<0.05,该线性回归模型拟合优度较高,式中,x为小球藻吸光度,y为小球藻细胞密度(104个/mL).
1.3 急性毒性实验
根据有毒化学品对藻类毒性测试的标准实验方法[17],取60 mL小球藻液置于100 mL烧杯中进行实验,分为对照组和实验组(小球藻起始浓度为:1×104个/mL). 对照组使用水生4号培养基进行培养,实验组使用水生4号培养基并加入Cd、HA或TiO2储备液进行培养,实验组划分为以下3组,根据上述方式进行培养,在培养24、48、72、96 h时分别取样测定其OD684. 每个样品均设置3个平行样.
单因子胁迫实验:①TiO2单独胁迫,TiO2质量浓度设置为:0.5、1.0、2.0、4.0、8.0 mg/L;②HA单独胁迫, HA质量浓度设置为:1、5、10 mg/L;③Cd单独胁迫, Cd2+的质量浓度设置为:0.05、0.10、0.15、0.20、0.40、0.80 mg/L.
两因子联合胁迫实验:④Cd -TiO2联合胁迫;⑤Cd-HA联合胁迫;⑥HA -TiO2联合胁迫;
三因子联合胁迫实验:⑦Cd-HA-TiO2联合胁迫.
根据单因子胁迫实验结果,两因子及三因子联合胁迫实验选取TiO2质量浓度为:1、4 mg/L, HA质量浓度为:1、5、10 mg/L, Cd2+的质量浓度设置为:0.05、0.10、0.15、0.20、0.40、0.80 mg/L.
1.4 小球藻氧化性损伤
小球藻细胞裂解液制备:培养48、96 h后,取藻液于离心管中,在低温下以3 500 r/min 离心10 min,弃上清液;用去离子水悬浮藻液,离心,弃上清液;用western及IP细胞裂解液(碧云天生物技术研究所,P0013)冰浴裂解藻细胞30 min;低温下以3 500 r/min 离心10 min,取上清液得到藻细胞裂解液,用于测定脂质氧化(MDA)和过氧化氢酶(CAT).
取上述所得细胞裂解液,采用脂质氧化(MDA)检测试剂盒(TBA法)(碧云天生物技术研究所,S0131),过氧化氢酶检测试剂盒(碧云天生物技术研究所,S0051)测定脂质氧化和过氧化氢酶.
培养48、96 h后,取藻液于离心管中,在低温下以3 500 r/min 离心10 min,弃上清液;用去离子水悬浮藻液,离心,弃上清液,得藻细胞备用. 采用超氧化物检测试剂盒(碧云天生物技术研究所,S0060)测定上述制备所得藻细胞的超氧化物. 氧化性损伤实验中根据1.1步骤对小球藻进行培养,其中小球藻起始浓度为:OD684=0.050,ρ(HA)为5 mg/L,ρ(TiO2)为 1 mg/L,ρ(Cd)为0.25 mg/L.
1.5 小球藻对重金属Cd的积累
用0.45 μm的滤膜对藻液进行过滤,滤液加入浓硝酸在120 ℃下消解2 h,用原子吸收分光光度计测量其Cd质量浓度,所得结果为藻细胞外Cd部分. 过滤所得藻泥用10 mmol EDTA-Na2重新分散10 min,用0.45 μm的滤膜过滤,滤液加入浓硝酸在120 ℃下消解2 h,原子吸收分光光度计测量其Cd质量浓度,所得结果为藻细胞吸附态Cd. 藻泥加入浓硝酸在120 ℃下消解2 h,用原子吸收分光光度计测量所得结果为藻细胞吸收态Cd. 其中藻细胞吸附态Cd和吸收态Cd为小球藻积累的Cd部分. 在培养小球藻6、12、24、48、72、96 h时取样测定. 吸收实验中根据1.1步骤对小球藻进行培养,其中小球藻起始浓度为:OD684=0.050,ρ(HA)为5 mg/L,ρ(TiO2)为 1 mg/L,ρ(Cd)为0.25 mg/L.
1.6 数据分析及处理
小球藻生长抑制率参照文献[18]采用相对数量法进行计算,公式如下:

(1)
式中,I为抑制率(%),Ntn为实验组n时刻测定时藻生物量;Nt0为实验组初次测定时藻生物量,NCn为对照组n时刻测定时藻生物量;NC0为对照组初次测定时藻生物量.
细胞吸收模型参照文献[19]进行计算,公式如下:

式中,Ci为藻细胞积累的Cd(mg/1010个藻细胞);Ce为藻细胞外的Cd(mg/1010个藻细胞);K0为藻细胞积累Cd的速率;K1为藻细胞清除Cd的速率;t为暴露时间.
利用软件SPSS 16.0求出线性回归方程并计算不同暴露情况下Cd的96h-EC50;并利用单因素分析(ANVOA)、多重比较检验法(LSD法和Tamhane’s T2法)进行组间差异性检验. 结果中*P<0.05表示存在显著性差异.
2 结果与讨论
2.1 Cd、HA、TiO2对小球藻的毒性作用
2.1.1 Cd、HA、TiO2单独胁迫对小球藻的毒性作用 HA单独作用下,小球藻的生长曲线与对照组相比没有显著性差异(图1A),表明在该质量浓度范围内HA单独作用时不会对小球藻产生生长抑制作用. 与HA类似,TiO2单独作用下(图1B),小球藻的生长与对照组基本一致,无显著性差异,研究[20]表明TiO2的生物毒性与其颗粒形状、粒径大小和化学组成等因素有关,藻类对TiO2的耐受性也具有种属特异性. 实验结果表明该质量浓度下TiO2不会抑制小球藻的生长.
对照组与Cd实验组的小球藻生物量均随着暴露时间的延长逐渐升高(图1C). 在Cd胁迫下,实验组每个时间段的藻生物量均低于对照组,小球藻生长受到明显的抑制作用. 且随着Cd质量浓度的增加,藻生物量逐渐降低,表明该生长抑制作用呈现明显的剂量-效应关系.当Cd质量浓度为0.05、0.10 mg/L时,小球藻96 h的生长抑制率分别为8.57%和19.09%,当Cd质量浓度提高至0.40、0.80 mg/L时,小球藻96 h的生长抑制率分别上升93.27%和96.30%. Cd对小球藻的生长抑制作用可能与破坏小球藻新陈代谢、干扰叶绿素合成和影响光合作用有关. Cd可以与细胞膜上的巯基结合,阻止Ca的跨膜运输从而导致细胞内Ca减少,Ca的减少可能导致藻细胞内部代谢紊乱[21]. 同时,Cd可以抑制原叶绿素酸酯及其底物的合成,进而影响叶绿素的合成[20]. Cd还可以通过损害藻细胞的PSⅡ中心和阻碍光合电子传递过程进而影响藻细胞的光合作用[7]
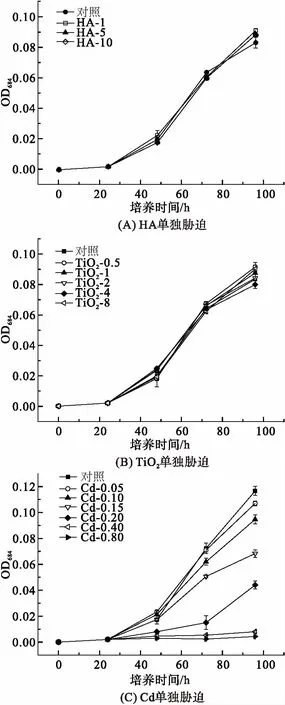
图1 HA、TiO2和Cd对小球藻生物量的影响
2.1.2 Cd、HA、TiO2两因子联合胁迫对小球藻的毒性作用 与Cd单独作用相似(图2A),在2种联合作用下,随着Cd质量浓度增加,小球藻96 h的生长抑制率均增加. Cd单独作用时,Cd的96 h-EC50为0.166 mg/L;Cd-HA联合作用时(HA质量浓度为1、5、10 mg/L),Cd的96 h-EC50分别为:0.185、0.185、0.207 mg/L; Cd-TiO2联合作用时(图2B,TiO2质量浓度为1、4 mg/L),Cd的96 h-EC50分别为0.185、0.199 mg/L. 与Cd单独作用相比,当体系中存在HA或TiO2时,Cd的96 h-EC50均有不同程度的提升,表明HA或TiO2存在情况下,可以降低Cd对小球藻的生长抑制作用(P>0.05). 根据自由离子活度模型(FIAM),金属离子对藻类毒性与体系中自由金属离子的浓度呈正相关[22]. HA上带有大量羧基、羟基等活性基团,使得腐殖酸表面带有较大的负电性[5]. 因此HA可以与水中的Cd离子发生离子交换、螯合、絮凝、表面吸附等作用,降低水体中Cd自由离子的浓度,从而降低Cd的吸收和毒性. 已有研究[13]表明TiO2颗粒可以吸附Cd,减少其外界环境中游离Cd的浓度,进而降低Cd对小球藻的生长抑制作用.
由图2C可知,当HA-TiO2联合作用时,小球藻96 h生长抑制率与TiO2单独作用(HA为0 mg/L)相比均有不同程度的上升. 当HA质量浓度一定时,小球藻的生长抑制作用随着TiO2质量浓度的增加而增强,对TiO2质量浓度呈现明显的依赖关系. 当HA为5.0 mg/L, TiO2质量浓度为0.5、1.0 mg/L时,小球藻96 h生长抑制率分别为2.83%和7.40%. 当TiO2质量浓度为8.0 mg/L时,生长抑制率上升至64.53%. 这主要是由于TiO2具有光敏活性,在光照情况下能对HA进行光解作用产生活性氧(ROS),ROS基团具有强氧化性会对小球藻产生胁迫作用,导致小球藻在HA-TiO2联合作用时生长抑制率上升[10].
2.1.3 Cd、HA和TiO2三因子联合胁迫对小球藻的毒性作用 在Cd-HA-TiO2联合作用下(图3),当Cd质量浓度<0.40 mg/L时,各组小球藻的96 h生长抑制率远高于Cd单独作用时,与其存在显著性差异(P<0.05). 由表1可知,小球藻在Cd-HA-TiO2联合作用下,Cd的96 h-EC50为0.063~0.089 mg/L,远低于Cd单独作用、Cd-HA和Cd-TiO2联合作用这3种情况的96 h-EC50. 以上实验结果表明,当HA和TiO2同时存在时,Cd对小球藻的生长抑制作用明显增强. 且当TiO2质量浓度由1.0 mg/L上升至为4.0 mg/L时, Cd-HA-TiO2联合胁迫对小球藻生长抑制作用显著增强. 当Cd质量浓度为0.05 mg/L,TiO2质量浓度为1.0 mg/L时,小球藻的96 h生长抑制率为34.83%~54.30%,当TiO2质量浓度上升至4.0 mg/L时,小球藻的96 h生长抑制率上升到66.55%~84.25%,存在组间差异.
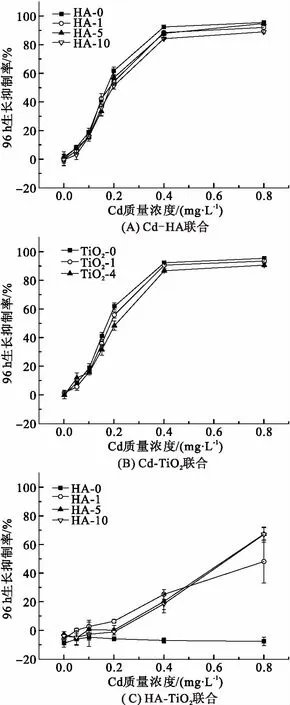
图2 Cd-HA、Cd-TiO2和HA-TiO2联合作用下对小球藻生长作用的影响
Figure 2 Effects of Cadmium on the growth ofChlorellain the exposure of Cd-HA、Cd-TiO2and HA-TiO2for 96 h
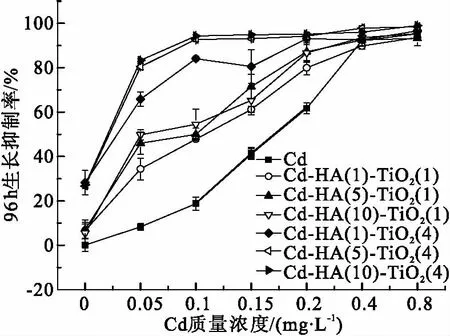
图3 Cd- HA-TiO2联合作用下对小球藻生长作用的影响
Figure 3 Effects of Cadmium on the growth ofChlorellain the exposure of Cd-HA-TiO2for 96 h
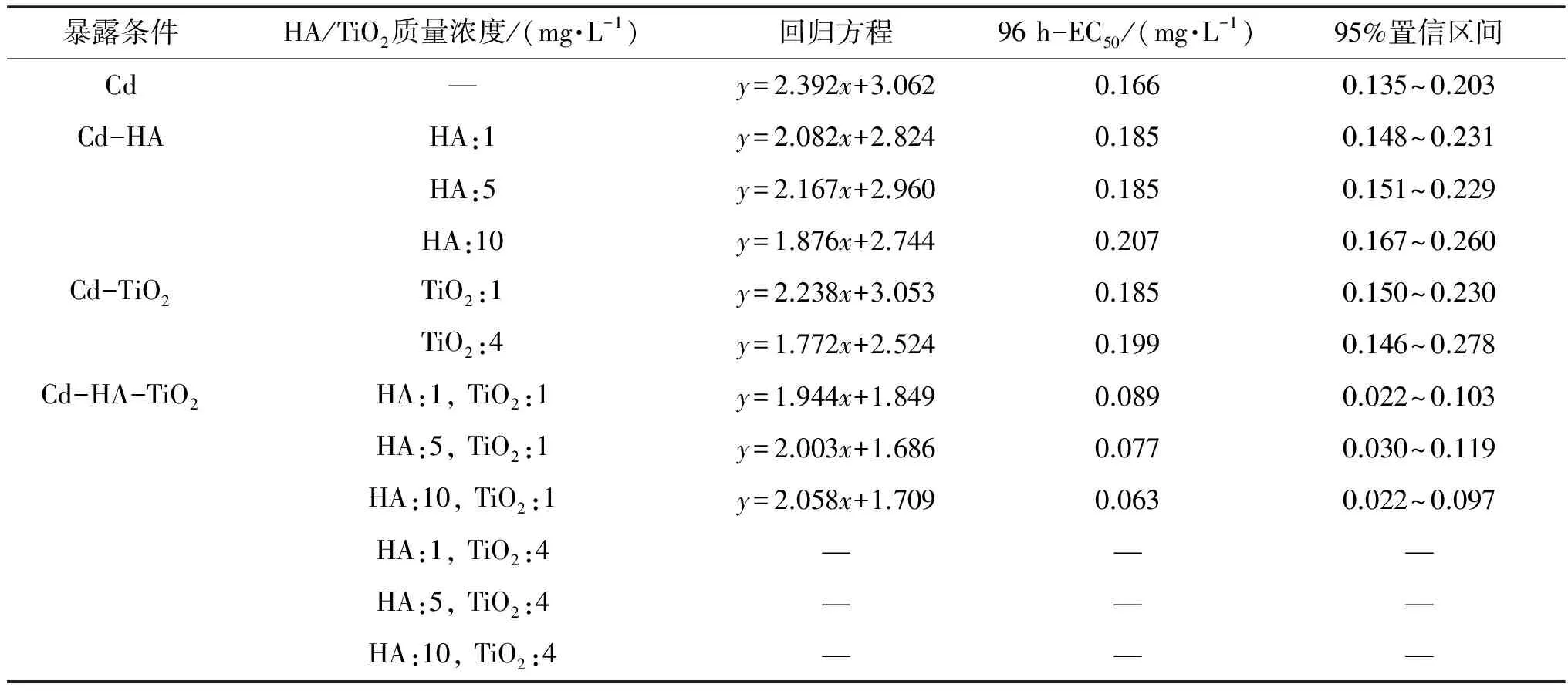
表1 小球藻在不同暴露条件下的回归方程及96 h-EC50Table 1 Regression equations and 96 h-EC50 of Chlorella growth under different exposure conditions
当Cd质量浓度大于0.40 mg/L,藻的生物量均急剧下降,不同暴露条件下的96 h生长抑制率相近,不存在显著性差异(P>0.05),这主要是由于高质量浓度的Cd就可以引起较强的生长抑制作用和毒性效应,其他因素的影响相对较弱. 因此,应重点关注当Cd质量浓度相对较低以及HA和TiO2同时存在时,Cd对小球藻的毒性作用增加的原因及机制.
2.2 不同暴露情况下小球藻的氧化性损伤
丙二醛(MDA)是生物体脂质氧化的天然产物. 动物或植物细胞发生氧化应激时,会发生脂质氧化,一些脂肪酸氧化后逐渐分解为一系列复杂的化合物,其中包括MDA. 因此可通过监测MDA的水平检测脂质氧化的水平. 不同暴露条件下的小球藻的脂质氧化水平如图4A所示,在Cd胁迫48、96 h后,小球藻的MDA与对照组相比明显上升,表明有自由基产生与造成损伤的过程. 且96 h时小球藻在不同暴露条件下的MDA均高于48 h(对照组除外),表明小球藻的脂质氧化损伤随着胁迫时间增长而增强. 外界胁迫96 h后,Cd单独作用、Cd-HA和Cd-TiO2联合作用这3种情况下,MDA分别为对照组的1.69倍、2.11倍、1.84倍;在Cd-HA-TiO2联合作用时,MDA为对照组2.06倍. 脂质氧化可以破坏细胞质膜的结构和功能,影响细胞代谢[23].
植物体内的过氧化氢酶(CAT)可以把机体代谢产生的H2O2分解为H2O和O2,具有解毒作用[24]. 外界胁迫下,细胞体内代谢产生的H2O2增加,会诱导产生更多的过氧化氢酶,因此CAT也可作为氧化性损伤标志. 由图4B可知,在没有Cd胁迫的情况下,小球藻的CAT活力与对照组相近. 在Cd胁迫48、96 h后,小球藻的CAT与对照组相比均有明显上升. 在Cd单独作用、Cd-HA和Cd-TiO2联合作用这3种情况下,当外界胁迫48 h后, CAT分别为1.11、1.44和1.26 U/109个藻细胞,其中在Cd-HA-TiO2联合作用时,CAT水平达到1.83 U/109个藻细胞,为对照组的2.61倍. Cd-HA-TiO2联合作用96 h后,相比其他暴露条件,CAT依然最高,达到1.85 U/109个藻细胞,为对照组的2.48倍 (P<0.05). 这可能是因为与其他暴露条件相比,Cd-HA-TiO2联合作用时小球藻代谢产生的H2O2水平较高,从而诱导了较多的过氧化氢酶产生.
超氧化物(KAT)通常指超氧化物阴离子,是一种氧分子自由基.在呼吸链中,NADPH氧化酶把电子传递给氧分子时会产生超氧化物阴离子,它可以导致氧化性损伤. 由图4C可以看出,在不同环境暴露48和96 h后,小球藻产生的KAT水平相近,不存在显著性差异(P>0.05). 这可能是因为不同的胁迫环境不会对藻细胞的NADPH氧化酶产生明显影响.

图4 在不同条件下暴露48 h和96 h后小球藻的MDA、CAT 和KAT含量
Figure 4 MDA, CAT and KAT ofChlorellaafter 48 h and 96 h in different exposure conditions
2.3 不同暴露情况下小球藻对Cd的积累
外界环境存在Cd时,小球藻会吸收外界环境的Cd. 当培养时间<12h,藻细胞对Cd的积累主要是吸附在细胞壁上(图5),当吸附达到平衡时藻细胞不再积累Cd,单位数量小球藻的Cd积累基本维持在同等水平. 随着培养时间增加,吸附在细胞壁上的Cd逐渐转移进入藻细胞内部,单位数量小球藻的Cd积累略有上升. 当培养时间>24小时,小球藻分裂繁殖,其生物量增加. 在体系中Cd总量一定的情况下,单位数量小球藻的Cd积累逐渐下降.
暴露 24、48、72和96 h时后(图5),小球藻在Cd-HA-TiO2联合作用下对Cd的生物积累均高于其他3种情况(P<0.05). 由表2可知,HA和TiO2同时存在情况下,Cd在小球藻细胞内外的累积系数(细胞积累Cd的速率/细胞代谢Cd的速率)也均高于其他3种情况. 以上结果表明Cd-HA-TiO2联合作用下,小球藻对Cd的吸收和积累相对其他暴露条件有所增加. 这可能是由于HA和TiO2黏附在藻细胞表面,而TiO2在光照条件下可以光解HA产生ROS基团,可能改变细胞质膜的通透性,使得藻细胞对体系中游离Cd的积累增加.
此外,Cd在三者联合作用下的藻细胞累积量增加可能与细胞转运蛋白的表达有关系. 有研究表明,Cd进入硅藻细胞主要通过ABC超家族转运蛋白[25]. 三者联合暴露是否会影响小球藻的ABC超家族转运蛋白需要进一步实验的验证,同时需要小球藻内ABC超家族转运蛋白的基因注释工作的推动. 而Cd-HA- TiO2三者联合作用,是否会改变Cd的形态从而改变Cd的毒性,比如形成有机镉,也需要进一步的工作进行研究.
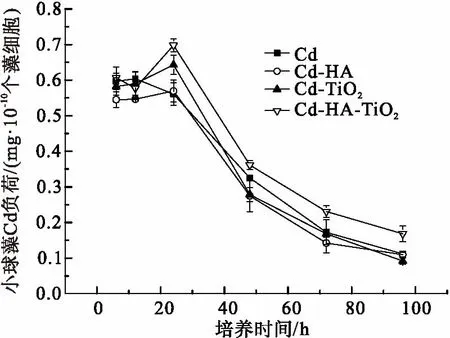
图5 96 h内Cd单独作用、Cd-HA、Cd-TiO2和Cd-HA-TiO2联合作用下对单位数量小球藻生物积累Cd的影响
Figure 5 Cd bioaccumulation inChlorellain the exposure of Cd, Cd-HA, Cd-TiO2or Cd-HA-TiO2
表2不同暴露条件下Cd在小球藻细胞的累积
Table 2 Ratios of Cd bioaccumulation inside and outside theChlorellacells

暴露条件CdCd-HACd-TiO2Cd-HA-TiO2累积系数1.331.091.131.63
注:累积系数=细胞积累Cd的速率/细胞代谢Cd的速率
3 结论
以小球藻为受试生物,研究了Cd-HA-TiO2联合暴露体系对小球藻的毒性作用以及小球藻的生理应答. 实验结果表明:
(1)在Cd胁迫下,小球藻的生长受到抑制,且呈剂量依赖效应.当HA或TiO2存在时,HA或TiO2可以吸附水中Cd,降低体系中自由金属离子的质量浓度,从而降低Cd对小球藻的生物毒性. 当HA、TiO2同时存在时,Cd对小球藻的生物毒性显著增强.
(2)在Cd胁迫下,小球藻的MDA、CAT水平均明显高于对照组,表明有自由基产生与造成氧化损伤. 在Cd-HA-TiO2联合作用时,小球藻的CAT水平最高.
(3)在Cd-HA-TiO2联合作用时,藻细胞对Cd的生物积累高于其他暴露条件下Cd的生物积累.
(4)结合急性毒性结果,HA、TiO2同时存在时,Cd对小球藻的生物毒性显著增强可能与藻细胞的氧化性损伤和Cd的生物积累增加有关.
[1] WEIR A,WESTERHOFF P,FABRICIUS L,et al. Titanium dioxide nanoparticles in food and personal care products[J]. Environmental Science & Technology,2012,46(4):2242-2250.
[2] 何孟常,王子健,汤鸿霄. 乐安江沉积物重金属污染及生态风险性评价[J]. 环境科学,1999,20(1):7-10.
HE M C,WANG Z J,TANG H X. Pollution and ecological risk assessment for heavy metals in sediments of Le’an river[J]. Environmental Science,1999,20(1):7-10.
[3] 兰亚琼. 水环境中镉离子与腐殖酸作用特性的研究[D]. 西安:西安建筑科技大学,2011.
LAN Y Q. Study of characteristics of heavy metals and humic acid in the water environment[D]. Xi′an:Xi′an University of Architecture and Technology,2011.
[4] 林立,孙卫玲,倪晋仁. 天然水中离子对消毒过程中挥发性卤代烃生成的影响[J]. 环境化学,2004,23(4):413-419.
LIN L,SUN W L,NI J R. The effects of iron in natural water on the formation of volatile halo-hydrocarbon in disinfection process[J]. Environmental Chemistry,2004,23(4):413-419.
[5] 梁咏梅,刘伟,马军. pH和腐殖酸对高铁酸盐去除水中铅,镉的影响[J]. 哈尔滨工业大学学报,2003,35(5):545-548.
LIANG Y M,LIU W,MA J. Effect of pH and humic acid on removal of lead and cadmium by combined ferrate pretreatment and alum coagulation[J]. Journal of Harbin Institute of Technology,2003,35(5):545-548.
[6] 李雅洁,王静,崔益斌,等. 纳米氧化锌和二氧化钛对斜生栅藻的毒性效应[J]. 农业环境科学学报,2013,32(6):1122-1127.
LI Y J,WANG J,CUI Y B,et al. Ecotoxicological effects of ZnO and TiO2nanoparticles on microalgae Scenedesmus oblignus[J]. Journal of Agro-Environment Science,2013,32(6):1122-1127.
[7] 姜晶. 蛋白核小球藻对重金属的吸附及其机理的研究[D]. 杭州:浙江工业大学,2012.
JIANG J. Biosorption of heavy metals from aqueous solution byChlorellapyrenoidsaand its reaction mechanism.[D]. Hangzhou:Zhejiang University of Technology,2012.
[8] 苏甜,李义刚,欧瑞康,等. 镉离子对羊角月牙藻光合作用及其抗氧化酶的毒性影响[J]. 生态科学,2014(2):301-306.
SU T,LI Y G,OU R K,et al. Toxic effects of Cd2+on the photosynthesis and antioxidase activity ofSelenastrumcapricornutum[J]. Ecology Science,2014(2):301-306.
[9] 杨晓静,陈灏,闫海,等. 纳米二氧化钛和单壁碳纳米管对普通小球藻生长的抑制效应[J]. 生态毒理学报,2010,5(1):38-43.
YANG X J,CHEN H,YAN H,et al. Effects of nano-TiO2and single-walled carbon nanotubes on the growth ofChlorellavulgaris[J]. Asian Journal of Ecotoxicology,2010,5(1):38-43.
[10] YANG S P,BAR-ILAN O,PETERSON R E,et al. Influence of humic acid on titanium dioxide nanoparticle toxicity to developing zebrafish[J]. Environmental Science & Technology,2013,47(9):4718-4725.
[11] SLAVEYKOVA V I,WILKINSON K J,CERESA A,et al. Role of fulvic acid on lead bioaccumulation byChlorellaKesslerii[J]. Environmental Science & Technology,2003,37(6):1114-1121.
[12] TAN C,FAN W H,WANG W X. Role of titanium dioxide nanoparticles in the elevated uptake and retention of cadmium and zinc in Daphnia magna[J]. Environmental Science & Technology,2011,46(1):469-476.
[13] 杨溦莞. 纳米二氧化钛颗粒对Cd2+生物有效性及毒性的影响[D]. 南京:南京大学,2013.
YANG W G. Effects of titanium dioxide engineered nanoparticles on the bioavailability and toxicity of Cd2+[D]. Nanjing:Nanjing University,2013.
[14] 冀静. 腐殖酸对纳米颗粒藻类毒性的影响及机理[D]. 杭州:浙江大学,2011.
JI J. The effect and its mechanism of humic acid on the algal toxicity of nanoparticles[D]. Hangzhou:Zhejiang University,2011.
[15] STEWART T J,BEHRA R,SIGG L. Impact of chronic lead exposure on metal distribution and biological effects to periphyton[J]. Environmental Science & Technology,2015,49(8):5044-5051.
[16] 石瑛,杜青平,谢树莲. 1,4-二氯苯对蛋白核小球藻的毒性效应[J]. 环境科学研究,2007,20(3):133-136.
SHI Y,DU Q P,XIE S L. The toxic effects of 1,4-Dichlorobenzene onChlorellapyrenoidosa.[J]. Research of Environmental Sciences,2007,20(3):133-136.
[17] 化学品藻类生长抑制试验G B T[S]. GB/T 21805-2008.
[18] 赵玉艳,蔡磊明. 几种藻类毒性试验统计方法的差异[J]. 农药,2004,43(7):298-299.
ZHAO Y Y,CAI L M. Statistical methods in algal toxicity test of pesticide[J]. Chinese Journal of Pesticides,2004,43(7):298-299.
[19] OOMEN A G,TOLLS J,KRUIDENIER M,et al. Availability of polychlorinated biphenyls (PCBs) and lindane for uptake by intestinal Caco-2 cells[J]. Environmental Health Perspectives,2001,109(7):731-737.
[20] MENARD A,DROBNE D,JEMEC A. Ecotoxicity of nanosized TiO2: review of in vivo data[J]. Environmental Pollution,2011,59(3):677-684.
[21] 刘东华,蒋悟生,李懋学. 镉对洋葱根生长和细胞分裂的影响[J]. 环境科学学报,1992,12(4):439-446.
LIU D H,JIANG W S,LI M X. The effects of cadmium on the growth and cell division of onion[J]. Acta Science Circumstance,1992,12(4):439-446.
[22] WAGEMANN R,BARICA J. Speciation and rate of loss of copper from lake water with implications to toxicity[J]. Water Research,1979,13(6):515-523.
[23] 陈吟,周建德,鲁蕾,等. 铜、镉联合胁迫对羊角月牙藻的自由基氧化损伤影响研究[J]. 环境污染与防治,2014,36(9):35-40.
CHEN Y,ZHOU J D,LU L,et al. Effects of copper-cadmium combined stress on free oxidative damage ofSelenastrumcapricornutum[J]. Environmental Pollution & Control,2014,36(9):35-40.
[24] 黄昌妙,潘伟斌,李燕,等. 三株溶藻菌对水华鱼腥藻抗氧化酶活性的影响[J]. 环境科技,2009(6):10-13.
HUANG C M,PAN W B,LI Y,et al. Effects of three algicidal bacterial strains on antioxidase activities ofAnabaenaflosaquae[J]. Environmental Science and Technology,2009(6):10-13.
[25] BREMBU T,JØRSTAD M,WINGE P,et al. Genome-wide profiling of responses to cadmium in the diatom phaeodactylum tricornutum[J]. Environmental Science and Technology,2011,45:7640-7647.
Combined Toxicological Effects of Cadmium, Humic Acid and TiO2on Chlorella
LIANG Siyun, KANG Yuan*, ZENG Lixuan, ZHANG Qiuyun, LUO Jiwen
(School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China)
Chlorellawas selected to test the combined toxicological effects of cadmium (Cd), humic acid (HA) and TiO2. The results showed that the 96h-EC50of Cd, Cd-HA and Cd-TiO2was 0.166, 0.185~0.207 and 0.185~0.199 mg/L, respectively, indicating that the toxicity of cadmium was attenuated in the presence of HA or TiO2. This was mainly due to the reduction of free Cd ion through combination of HA and TiO2. However, the 96h-EC50of Cd-HA-TiO2was decreased to 0.063~0.089 mg/L, indicating that the toxicity of cadmium was significantly increased in the presence of HA and TiO2.Chlorellashowed the highest CAT level after exposure to Cd-HA-TiO2compared to other treatments. In addition,the bio-accumulation level of Cd was the highest after exposure to Cd-HA-TiO2. This may explain the highest toxicity observed in the Cd-HA-TiO2exposure group.
Chlorella; combined effect; titanium dioxide; humic acid; cadmium
2016-10-25 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(41301563);广东省科技计划项目(2014A020216036)
*通讯作者:康园,副教授,Email:kangyuan@m.scnu.edu.cn.
X171.5
A
1000-5463(2017)06-0052-08
【中文责编:成文 英文审校:李海航】
