我国辣椒核心种质资源园艺性状多样性的分析和评价
2018-01-11曹亚从张正海张宝玺白锐琴赵园园王立浩
赵 红 曹亚从 张正海 张宝玺 白锐琴 赵园园 王立浩
(中国农业科学院蔬菜花卉研究所,农业部园艺作物生物学与种质创新重点实验室,北京 100081)
辣椒(Capsicumspp.)属于茄科辣椒属一年生或多年生植物(王立浩 等,2012),是一种世界性的重要蔬菜和调味品,果实含有丰富的VC,还是提炼辣椒素和辣椒红素的原料,具有重要的经济价值(Reilly et al.,2001;Khan et al.,2014)。辣椒在我国的年栽培面积约150万hm2,约占我国蔬菜种植面积的10%,对我国蔬菜市场的周年供应具有重要意义(王立浩 等,2016)。
辣椒起源于美洲的热带和亚热带地区(Davenport,2004;Mongkolporn & Taylor,2011),研究认为至少存在4个主要起源中心:① 美国和墨西哥南部至南美西部;② 巴西和委内瑞拉海岸东北部;③ 巴西东海岸;④ 玻利维亚和巴拉圭中部至阿根廷北部和中部。辣椒属目前已经鉴定的种共有35个(Carvalho et al.,2014);1983年国际植物遗传资源委员会将辣椒栽培种划分为5个,分别是一年生辣椒(Capsicum annuumL.)、灌木状辣椒(Capsicum frutescensL.)、中国辣椒(Capsicum chinenseJacq)、 柔 毛 辣 椒(Capsicum pubesensRuiz & Pavon)和下垂辣椒(Capsicum baccatum var.PendulumL.)(IBPGR,1983)。其中一年生辣椒是世界上栽培最广泛、经济价值最高,同时也是育种工作中应用最多的栽培种(Rivera et al.,2016)。据报道这5个辣椒栽培种的驯化是独立的(Andrews,1995),至少存在3个不同的驯化中心(Paran et al.,2007;Pickersgill,2007)。
近年来,国内外学者在辣椒种质表型性状评价与相关性分析方面已开展了一些工作,为辣椒种质资源遗传多样性相关研究奠定了基础(Geleta et al.,2005;Bozokalfa et al.,2009;Thul et al.,2009;蒋向辉 等,2010;许先松 等,2011)。植物的农艺性状指标可以表征种质的特点和相关性状,根据表型差异来反映基因型差异具有重要的意义(李斌 等,2002;李梅 等,2005;詹永发 等,2010;Naegele et al.,2016),因此对种质农艺性状的分析是研究遗传多样性的基础(Lefebvre et al.,2001)。
中国农业科学院蔬菜花卉研究所辣椒课题组前期在对我国1 907份辣椒资源分子标记分析的基础上,建立了我国辣椒核心种质资源(待发表)。本试验通过对331份我国辣椒核心种质资源的43个农艺性状进行多样性评价以及聚类分析,旨在了解辣椒核心种质资源的遗传多样性分布以及亲缘关系,为辣椒种质资源的分子评价、基因深度挖掘及遗传改良提供理论参考。

表1 辣椒种质资源质量性状的描述分组
1 材料与方法
1.1 试验材料
试验所用辣椒材料来源于顾晓振等构建的我国辣椒核心种质(待发表)中根据表型调查确定的249份辣椒材料,根据分子标记分析,代表了我国总体种质资源遗传多样性的75.6%,加上辣椒课题组从国内引进和选育的自交系材料57份以及国外引进材料25份,共331份(表4)。各材料于2016年春定植在中国农业科学院廊坊试验基地的日光温室中,双行定植,每份材料定植8株。
1.2 试验方法
1.2.1 农艺性状调查 参照《辣椒种质资源描述规范和数据标准》(李锡香和张宝玺,2006)进行田间性状调查,调查的农艺性状分为质量性状和数量性状。其中质量性状包括:株型、分枝性、主茎色、茎茸毛、叶形、叶色、叶缘、叶面茸毛、叶面特征、花冠色、花药颜色、花柱颜色、花梗着生状态、花柱长度、青熟果色、老熟果色、果面棱沟、果面特征、果肩形状、果顶形状、果脐附属物、果基部宿存花萼、果形、熟性,共24个性状;数量性状包括:株高、开展度、叶片长、叶片宽、叶柄长、侧枝数、最长侧枝长度、花期、首花节位、商品果纵径、商品果横径、果梗长度、果肉厚、单果质量、单株果数、单株产量、单果种子数、种子千粒重、干物质含量,共19个性状。
1.2.2 试验数据分析 利用SPSS 17.0软件(Kang &Kim,2009)计算质量性状的频率分布和变异系数,数量性状的极大值、极小值、变异幅度、均值、标准差和变异系数。各个性状的Shannon信息指数(Shannon & Weaver,1949)由Bio-dap软件计算得到,其中质量性状的分级标准(表1)参照《辣椒种质资源描述规范和数据标准》和实际调查情况进行;数量性状的分级标准根据各性状数据的平均数(M)和标准差(S)将数据分为10级,从第1级Xi<(M-2S)到第10级Xi≥(M+2S),每0.5S为1级,每一组的相对频率用于计算多样性指数(赵香娜 等,2008)。基于43个植物学性状的聚类分析采用GGT软件计算遗传距离,采用UPGMA(unweighted pair-group method with arithmetic means)的方法在MEGA软件(Tamura et al.,2007)中构建系统进化树。

表2 331份辣椒种质资源质量性状的分布频率与变异系数
2 结果与分析
2.1 辣椒种质资源重要农艺性状的多样性分析
2.1.1 辣椒种质资源质量性状多样性 331份辣椒种质资源质量性状的分布频率和变异情况详见表2。辣椒质量性状的变异系数在13.29%~56.42%之间,Shannon信息指数在0.17~2.41之间。果形的Shannon信息指数最高,为2.41,其变异系数也较高,为47.08%,说明其性状表现形式十分丰富,共有13种,其中长羊角和短羊角的果形所占比例最大,分别为16.9%和14.8%。其次是果肩形状和熟性,Shannon信息指数均为1.27。但是果肩形状的变异系数更大,为50.93%,其中无果肩的频率分布最高,为41.9%。果实熟性主要以早熟和中熟为主,频率分别为47.0%和29.2%。主茎色的Shannon信息指数只有0.17,变异系数也较低,为18.75%;其性状表现主要是绿色,为96.1%。老熟果色以红色为主,所占频率为93.7%,其Shannon信息指数和变异系数也很低,分别为0.25和17.11%。株型以半直立为主,所占频率为57.4%。分枝性以中等为主,所占频率为79.0%。茎茸毛的Shannon信息指数也较高,为1.33,其表现形式以无茸毛和茸毛稀为主,所占频率分别是34.9%和27.4%。叶形以长卵圆为主,所占频率为75.8%。叶色以绿色为主,所占频率为75.9%。叶缘以全缘为主,所占频率为81.6%。叶茸毛表现形式以无茸毛和茸毛稀为主,所占频率分别为39.2%和31.6%。叶面特征以平滑为主,所占频率为73.2%。花冠色以白色为主,所占频率为91.6%。花药颜色以紫色为主,所占频率为72.6%。花柱颜色以白色为主,所占频率为82.5%。花梗着生状态的分布比较平均,下垂、侧生和直立的分布频率分别是33.1%、31.9%和33.7%。青熟果色的性状表现也比较丰富,主要以绿色为主,所占频率为67.8%。果面棱沟以无棱沟为主,所占频率为56.0%。果面特征以微皱为主,所占频率为62.3%。果顶形状以细尖和钝圆为主,所占频率分别为45.2%和35.5%。果脐附属物绝大部分没有,所占频率为88.0%。果基部宿存花萼以平展和下包为主,所占频率分别为43.1%和41.3%。
2.1.2 辣椒种质资源数量性状多样性 从表3可以看出,331份辣椒种质资源数量性状的变异系数范围为16.92%~140.18%,Shannon信息指数为1.48~2.08。Shannon信息指数最大的3个性状依次是:株高、开展度以及叶柄长,但它们的变异系数都较小。同时,变异系数最大的两个性状单果质量和最长侧枝长度的Shannon信息指数却是最小的,只有1.48。商品果横径、果肉厚、单果种子数、单株果数以及单株产量的变异系数均超过了50%,Shannon信息指数也较高,在1.69~2.01之间。这说明辣椒资源果实的性状表现变异十分丰富。
辣椒种质资源数量性状的分布情况如图1所示,其符合正态分布的性状有:开展度、叶片长、果梗长度、单果种子数、果肉厚、单果质量以及干物质含量。
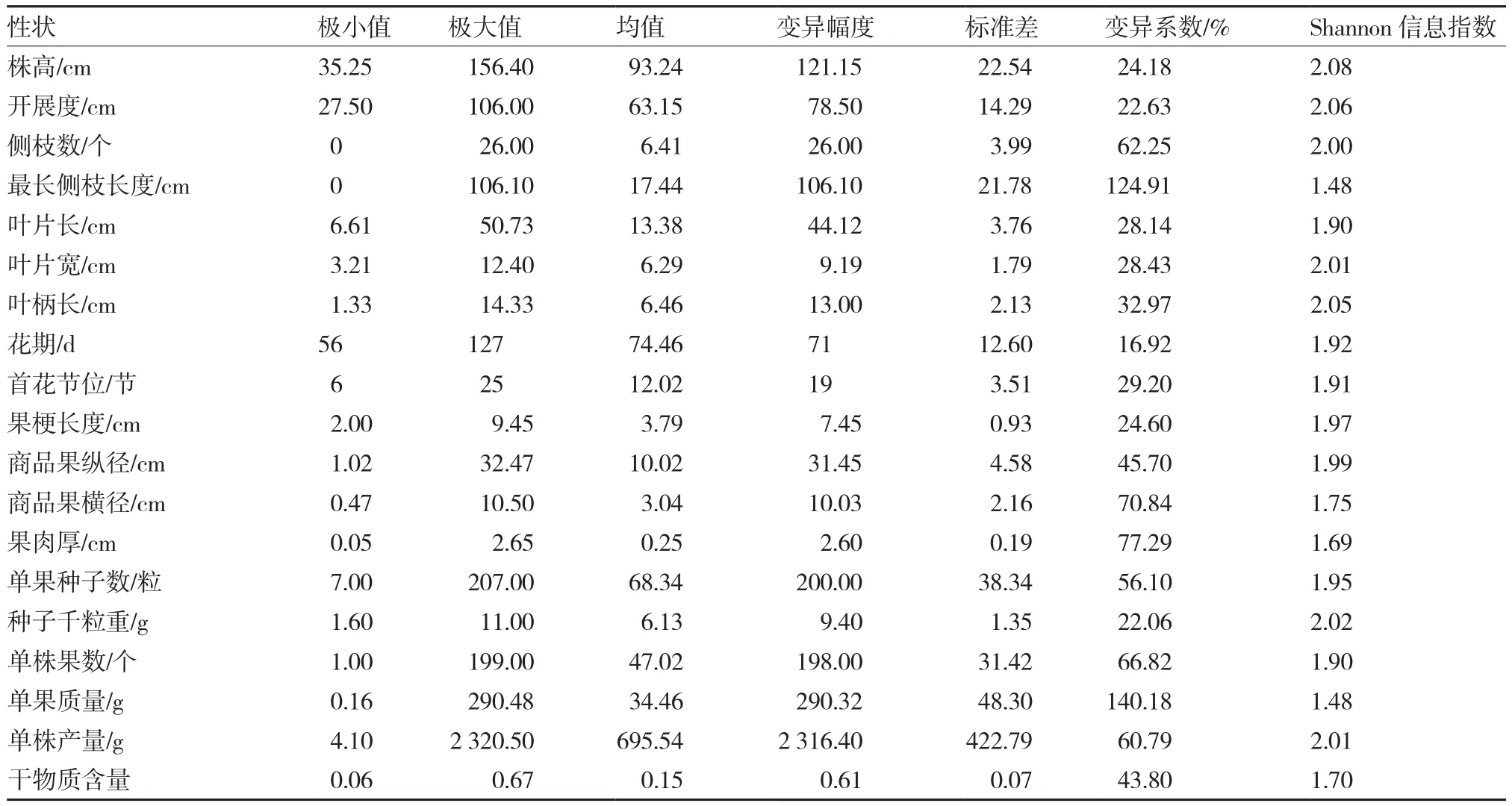
表3 辣椒种质资源数量性状的描述及变异系数

图1 331份辣椒种质资源数量性状的分布检验
2.2 辣椒种质资源重要农艺性状的聚类分析
基于43个农艺性状对331份辣椒种质资源进行聚类(图2),在遗传距离为0.35时被分为两大类(表4)。
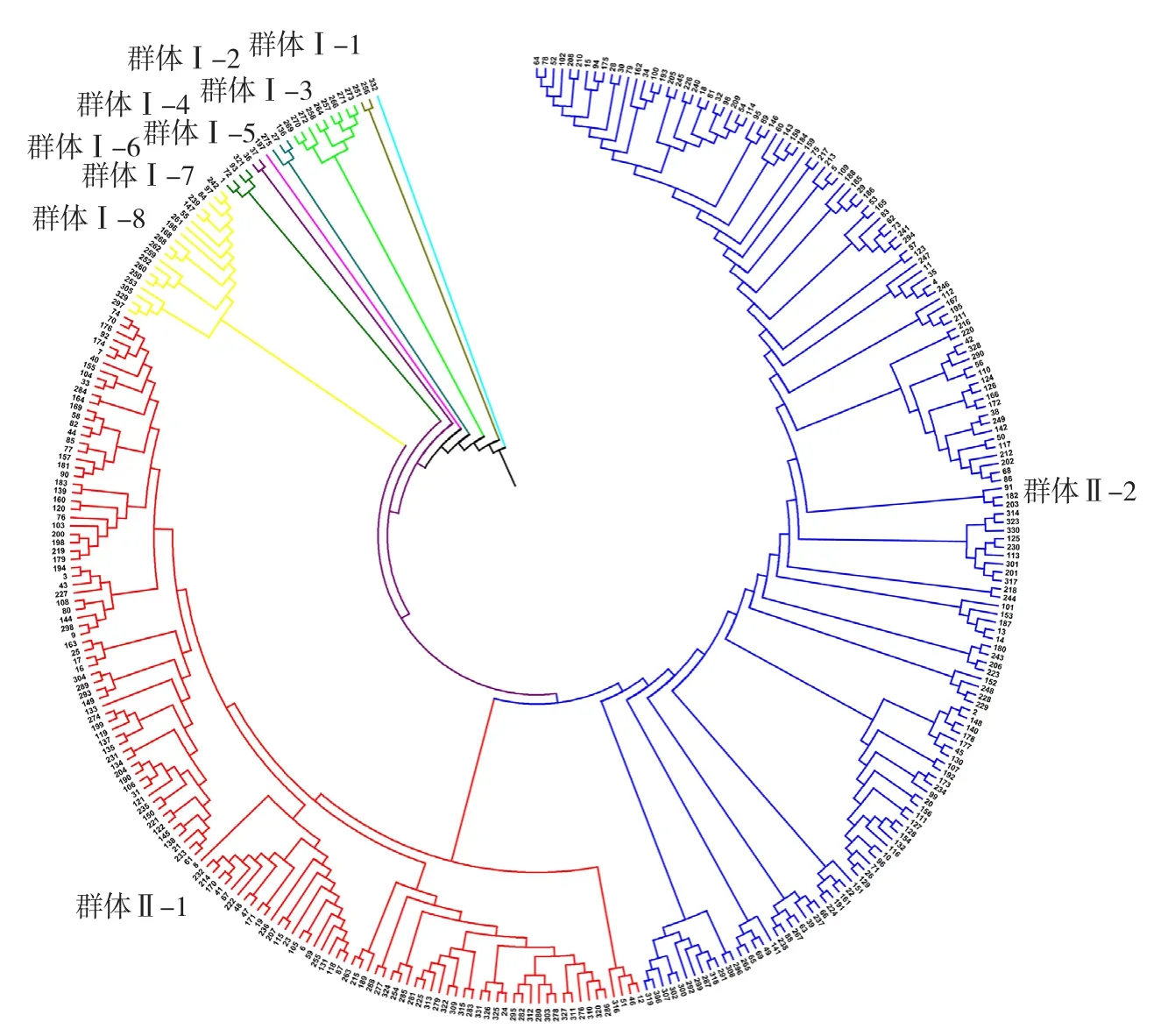
图2 331份辣椒种质资源的聚类分析

表4 331份辣椒种质资源的信息及分类
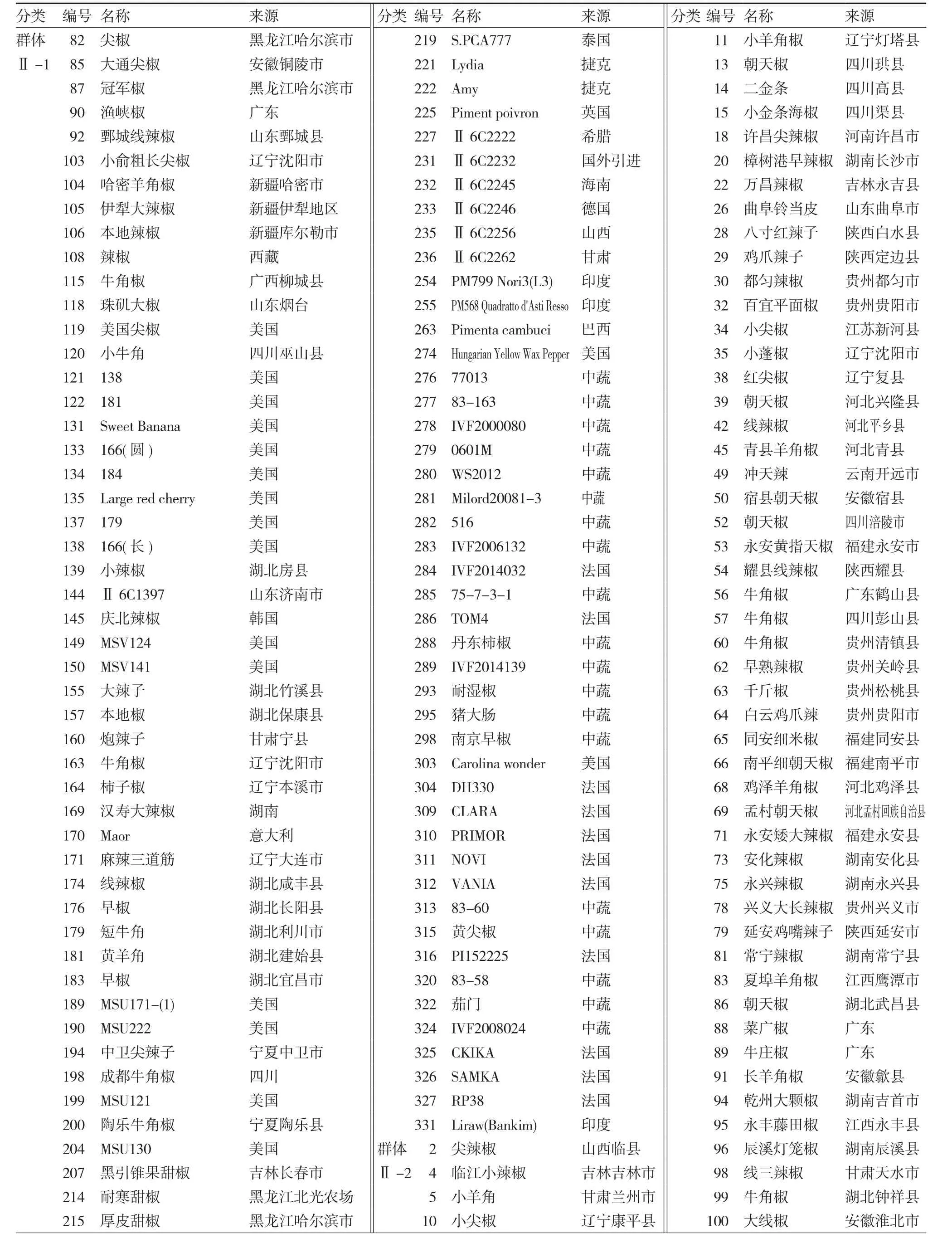
续表
群体Ⅰ共有40份材料,其中种间材料27份,一年生辣椒13份。其植物学性状表现丰富,比如花冠色有白色、紫色、浅绿色以及白色带绿色斑点;青熟果色有绿色、紫色等;果形小,果肉薄,果实成熟期一般极晚;辣椒素含量很高。根据各个材料不同性状表现可以把群体Ⅰ细分为8个群体。群体Ⅰ-1包含1份材料,是海南黄灯笼椒,属于中国辣椒(C. chinenseJacq)。其特点是老熟果色为黄色,果面皱缩,辣椒素含量高。群体Ⅰ-2含有2份材料,均是绒毛辣椒(C. pubesensRuiz & Pavon)。茎和叶面茸毛茂密,花冠颜色、花药颜色以及花柱颜色均为紫色,花柱短于雄蕊,单节叶腋着生1~2朵花,花梗直立生长,果实成熟期极晚,并且种子种皮色为黑色。群体 Ⅰ-3含有9份材料,其中5份属于中国辣椒(C. chinenseJacq),其余4份属于下垂辣椒(C.baccatumvar.pendulumL.)。花冠颜色各异,有白色、浅绿色以及白色带褐色斑点;花梗直立生长;果形小,果肉薄;青熟果色为黄绿色或浅绿色,老熟果色为黄、橘红以及红色;果实成熟期极晚;辣味极重。群体 Ⅰ-4包含3份材料,均为一年生辣椒(C.annuumL.),成熟期早,单株果数多,果形为长羊角形,果大,单果种子数多,有辣味。群体 Ⅰ-5只有1份材料,是引自韩国的紫叶小辣椒。植株高大,主茎色为绿色带紫色条纹;花冠颜色、花药颜色以及花柱颜色均为紫色;单果质量小,青熟果为紫色;辣味轻。群体 Ⅰ-6包含2份材料,均来自辽宁省。花冠颜色为白色,花药颜色为蓝色;果肉薄、果实大、单产高,果实成熟期适中。群体 Ⅰ-7包含4份材料,均为一年生辣椒(C. annuumL.)。分枝性弱,果基部宿存萼片平展。群体 Ⅰ-8包含18份材料,其中11份为灌木状辣椒(C. frutescensL.),占61.1%。植株高大,分枝性中弱,叶片颜色为浅绿色;花冠色多为浅绿色,花药为紫色,单节叶腋着生1~3朵花;果实成熟期极晚,果形多为短羊角形,果肉薄,果基部宿存萼片形态为下包,辣味重。

续表
群体Ⅱ共有291份材料,绝大多数为一年生辣椒(C. annuumL.),3份中国辣椒(C.chinenseJacq)和1份下垂辣椒(C. baccatumvar. pendulumL.),其植物学性状主要表现为中度分枝性,主茎色为绿色,花冠颜色为白色,花药颜色多数为紫色;花梗着生状态有下垂、直立和侧生;青熟果颜色各异,有黄白、黄绿、浅绿、绿、深绿、紫色;果实熟性多为早熟和中熟。根据各个材料的不同植物学性状表现又可以将群体Ⅱ分为两个群体。群体Ⅱ-1包含127份材料。果形多样,其中灯笼椒占49.5%,羊角椒占22.1%;果形较大,单果质量大,单产高;果基部宿存萼片形态多为平展;绝大多数果实无辣味。群体 Ⅱ-2包含164份材料。植株较高,叶形多为长卵圆形(81.8%);果形多为羊角形和指形,所占比例为90.5%;果脐多细尖,无果肩,果肉薄,单果质量轻;果基部宿存萼片形态多为下包;果实熟性多为早熟,并且95.2%的果实有辣味。
3 结论与讨论
3.1 辣椒种质资源重要农艺性状的多样性
辣椒种质资源质量性状的Shannon信息指数较大的依次为果形、茎茸毛、果肩形状、熟性,其变异系数也较大。其中果形、果肩形状以及熟性都与果实有关,说明果实的变异十分丰富。Shannon信息指数较低的有主茎色、老熟果色和果脐附属物,其变异系数也较小,说明它们的遗传较稳定。花柱颜色的变异系数是最大的,但是其Shannon信息指数却很小,说明Shannon信息指数和变异系数并不是呈正相关的。数量性状Shannon信息指数最大的3个性状依次是:株高、开展度以及叶柄长;商品果横径、果肉厚、单果种子数、单株果数以及单株产量的变异系数均超过了50%。与质量性状的变异相比,数量性状的变异较大,遗传资源较丰富;而质量性状的遗传较稳定,这与詹永发等(2008)、李宁等(2015)对辣椒资源多样性的研究结果一致。但本试验中株高、商品果横径、单果种子数以及种子千粒重的多样性高于詹永发等(2008)的研究结果;在果形、花梗着生状态、首花节位等11个性状的多样性高于李宁等(2015)的研究结果。本试验结果表明,我国辣椒核心种质资源植物学性状表现丰富,涵盖变异类型广,具有很高的育种价值。
3.2 辣椒种质资源植物学性状的聚类与分类学比较
辣椒一年生栽培种的性状表现相对单一,遗传背景较为狭窄,多样性指数低;而其余4个栽培种以及野生种材料的植物学性状表现十分丰富,遗传多样性较高,比如花冠色涵盖白、浅绿、紫色以及白色带褐色斑点。依据辣椒植物学性状的聚类分析结果基本可以将试验材料按照材料来源以及所属种区分为两大群体,各群体间性状表现差异明显,群体Ⅰ的遗传多样性远远高于群体Ⅱ,其中群体Ⅰ大部分为除一年生栽培种之外的其他辣椒种,群体Ⅱ中绝大多数为一年生栽培种。这与夏碧波等(2017)对30份国外引进辣椒资源的形态学聚类分析结果一致。从聚类分析结果可以看出,一年生辣椒、中国辣椒以及灌木状辣椒三者间的亲缘关系更为相近,这一结论覃成等(2015)也曾提到过。聚类结果并没有完全将同一种的材料聚类到一起,比如265号和267号(C. chinenseJacq)和一年生辣椒归为一类,原因可能是在系统聚类时没有将植物学性状表现的主次区分或者由于栽培环境的影响使其性状发生改变,以及某些材料部分性状数据的缺失等等。
种质资源的遗传多样性是育种工作的基础,而对种质资源遗传多样性的研究可以挖掘出优异资源,从而为育种者提供重要信息。本试验采用表型调查的方法,具有简单、方便、直观的特点,但是在深度挖掘种质的优异基因方面有所欠缺,因此在后续的工作中有必要将农艺性状调查与分子标记结合起来,更加精准地把握辣椒种质资源中的优异性状,进一步为育种工作提供有力信息。
蒋向辉,佘朝文,许栋,张青桦,赵旺.2010.应用形态学与RAPD标记对朝天椒遗传多样性的分析.西南农业学报,23(3):810-813.
李斌,顾万春,卢宝明.2002.白皮松天然群体种实性状表型多样性研究.生物多样性,10(2):181-188.
李梅,韩海荣,康峰峰.2005.辽东栎天然群体表型多样性研究.北京林业大学学报,27(5):10-16.
李宁,王飞,姚明华,焦春海,尹延旭.2015.国内外辣椒种质资源表型性状多样性及相关性分析.辣椒杂志,(1):8-13.
李锡香,张宝玺.2006.辣椒种质资源描述规范和数据标准.北京:中国农业出版社:66-75.
覃成,程蛟文,吴智明,罗希榕,胡开林.2015.辣椒基因组学的研究进展.农业生物技术学报,23(7):953-966.
王立浩,毛胜利,张正海,张宝玺.2012.辣椒分子遗传育种研究进展.辣椒杂志,(1):1-9.
王立浩,张正海,曹亚从,张宝玺.2016.“十二五”我国辣椒遗传育种研究进展及其展望.中国蔬菜,(1):1-7.
夏碧波,李颖,王恒明,李涛,徐小万,吴智明.2017.国外引进辣椒资源形态学性状的聚类分析.分子植物育种,15(8):3318-3330.
许先松,刘志钦,林晓丹,牟少亮,官德义,何水林.2011.基于形态及SRAP标记的辣椒资源遗传多样性及亲缘关系比较.福建农林大学学报:自然科学版,40(1):48-53.
詹永发,姜虹,韩世玉,杨红,刘崇政,赖卫.2008.朝天椒种质材料的遗传多样性研究.贵州农业科学,36(4):8-10.
詹永发,杨红,涂祥敏,刘崇政,田应书.2010.辣椒品种资源的遗传多样性和聚类分析.贵州农业科学,38(11):12-15.
赵香娜,李桂英,刘洋,陆平,顿宝庆,岳美琪,张璞.2008.国内外甜高粱种质资源主要性状遗传多样性及相关性分析.植物遗传资源学报,9(3):302-307.
Andrews J.1995.Peppers:The Domesticated Capsicums.Austin:University of Texas Press.
Bozokalfa M K,Esiyok D,Turhan K.2009.Patterns of phenotypic variation in a germplasm collection of pepper(Capsicum annuumL.)from Turkey.Spanish Journal of Agricultural Research,7(1):83-95.
Carvalho S I C,Ragassi C F,Bianchetti L B,Reifschneider F J B,Buso G S C,Faleiro F G.2014.Morphological and genetic relationships between wild and domesticated forms of peppers(Capsicum frutescensL. andC.chinenseJacquin).Genetics and Molecular Research,13(3):7447-7464.
Davenport L J.2004.Genera Solanacearum:The genera of Solanaceae illustrated,arranged according to a new system by Armando T.Hunziker.Systematic Botany,29(1):221-222.
Geleta L F,Labuschagne M T,Viljoen C D.2005.Genetic variability in pepper(Capsicum annuumL.)estimated by morphological data and amplified fragment length polymorphism markers.Biodiversity and Conservation,14(10):2361-2375.
IBPGR.1983.Genetic resources ofCapsicum:a global plan of action.Rome:IBPGR Secretariat.
Kang B S,Kim K S.2009.SPSS 17.0:Statistical analysis of the social sciences.Seoul:Hannarae Academy.
Khan F A,Mahmood T,Ali M,Saeed A,Maalik A.2014.Pharmacological importance of an ethnobotanical plant:Capsicum annuumL.Natural Product Research,28(16):1267-1274.
Lefebvre V,Goffinet B,Chauvet J C,Caromel B,Signoret P,Brand R,Palloix A.2001.Evaluation of genetic distances between pepper inbred lines for cultivar protection purposes:comparison of AFLP,RAPD and phenotypic data.Theoretical Applied Genetics,102(5):741-750.
Mongkolporn O,Taylor P W J.2011.‘Capsicum’ Wild Crop Relatives:Genomic and Breeding Resources.Berlin:Springer-Verlag:43-57.
Naegele R P,Mitchell J,Hausbeck M K.2016.Genetic diversity,population structure,and heritability of fruit traits inCapsicum annuum.PLoS One,11(7):e0156969.
Paran I,Ben-Chaim A,Kang B C,Jahn M.2007.Capsicums.Vegetables.Berlin:Springer-Verlag:209-226.
Pickersgill B.2007.Domestication of plants in the Americas:insights from Mendelian and molecular genetics.Annals of Botany,100(5):925-940.
Reilly C A,Crouch D J,Yost G S,Fatah A A.2001.Determination of capsaicin,dihydrocapsaicin,and nonivamide in self-defense weapons by liquid chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry.Journal of Chromatography A,912(2):259-267.
Rivera A,Monteagudo A B,Igartua E,Taboada A,Gar cí a-Ulloa A,Pomar F,Silvar C.2016.Assessing genetic and phenotypic diversity in pepper(Capsicum annuumL.)landraces from North-West Spain.Scientia Horticulturae,203:1-11.
Shannon C E,Weaver W.1949.The Mathematical Theory of Communication.Urbana,Illinois:University of Illinois:117.
Tamura K,Dudley J,Nei M,Kumar S.2007.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0.Molecular Biology and Evolution,24(8):1596-1599.
Thul S T,Lal R K,Shasany A K,Darokar M P,Gupta A K,Gupta M M,Khanuja S P S.2009.Estimation of phenotypic divergence in a collection of Capsicum species for yield-related traits.Euphytica,168(2):189-196.
