SrO改性SiO2-B2O3-CaO-P2O5系生物玻璃的制备及体外生物活性研究
2018-01-11殷海荣郭宏伟李明阳
殷海荣, 杨 晨, 郭宏伟, 童 强, 高 杨, 李明阳
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
随着社会的发展和饮食结构的改变,骨缺损成为生活中的常见病和多发病,它使患者遭受身心痛苦,甚至导致残疾[1].目前,关于骨缺损修复的研究方向主要集中在骨缺损修复材料的选择上[2].从修复质量、免疫排斥和疾病传播等多方面来衡量,自体骨都是最佳的选择.但由于供骨量有限,取骨又会造成二次手术的创伤,因此它的临床应用受到了很大的限制[3].通过开发新的骨修复材料帮助患者修复受损的骨骼是生物医学材料学界多年来一直在探索并试图解决的重要问题[4].骨的仿生制备来源于骨组织工程,选择合适的支架材料是骨组织工程所要解决的关键问题[5].
生物活性玻璃是20世纪70年代初由美国佛罗里达大学Larry L Hench教授等人发明的可降解生物材料,他们在研究中发现将组分为SiO2-Na2O3-CaO-P2O5的玻璃材料植入生物体内后,玻璃材料中的组分可以同生物体内的组分互相交换或者反应,形成牢固的化学键结合,最终生成与生物体本身相容的物质,构成新生骨骼的一部分[6].越来越多的研究发现,来自无机材料的离子溶解是改善这些材料性能的关键[7-9].硼普遍存在于蔬果中,是维持骨的健康和钙、磷、镁正常代谢所需要的微量元素之一.以硼为基础的生物玻璃与硅酸盐生物玻璃相比,有更好的可塑性和生物降解性.然而硼离子的快速释放可能会产生细胞毒性是必须考虑的问题之一[10].
相关研究发现,根据玻璃结构的“混合碱效应”,玻璃中锶和硼的协同作用可以改善某些离子的释放速率[11],因此本文在SiO2-B2O3-CaO-P2O5系生物玻璃配方的基础上,添加0~9 mol%的SrO,采用聚合物泡沫模板法制备生物玻璃支架材料,并探究其体外生物活性,以提高SiO2-B2O3-CaO-P2O5系生物玻璃的应用范围.
1 实验部分
1.1 样品制备
本文所用的SiO2-B2O3-CaO-P2O5系生物玻璃配方如表1中的S0所示,在此配方的基础上添加0~9 mol %的SrO分别记做S1、S2、S3.
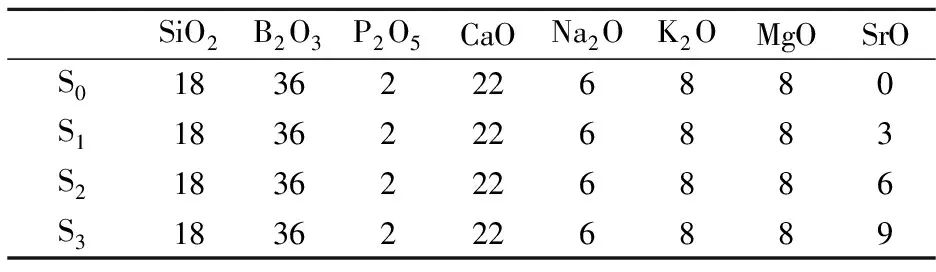
表1 SiO2-B2O3-CaO-P2O5系生物玻璃组成(mol%)
本实验所用的原料均为分析纯,根据表1的组成,准确称取原料并进行混合,在1 200 ℃下将混合好的配合料加入铂金坩埚中,保温3 h后,把融化好的玻璃液浇入去离子水中,得到1~2 mm大小的玻璃颗粒.将得到的玻璃颗粒烘干,然后放入球磨罐中,以乙醇作为溶剂,氧化锆球石作为研磨介质球磨5 h,得到直径在1μm左右的玻璃粉体.
本文采用聚合物泡沫模板法制备生物玻璃支架[12].将研磨好的玻璃粉体按照体积比2∶3的比例加入到乙醇中,再加入玻璃粉体质量5%的羧甲基纤维素作为悬浮剂,在磁力搅拌器下搅拌至均匀的浆体.把切割成1 cm×1 cm×1 cm的聚氨酯泡沫浸入浆体中,并反复按压几次,直至聚氨酯泡沫完全被浆体浸润.接着将其在室温下放置6 h充分干燥,把干燥好的聚氨酯泡沫放在马弗炉里进行烧结,即得到生物玻璃支架材料.
1.2 测试与表征
采用德国NETZSCH STA449 F3型热分析仪,进行差示扫描热分析(DSC),温度范围为30 ℃~900 ℃,升温速率5 ℃/min;采用HITACH FE-SEM S4800型扫描电子显微镜(SEM)观察样品的微观结构及表面形貌;样品的气孔率采用阿基米德法测定,样品的抗弯强度采用万能材料试验机测定;采用德国Bruker VERTEX70型傅里叶变换红外光谱仪(FTIR)对样品结构分析;将样品在模拟体液(SBF)中浸泡不同的天数,然后测定其晶相、微观形貌以及Ca离子和B离子的溶出速率来表征其体外生物活性;其中样品的晶相结构采用D/max 2200PC型X射线衍射仪(XRD)分析,Cu Kα1特征X射线,2θ范围为10 °~70 °;离子溶出速率采用美国THEM公司的电感耦合等离子发射光谱仪(ICP)来测定.
2 结果与讨论
2.1 差热分析
图1为玻璃粉体的DSC曲线图.从图1可以看出,DSC曲线上有明显的吸热峰和放热峰,100 ℃附近出现微小的吸热峰,这是由于玻璃中的吸附水蒸发造成的.而DSC曲线在500 ℃左右出现明显的拐点,基线向吸热方向移动,所以玻璃态转变点为500 ℃.592 ℃和742 ℃为玻璃的析晶起始温度,709 ℃和790 ℃为玻璃的析晶峰值温度.而生物玻璃支架的制备只需要将玻璃粉体烧结达到致密化,所以烧结温度范围为500 ℃~592 ℃[13].根据前期实验,以530 ℃作为生物玻璃烧结温度,其烧结制度为:2 ℃/min从室温缓慢升温到400 ℃,使聚氨酯泡沫充分分解(聚氨酯泡沫的分解温度为300 ℃).以5 ℃/min从400 ℃升温到530 ℃并保温2 h,使生物玻璃充分烧结并致密化.

图1 玻璃粉体的DSC曲线图
2.2 生物玻璃形貌分析
S2样品的扫描电镜照片如图2所示.从图2(a)可以看出,聚氨酯泡沫是具有规则空隙的多孔材料,其形貌和人体松质骨非常接近,孔径大小在300~500μm之间.图2(b)为500μm下S2样品的扫描电镜图,其形貌和聚氨酯泡沫相似,孔隙规则,连通性很好,孔径大小在300~500μm之间.图2(c)为在100μm下S2样品表面的微观形貌,其表面光滑平整.图2(d)为S2样品在37 ℃的SBF溶液中浸泡一周之后的微观形貌,可以发现在S2样品的表面出现大量的颗粒状的晶体,通过后期XRD测试,该种晶体为羟基磷灰石(HA).HA为人体骨骼的重要组分,生物玻璃在人体内转化为HA的能力是其生物活性的重要标志,所以SrO掺杂的SiO2-B2O3-CaO-P2O5系生物玻璃支架具有良好的生物活性.

(a)聚氨酯泡沫 (b)、(c)未经处理的S2样品 (d)S2样品在37 ℃的SBF溶液中浸泡一周图2 样品的扫描照片
人体松质骨的气孔率在60%~90%,抗压强度在2~12 MPa.较高的气孔率有助于细胞的粘附和增殖,但是在提高气孔率的同时往往会降低生物玻璃材料的抗压强度.好的生物玻璃支架材料在满足气孔率的同时也应该具有足够的抗压强度,因为这样才能保证新生骨在取代支架材料时其可以保持基本结构不改变.
不同SrO含量的SiO2-B2O3-CaO-P2O5系生物玻璃样品的气孔率和抗压强度如表2所示.从表2可以看出,所制备的生物玻璃样品气孔率在85%左右,抗压强度均大于11 MPa.随着SrO取代CaO的增加,生物玻璃支架的气孔率无明显变化趋势,而抗压强度略微增大.所以采用聚合物泡沫模板法制备的生物玻璃可以满足骨组织工程支架材料的要求.
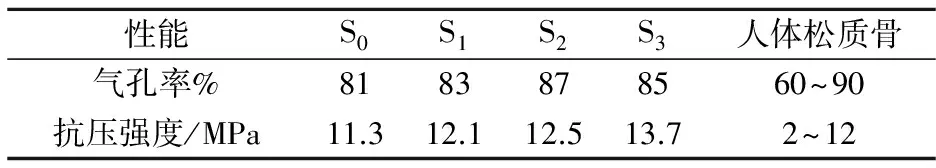
表2 不同SrO含量生物玻璃的气孔率和抗压强度
2.3 生物玻璃的红外光谱分析
不同SrO掺杂SiO2-B2O3-CaO-P2O5系生物玻璃支架的傅里叶红外光谱如图3所示.从图3可以发现,样品在1 065 cm-1和479 cm-1均出现明显的吸收峰,这两个峰对应的分别为P-O-Si键的伸缩震动和Si-O键的弯曲震动.而570 cm-1出现的吸收峰是由于[PO4]中P-O的弯曲震动所产生的.在720 cm-1和1 430 cm-1出现的吸收峰分别与B-O键和C-O的伸缩震动有关.
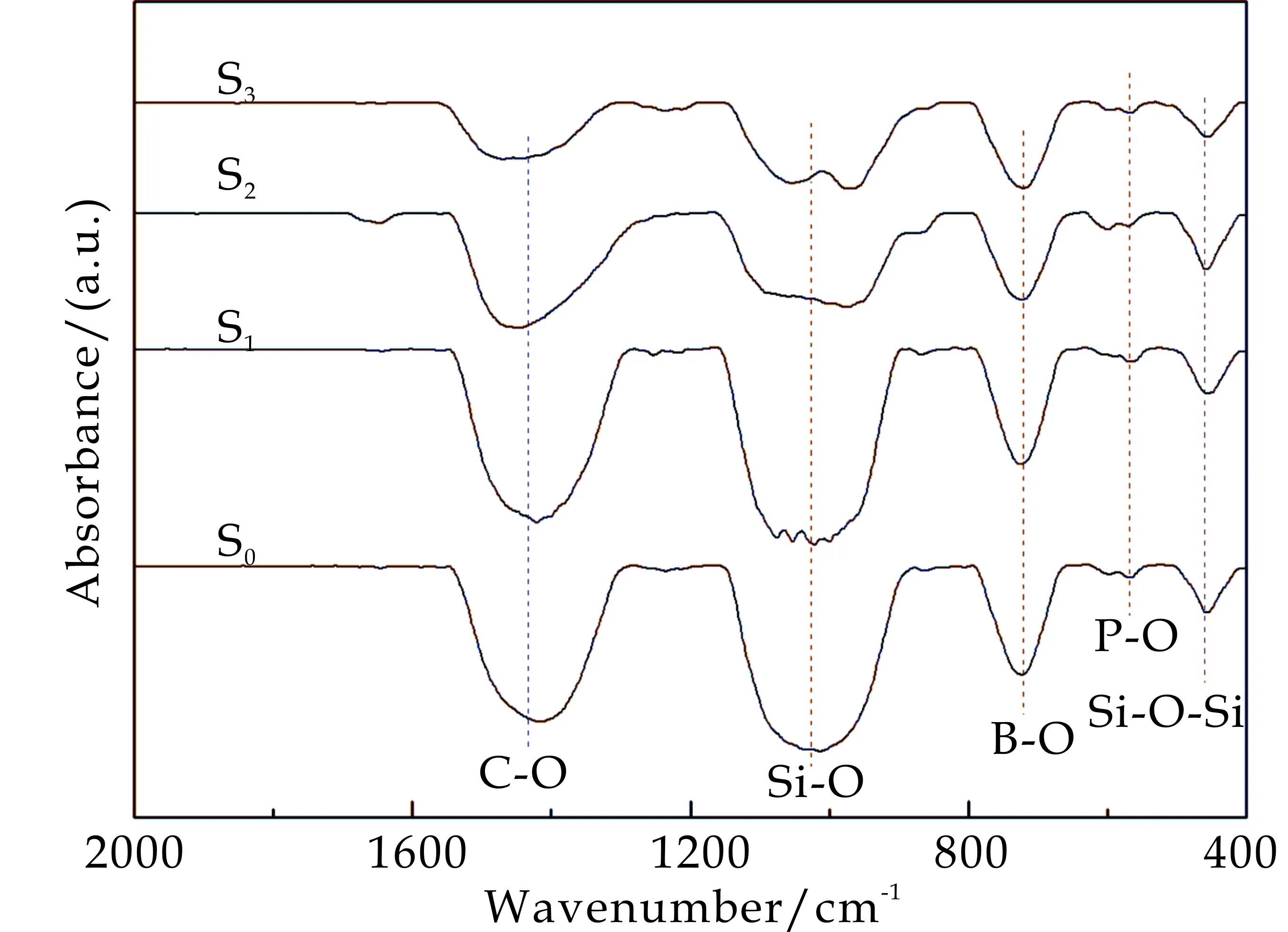
图3 不同SrO含量SiO2-B2O3-CaO-P2O5生物玻璃样品的红外光谱图
通过S0和S1、S2、S3样品的对比发现,1 050~1 100 cm-1范围内Si-O的特征峰在逐渐减弱,当Sr添加量达到9 mol%时,1 065 cm-1处的特征峰分成了1 088 cm-1和986 cm-1两个部分.这可能是由于Sr与Ca相比其原子半径较大(Sr原子半径为1.16 Å,Ca原子半径为1.00 Å),随着玻璃支架中Sr替换Ca,使得玻璃网络结构变大,破坏了部分Si-O键[14].而1 430 cm-1和720 cm-1波长处的C-O键和B-O键的强度却没有发生明显变化.
2.4 生物玻璃的体外生物活性
生物玻璃的体外生物活性是指在人体液中表面发生一系列反应,最后在表面形成一层与人体骨骼无机相相似的羟基磷灰石(HA)并与人体硬或软组织如胶原蛋白和细胞紧密联结的能力.生物玻璃中的离子溶出速率与其和细胞键和的能力密切相关[15].通过在SBF溶液中浸泡可以检测材料的体外生物活性,相关研究发现这样获得的体外生物活性和体内生物活性有着密切的关联.
未经处理的S2样品以及S2样品在SBF溶液中浸泡一周之后的XRD图谱如图4所示.从图4可以看出,未经处理的样品为非晶态材料,其XRD图谱无明显的衍射峰.当样品在37 ℃的SBF溶液中浸泡一周之后,样品的XRD图谱出现明显的衍射峰,对比PDF标准卡片,析出晶体为HA,表明其生物活性较好.
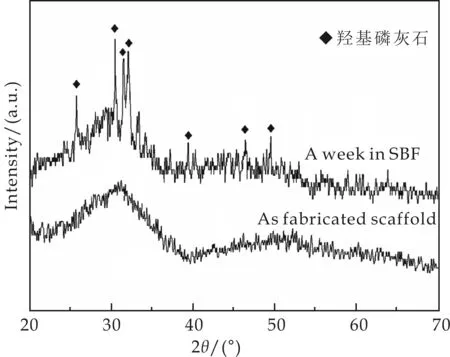
图4 未经处理的S2样品以及其在SBF溶液中浸泡一周之后的XRD图谱
将不同SrO含量的生物玻璃样品在37 ℃的SBF溶液中分别浸泡1、3、8、15、20天,溶液中Ca离子的浓度随浸泡时间的变化趋势如图5所示.从图5可以看出,随着浸泡时间的延长,Ca离子浓度在不断增大,而在第15天开始Ca离子浓度开始趋于稳定.且随着SrO含量的增加,同一时间点Ca离子浓度也在逐渐增大.生物玻璃中Ca离子释放速率与HA的形成速率有关,这也表明SrO掺杂可以促进SiO2-B2O3-CaO-P2O5系生物玻璃HA形成,提高其生物活性[16].
生物玻璃样品在SBF溶液中随着浸泡时间延长,B离子的浓度变化曲线如图6所示.从图6可以看出,B离子浓度的变化趋势和Ca离子浓度的变化趋势一致:在前8天B离子浓度在逐渐增大,8~15天之间增长变得缓慢,并在15天以后趋于稳定.而同一时间点,B离子浓度随着SrO含量的增加在逐渐减小.Fu等[17]发现B离子浓度大于0.65 mm时会抑制细胞的增殖.从图6可以看出,在第20天时S0样品中B离子浓度接近700 ppm,而加入SrO后B离子浓度在逐渐降低,当Sr添加量达到6 mol%时,B离子浓度在20天时稳定在450 ppm.所以SrO掺杂SiO2-B2O3-CaO-P2O5系生物玻璃能够在一定程度抑制B离子的快速释放,提高其生物活性.

图5 不同SrO含量样品在SBF溶液中Ca离子浓度变化曲线
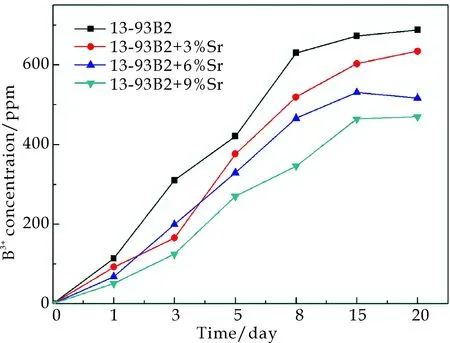
图6 不同SrO含量样品在SBF溶液中B离子浓度变化曲线
3 结论
(1)采用聚合物泡沫模板法制备了SiO2-B2O3-CaO-P2O5系生物玻璃,并添加0~9 mol%的SrO,该体系生物玻璃的烧结温度在530 ℃,气孔率在85%左右,抗压强度在12 MPa左右.
(2)随着SrO含量的增加,玻璃结构中Si-O键在逐渐减弱,而C-O键和B-O键的强度无明显变化.
(3)在SBF溶液中随着浸泡时间延长Ca离子和B离子的释放浓度均先增加后趋于稳定,随着SrO含量增加,同一时间点Ca离子的浓度在逐渐增大,而B离子浓度在逐渐减小,其生物活性变好.
[1] M N Rahaman,D E Day,B S Bal,et al.Bioactive glass in tissue engineering[J].Acta Biomaterialia,2011,7(6):2 355-2 373.
[2] Juliane Isaac,Sabine Loty,Ahmad Hamdan,et al.Bone-like tissue formation on a biomimetic titanium surface in an explant model of osteoconduction[J].Journal of Biomedical Materials Research Part A,2009,89A(3):585-593.
[3] C A Vacanti,J P Vacanti.Bone and cartilage reconstruction with tissue engineering approaches[J].Otolaryngologic Clinics of North America,1994,27(1):263-276.
[4] L L Hench.Biomaterials:A forecast for the future[J].Biomaterials,1998,19(16):1 419-1 421.
[5] Crane G M,Ishaug S L,Mikos A G.Bone tissue engineering[J].Nature Medicine,1995,12(1):1 322-1 324.
[6] Matthew D,O′ Donnell.Predicting bioactive glass properties from the molecular chemical composition:Glass transition temperature[J].Acta Biomaterialia,2011,7(5):2 264-2 269.
[7] P D Saltman,L G Strause.The role of trace minerals in osteoporosis[J].Journal of the American College of Nutrition,1993,12(4):384-389.
[8] J H Beattie,A Avenell.Trace element nutrition and bone metabolism[J].Nutrition Research Reviews,1992,5(1):167-188.
[9] F H Nielsen.New essential trace elements for the life sciences[J].Biological Trace Element Research,1990,26-27(1):599-611.
[10] T Uysal,A Ustdal,M F Sonmez,et al.Stimulation of bone formation by dietary boron in an orthopedically expanded suture in rabbits[J].Angle Orthodontist,2009,79(5):984-990.
[11] H B Pan,X L Zhao,X Zhang,et al.Strontium borate glass:Potential biomaterial for bone regeneration[J].Journal of the Royal Society Interface,2010,48(7):1 025-1 031.
[12] Q Fu,M N Rahaman,B S Bal,et al.Mechanical and in vitro performance of 13-93 bioactive glass scaffolds prepared by a polymer foam replication technique[J].Acta Biomaterialia,2008,6(4):1 854-1 860.
[13] Varshneya A K,Tomozawa M.Fundamentals of inorganic glasses[J].Journal of Non Crystalline Solids,1994,170(1):112.
[14] Kokubo T.Apatite formation on surfaces of ceramics, metals and polymers in body environment[J].Acta Materialia,1998,46(7):2 519-2 527.
[15] Dziadek M,Zagrajczuk B,Menaszek E,et al.Gel-derived SiO2-CaO-P2O5bioactive glasses and glass-ceramics modified by SrO addition[J].Ceramics International,2016,42(5):5 842-5 857.
[16] 赵寅生,张 欣,向卫东,等.含锶硼硅酸盐生物玻璃的降解性能及体外生物活性[J].功能材料,2010,41(3):439-442.
[17] Hailuo Fu,Qiang Fu,Nai Zhou,et al.In vitro evaluation of borate-based bioactive glass scaffolds prepared by a polymer foam replication method[J].Materials Science & Engineering C,2009,29(7):2 275-2 281.
