羊乳及其制品中掺入牛乳成分的双重PCR检测
2018-01-11宋宏新刘建兰徐秦峰
宋宏新, 刘建兰, 徐秦峰
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
国际药典委员会的食品化学法典(CAC)调查报告报道,1980年至2010年,由经济利益驱使的25个最容易掺假的食品成分中,其中乳成分掺假在学术领域排名第二,在媒体报道排名第七,可见乳类掺假检测的重要性[1].羊乳因其独特的风味和营养价值而被多数消费者青睐,由于羊乳的泌乳期受季节性的波动影响较大,使得产奶量不如牛乳,且价格高于牛乳,故掺假现象时有发生,以此来获取利益[2,3].
由于常见乳品成分及形态的相似性大,有关乳物种鉴定一直是一个亟待解决的问题.常见的乳物种鉴定的检测技术有基于乳中高含量的蛋白质的方法,如免疫学[2]和电泳的检测技术,免疫学灵敏度较高但易发生假阳性且抗体保存性不足.电泳分为聚丙烯酰氨凝胶电泳(PAGE)[4]、毛细管电泳(CE)[5]和双向电泳[6],在欧盟电泳是一种广泛的有效的牛乳检测手段,但是,基于蛋白质的方法不适于复杂母体来源的食品,因为很容易受热处理材料的影响而使得灵敏度降低[7].利用乳的一些特性,如外表、风味、质构的感官分析法近年来也悄然兴起[8],但易随加工变化而挥发,加工损失较严重;常用的液相(HPLC)[9]、气相(GC)[10]色谱检测方法和红外(IR)[11]、近红外(NIR)[12]及核磁共振技术(NMR)[13]等光谱检测方法,其中液相和气相费时费力、需要复杂的样品前处理,光谱技术几乎无需对样品预处理且其适合在线过程控制,但光谱需要建立复杂的模型,掌握和普及程度不足且仪器昂贵.
基于DNA的PCR技术,因其在高温高压下可以稳定存在的特点[14]而在食品掺假领域悄然兴起,并已经广泛应用于食品掺假的验证和证明[15].在乳制品中DNA之所以可以作为掺假的检测目标是由于DNA在高温、高压和化学处理的条件下依然稳定存在[16].据报道,反刍动物的乳可以用作DNA的来源,因为它具有大量的体细胞,主要是白细胞,而且还含有来自挤奶母牛的上皮细胞,且在所有独立细胞间的结构高度保守[17],含有适用于PCR扩增的基因组DNA[18].
本实验则基于分子生物学技术的发展,建立了提取牛羊乳及其制品中的DNA检测方法,通过聚合酶链式反应对DNA片段进行扩增,再以琼脂糖凝胶电泳来对结果进行检测,具有快速、省时、灵敏度较高的特点.
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
鲜牛乳样品采自西安市未央区草滩奶牛场;鲜羊奶采自陕西省富平县金牛乳品公司;鲜奶于-20 ℃保存备用.纯羊奶粉、纯牛奶粉、全脂奶粉、乳清蛋白粉等市售奶类样品购自西安市不同的超市.
巴氏杀菌乳制作方法采用《NYT 939-2005 巴氏杀菌乳和UHT灭菌乳中复原乳的鉴定》.
牛、羊引物由上海捷瑞生物工程有限公司合成,开盖前经4 000×g离心1 min,使DNA沉在底部,按其管上的OD值加相应的灭菌超纯水,稀释成100μmol/L,分装后再取适量稀释为10μmol/L -20 ℃保存备用,待PCR扩增备用.
1.1.2 主要仪器与试剂
(1)主要试剂:2×PCR Mix、DNA MarkerⅠ、快速DNA提取检测试剂盒、磁珠法血液基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司.
(2)主要仪器:高速冷冻离心机(HC-2518R,杭州华创科学器材有限公司);普通PCR仪(Bio-Rad,伯乐生命医学上海有限公司);琼脂糖水平电泳仪(DYCP-31DN,北京六一生物科技有限公司);电泳图像分析系统(FR-980A,上海复日科技有限公司).
1.2 实验方法
1.2.1 DNA的提取
液态乳DNA除脂采用黎颖等[19]除脂方法,并在此方法上略有改动,液态乳固体乳粉则先加水成为复原乳再依据上述方法.取10.0 mL上述处理好的乳样于离心管中(固体乳粉则称量40.0 mg,溶于10.0 mL蒸馏水中,混匀),在4 ℃ 5 000×g离心30 min.除去离心管上层的乳脂,再次将乳混匀,10 000×g离心15 min,用小勺和无菌棉除去上层乳脂,如此重复两次.再用吸管将上清液吸出,保留最底部的沉淀,用无菌棉球擦除离心管壁上残存乳脂,用2 mL的PBS缓冲液溶解沉淀,并使之悬浮,10 000×g离心10 min,如此重复三次.最后将沉淀溶于500μL PBS缓冲液中悬浮(固体样品最终溶于200μL PBS缓冲液中,混匀),备用.
快速DNA提取方法的建立:采用DNA提取检测试剂盒进行,并按试剂盒说明略作修改进行.取液体样品50μL(乳粉处理后样品为200μL)于1.5 mL的离心管中,加入100μL缓冲液B1(乳粉样品加50μL),确保缓冲液可完全覆盖样品;用研磨杵将样品混匀捣碎;加入100μL缓冲液B2(乳粉样品加50μL),振荡混匀,12 000×g离心2 min;小心吸取100μL上清液于另一干净的1.5 mL离心管中作为模板备用.
磁珠法提取DNA方法的建立:用磁珠法基因组DNA提取试剂盒进行,并按试剂盒说明略作修改进行.取样品400μL样品,加入20μL Proteinase K溶液;加入300μL裂解液GHL,振荡混匀;将离心管置于65 ℃,孵育60 min,期间颠倒混匀3回,每回3~5次;消化完成后置室温放置5 min,再加入350μL异丙醇,振荡混匀10 s后加入20μL磁珠悬浮液G,振荡混匀1 min,共静置9 min,每3 min振荡混匀1 min.将离心管放于磁力架上静置30 s,待磁珠完全吸附后,小心移去液体;取下离心管,加入700μL GDA缓冲液与无水乙醇的混合物(1∶4),振荡混匀5 min;再置磁力架上静置30 s,磁珠完全吸附后,小心吸去液体;将离心管从磁力架上取下,加入700μL PWD漂洗液与无水乙醇的混合物(1∶1),振荡混匀2 min;重复上一步骤,室温晾干后加入100μL洗脱缓冲液TB,振荡混匀,置于56 ℃孵育10 min后将其静置于磁力架上,待磁珠完全吸附将DNA溶液转移至一个新的离心管中,并于4 ℃保存.具体操作按试剂盒说明进行.
1.2.2 引物的选取
本课题涉及到的牛羊源性引物,经查找资料,以线粒体12S rRNA的保守序列设计特异性引物,牛乳和羊乳源性成分扩增选取已报道的引物分别来自Bottero等[20](2003).引物序列如表1所示.
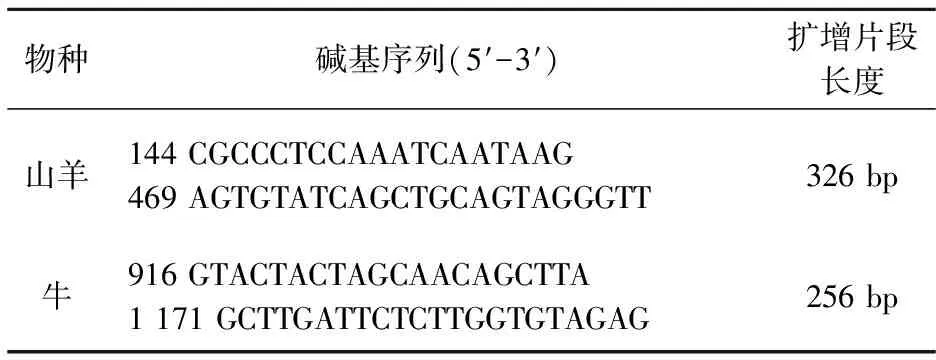
表1 本实验中PCR扩增引物序列
1.2.3 PCR扩增
双重 PCR 体系和反应程序如下:PCR 总反应体系为 25μL;其中模板 DNA 2μL,2×PCR Mix 12.5μL,牛和羊的上下游引物(10μmol/μL)各0.5μL,ddH2O 8.5μL.PCR 反应程序为:94 ℃预变性3 min, 94 ℃变性30 s,45 ℃退火45 s,72 ℃延伸30 s,35个循环;72 ℃后延伸10 min;-20 ℃保存.
1.2.4 琼脂糖凝胶电泳
配制2.5%琼脂糖凝胶,调整电泳仪电压50 V,电泳约120 min,经EB染色30 min,灭菌双蒸水脱色10 min,置凝胶成像分析系统观察结果.本文所有实验均重复三次.
2 结果与讨论
2.1 双重PCR体系的建立
对鲜牛乳及鲜羊乳按照除脂、提取DNA、PCR扩增、电泳等操作方法进行以验证该方法的灵敏度和选取引物是否合理.其结果如图1所示.

M:100 bp Marker;1~2:鲜牛乳;3~4:鲜羊乳;-:双蒸水空白对照图1 牛羊乳的双重PCR电泳方法验证实验
从图1可以清晰地看到,牛羊乳在256 bp和326 bp各自的条带,且牛乳的条带亮度要大于羊乳条带,原因可能是羊乳的蛋白质含量高于牛乳,在蛋白质消化过程中羊乳蛋白未完全消化,提取出的DNA含量较少,反之,牛乳加的缓冲液的量相对较多,应根据实验中具体沉淀物的含量来及时的调整试剂量的多少,以确保实验更加的准确.Rogrigues等[21]选取了牛300 bp和羊444 bp的引物扩增片段,条带暗且不如本研究中图1清晰.通过灵敏度试验,可以看出引物特异性良好,该方法具有较好的作为牛羊乳中DNA提取的检测依据.
2.2 模拟掺假样品中牛源性成分的检测
由于乳中DNA主要来自母体(牛或羊)的乳腺细胞里,含量低,且体细胞的数量又受多方面因素的影响,如,母体动物是否处于哺乳期、乳房健康状况、个体差异及环境的影响等[15,22],故提取乳DNA的质量和纯度对后续实验的开展具有至关重要的作用.常见成本较低的DNA提取方法有有机溶剂提取法[21],如利用苯酚-氯仿-异戊醇来逐级对细胞进行破碎来裂解蛋白质,最后因DNA与醇的相组成不同(DNA为水相,醇为有机相)而得以分离提取,但该方法使用大量有机溶剂,DNA损失较严重,适用于物质中高含量的DNA的提取,故本研究在此基础上利用快速DNA提取法和磁珠DNA提取法进行方法的对比研究.
在纯羊乳中分别掺入50%、25%、10%、5%、1%和0.5%的新鲜牛乳以此作为模拟样品来检测其牛源性成分,并以灭菌双蒸水为空白对照,进而判断检测限,并以此作为市售商品掺假的一个基本的检测依据.并对比两种DNA提取方法(快速DNA提取法和磁珠DNA提取法)的灵敏度及检测阈值的差别,实验结果如图2所示.

(a) 快速DNA提取法

(b) 磁珠DNA提取法M:100 bp Marker;1:纯鲜牛乳;2~7:掺入50%、25%、10%、5%、1%和0.5%的新鲜牛乳的新鲜羊乳;8:纯鲜羊乳;-:空白对照图2 羊乳中掺入牛乳的双重PCR检测
由图2可得出,快速DNA提取法最低可以检测到羊乳中10%的牛乳掺假,磁珠 DNA提取法最低可以检测到羊乳中1%的牛乳掺假.比较可知,使用磁珠DNA提取法检测阈值更低,电泳条带整齐而稳定,DNA提取质量较高,而前者虽操作简单省时,但蛋白质污染较验证,DNA纯度不高,故选用磁珠法进行后续的实验较为准确.
2.3 市售奶制品中牛源性成分的应用性检测
使用磁珠法对含有不同牛乳比例(掺入50%、25%、10%、5%、1%和0.5%的牛乳的巴氏杀菌羊乳)的巴氏杀菌羊乳进行检测,并以灭菌双蒸水为空白对照,其结果如图3所示.由图3可知,条带虽不如鲜乳的DNA稳定规则,但也可检测出掺入1%的牛乳成分.

M:100 bp Marker;1:纯巴氏杀菌牛乳;2~8:掺入50%、25%、10%、5%、1%和0.5%的牛乳的巴氏杀菌羊乳;-:空白对照图3 掺入牛乳的巴氏杀菌羊乳的双重PCR检测
为进一步验证方法的适用性,对四个市售不同品牌的羊奶粉样品,以纯牛羊奶粉作对照,应用建立的方法进行检测,其结果如图4所示.
图4显示,泳道2和5各有两个条带,显示了掺入了牛乳情况,而泳道3仅有牛DNA一个条带,显示了几乎全是牛乳,说明完全掺假,泳道4与泳道1一致,说明未掺假.本课题组在实验室对多个品牌的液态羊乳、全脂奶粉、脱脂奶粉及婴幼儿配方奶粉等16个产品进行了检测,其中网上选购的8个羊乳掺假产品占半数以上,而从羊乳产业大省的陕西本地购买的8个羊乳商品掺假情况则不超过四分之一,故从实际市售样品检测结果来看,为了保护消费者及诚信厂家的权益,羊乳制品的保真性检测非常有意义.
3 结论
本文建立了以牛羊线粒体DNA上的12S rRNA为靶基因而设计针对牛羊特异性的片段的双重PCR检测方法,并以快速法和磁珠法对比,得出使用磁珠法的灵敏度高,DNA纯度较高.此前的研究中,磁珠法多用于提取血液中DNA,本文则首次用该法提取具有复杂的乳成分体系的乳中的DNA,且结果显示,在鲜羊乳及巴氏杀菌羊乳中最低能检测出掺有1%的牛乳的成分,并能直观检测出市售羊奶粉的掺假情况,说明经过一系列加工的奶粉中DNA依然能够稳定存在,为乳品掺假提供了一个可行的方法.
双重PCR因其可以同时对两对引物来扩增两个目的片段,对食品中掺入一个组分来进行特异性检测,操作方便直观,灵敏度高,商业性掺假从利益与风险两方面考虑,一般以5%为限度,本研究1%检测阈值已足够掺假监控检测的要求.但如何应对乳品多组分掺假(非乳源性)的引物设计要求更高,如何化解受电泳样品数限制的大规模普查要求,基于此不足之处,今后应在双重PCR的基础上,建立多组分食品掺假的多重PCR技术及考虑大规模实际应用的荧光定量PCR技术的检测方法,进一步为乳品掺假的监管提供一个方便快捷的技术.
[1] Moore J C,Spink J,Lipp M.Development and application of a database of food ingredient fraud and economically motivated adulteration from 1980 to 2010[J].Journal of Food Science,2012,77(4):118-121.
[2] Rodríguez d R P,Snchezgarcía S,Escudero C,et al.Allergy to goat's and sheep's milk in a population of cow's milk-allergic children treated with oral immunotherapy[J].Pediatric Allergy & Immunology Official Publication of the European Society of Pediatric Allergy & Immunology,2012,23(2):128-132.
[3] Mafra I,Ferreira I M,Faria M A,et al.A novel approach to the quantification of bovine milk in ovine cheeses using a duplex polymerase chain reaction method[J].Journal of Agricultural & Food Chemistry,2004,52(16):4 943-4 947.
[4] Pesic M,Barac M,Vrvic M,et al.Qualitative and quantitative analysis of bovine milk adulteration in caprine and ovine milks using native-PAGE[J].Food Chemistry,2011,125(4):1 443-1 449.
[5] Malmgren B,Ardö Y,Langton M,et al.Changes in proteins,physical stability and structure in directly heated UHT milk during storage at different temperatures[J].International Dairy Journal,2017,71(8):60-65.
[6] Le T T,Deeth H C,Larsen L B.Proteomics of major bovine milk proteins: Novel insights[J].International Dairy Journal,2016,67:2-15.
[8] Dias L A,Peres A M,Veloso A C A,et al.An electronic tongue taste evaluation: Identification of goat milk adulteration with bovine milk[J].Sensors & Actuators B Chemical,2009,136(1):209-217.
[9] Czerwenka C,MüLler L,Lindner W.Detection of the adulteration of water buffalo milk and mozzarella with cow′s milk by liquid chromatography-mass spectrometry analysis ofβ-lactoglobulin variants[J].Food Chemistry,2010,122(3):901-908.
[10] Dan T,Wang D,Jin R L,et al.Characterization of volatile compounds in fermented milk using solid-phase microextraction methods coupled with gas chromatography-mass spectrometry[J].Journal of Dairy Science,2017,4(4):2 488-2 500.
[11] Yang R,Rong L,Dong G,et al.Two-dimensional hetero-spectral mid-infrared and near-infrared correlation spectroscopy for discrimination adulterated milk[J].Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy,2016,157(8):50-54.
[12] Bilge.G.Determination of whey adulteration in milk powder by using laser induced breakdown spectroscopy[J].Food Chemistry,2016,212:183-188.
[13] Santos P M,Pereira Filho E R,Colnago L A.Detection and quantification of milk adulteration using time domain nuclear magnetic resonance (TD-NMR)[J].Microchemical Journal,2016,124:15-19.
[14] Mininni A N,Pellizzari C,Cardazzo B.Evaluation of real-time PCR assays for detection and quantification of fraudulent addition of bovine milk to caprine and ovine milk for cheese manufacture[J].International Dairy Journal,2009,19(10):617-623.
[15] Kamal M,Karoui R.Analytical methods coupled with chemometric tools for determining the authenticity and detecting the adulteration of dairy products: A review[J].Trends in Food Science & Technology,2015,46(1):27-48.
[16] Ganopoulos I,Sakaridis I,Argiriou A,et al.A novel closed-tube method based on high resolution melting (HRM) analysis for authenticity testing and quantitative detection in greek PDO feta cheese.[J].Food Chemistry,2013,141(2):835-840.
[17] Mafra I,Roxo A,Implvo F,et al.A duplex polymerase chain reaction for the quantitative detection of cows′ milk in goats′ milk cheese[J].International Dairy Journal,2007,17(9):1 132-1 138.
[18] Fang X,Zhang C.Detection of adulterated murine components in meat products by TaqMan@real-time PCR.[J].Food Chemistry,2016,192(2):485.
[19] 黎 颖,巫 坚,林 波.羊乳及其制品中掺入牛属牛乳和水牛乳的检测[J].基因组学与应用生物学,2015(5):977-981.
[20] Bottero M T,Civera T,Nucera D,et al.A multiplex polymerase chain reaction for identification of cows,goats and
sheep milk in dairy products[J].International Dairy Journal,2003,13(4):277-282.
[21] Rodrigues N P,Givisiez P E,Queiroga R C,et al.Milk adulteration: Detection of bovine milk in bulk goat milk produced by smallholders in northeastern Brazil by a duplex PCR assay[J].Journal of Dairy Science,2012,95(5):2 749-2 752.
[22] Drummond M G,Brasil B S A F,Dalsecco L S,et al.A versatile real-time PCR method to quantify bovine contamination in buffalo products[J].Food Control,2013,29(1):131-137.
